鞘内注射onasemnogene abeparvovec(OAV101 IT)作为一种潜在的一次性基因转移疗法,旨在为更多的SMA患者提供治疗选择。与基于体重的全身性静脉给药相比,鞘内固定剂量给药可降低病毒载量和全身性载体暴露,同时通过靶向作用机制有望实现与全身给药相当的持久的SMN蛋白表达和疗效。近日,Nature Medicine(影响因子50.0)发表的一项研究评估了鞘内注射OAV101 IT在已停用其他SMA药物的患者中的安全性、耐受性和疗效。结果显示:OAV101 IT在经治SMA患者中表现出稳定的疗效,安全性与以往治疗一致,且未发现新的安全问题。

STRENGTH研究是一项为期52周的3b期、单臂、开放标签、多中心研究,纳入2-18岁、已停用nusinersen或risdiplam的SMA患者。主要纳入标准包括经基因确诊为SMA、具有SMA症状、能够独坐但从未独立行走。受试者需在筛选时接受过至少4次nusinersen或至少3个月risdiplam治疗,并在基线前分别停用nusinersen至少4个月或risdiplam至少15天。
受试者接受单次鞘内注射OAV101 IT,给药前约24小时开始口服
1. 受试者特征
共有27例受试者入组并接受OAV101 IT治疗。所有受试者在入组时均为有症状的患者,最常见的症状为肢体无力(n=26,96.3%)和低
OAV101 IT治疗时的平均(标准差)年龄为7.4(3.35)岁(范围:2.4-17.7岁)。所有受试者均停用了先前的SMN靶向治疗,其中21例停用了nusinersen(77.8%),4例停用了risdiplam(14.8%),以及2例既往接受过nusinersen和risdiplam治疗的受试者(7.4%)。基线时,平均HFMSE评分为24.3分,平均RULM评分为24.6分。
2. 安全性结果
所有受试者(n=27)均经历了至少一次AE,最常见的是鼻
报告的AESI主要包括暂时性血小板减少(n=8,29.6%)、肝毒性(n=4,14.8%)以及可能提示背根神经节(DRG)毒性的体征和症状(n= 2,7.4%)。在暂时性血小板减少类别中,最常报告的不良事件为鼻出血(n=3,11.1%)和挫伤(n= 2,7.4%)。这些事件均为轻度或中度,非严重且已自行缓解。肝毒性事件表现为肝酶水平升高,发生于2-10岁的受试者,程度为轻度至中度,经泼尼松龙治疗后缓解。可能提示DRG毒性的体征和症状包括足部异常感觉(n=1,3.7%)以及前臂、颈部和头皮感觉障碍(n=1,3.7%),均为短暂、轻度、非严重,且未经治疗即自行缓解。
3. 疗效结果
患者的运动功能在52周内保持稳定。从基线到第52周,HFMSE评分的平均(标准差)变化为0.17(2.89;范围:-5.5至7.5),最小二乘均值(LSM)变化为1.05(标准误,0.61;95%CI:-0.21至2.32;Cohen's d:0.36);RULM评分的平均(标准差)变化为0.29(2.85;范围:-6.0至6.0),LSM变化为0.59(标准误,0.55;95%CI:-0.56至1.73)。
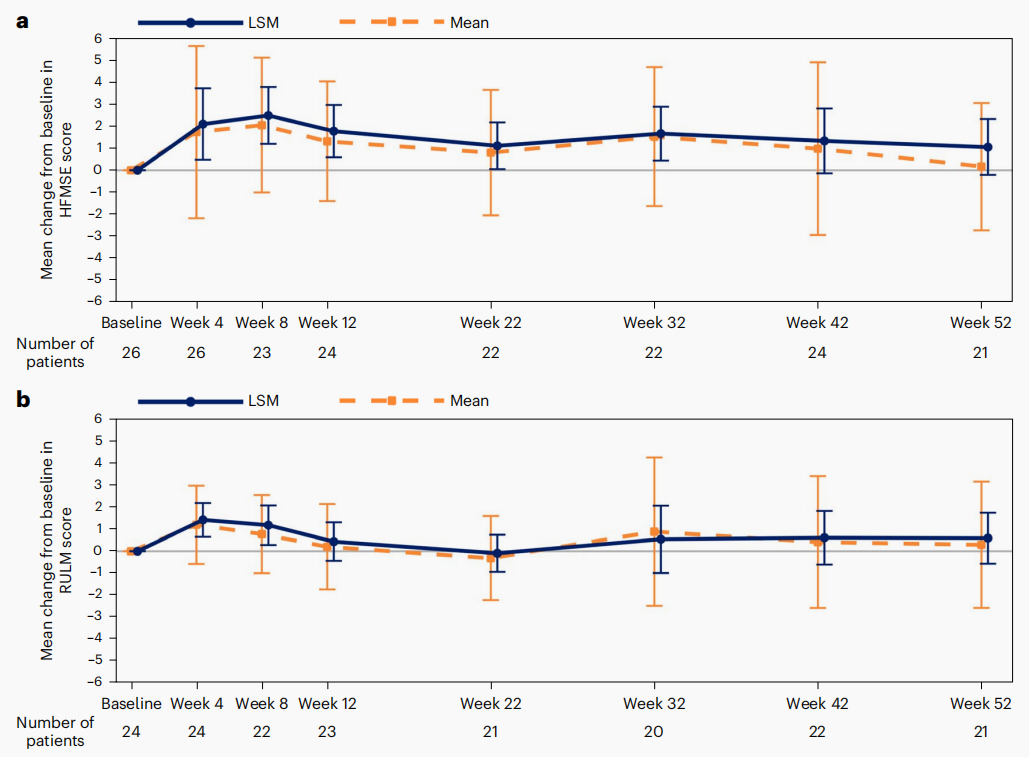
图1 HFMSE和RULM评分较基线的平均变化
照顾者体验评分在52周内也保持稳定。ACEND工具总分的基线变化平均值(标准差)为1.43(9.32;范围:-14.6至20.7);ACEND的调整后LSM变化为1.06(标准误,1.92;95%CI:-2.90至5.02)。探索性终点显示,大部分受试者在第52周时表现出的运动里程碑与基线时相同。
本研究是首个专门针对已停用nusinersen或risdiplam治疗的SMA患者,评估鞘内注射OAV101 IT的安全性、耐受性与疗效的临床研究。结果表明,对于已停用nusinersen或risdiplam、具有不同治疗时长和基线运动功能水平的SMA患者,鞘内注射OAV101 IT展现出良好的安全性,其安全特征与初治患者一致,并能维持运动功能和照顾者体验的稳定。因此,OAV101 IT可能成为SMA患者的另一种治疗选择。
参考文献:
1. Kwon JM, Munell F, Le Goff L, et al. Intrathecal onasemnogene abeparvovec for treatment-experienced patients with spinal muscular atrophy: a phase 3b, open-label trial. Nat Med. 2025 Dec 8. doi: 10.1038/s41591-025-04119-2.
医脉通是专业的在线医生平台,“感知世界医学
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)