
早期前体急性T淋巴细胞白血病(ETP-ALL)是急性T淋巴细胞白血病(T-ALL)中高度侵袭性的高危亚型,具有复杂的遗传背景和显著的治疗抵抗特征。现有诊断主要依赖免疫表型标准,但其与疾病内在分子特征并不完全匹配,限制了精准分型和靶向治疗策略的制定。因此,亟需从多组学层面系统解析ETP-ALL的分子本质。作为连接基因组与临床表型的关键桥梁,蛋白质组学正成为破解血液肿瘤异质性、驱动精准诊疗的核心范式。
2026年2月4日,浙江大学医学院附属第一医院


01
研究内容
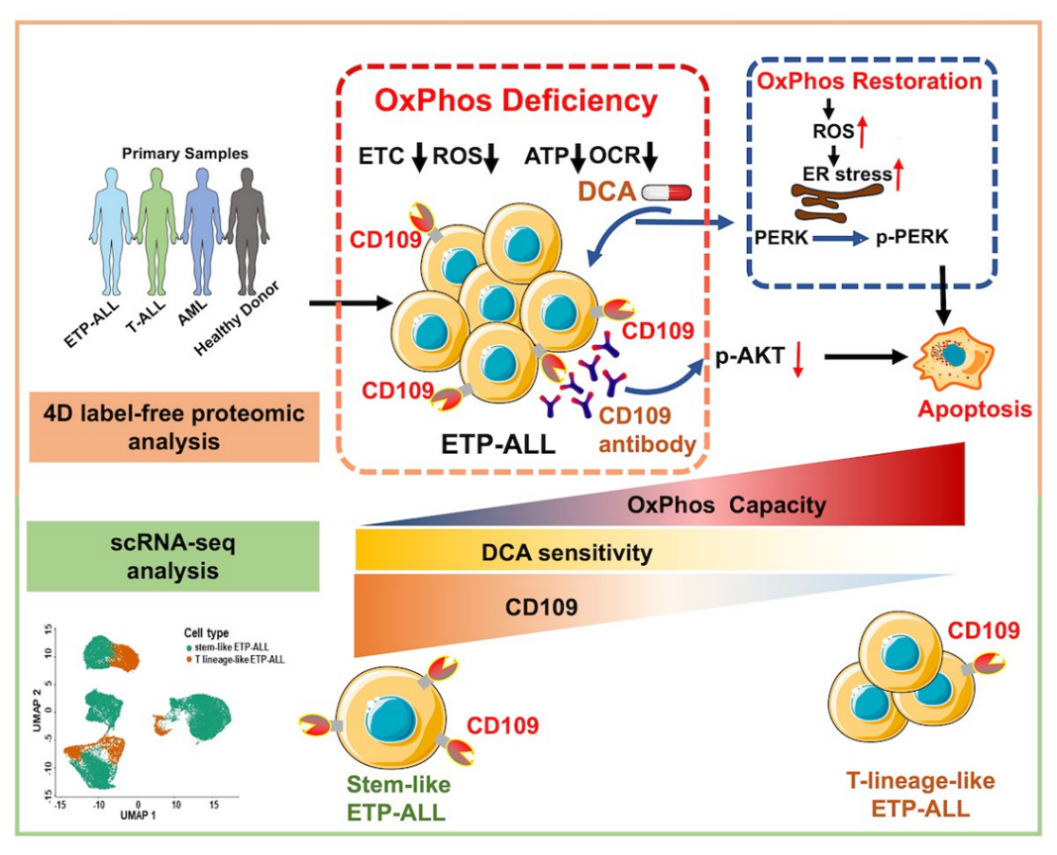
研究首先通过深度蛋白质组学筛选发现,ETP-ALL存在以氧化磷酸化功能缺陷为核心的代谢重编程特征。尤其在ETP-ALL的干细胞样亚群中,表现出显著的线粒体功能低下。随后,团队通过一系列功能实验验证了这一组学发现:ETP-ALL细胞的线粒体呼吸、ATP合成及氧耗水平均明显降低,并伴随线粒体膜电位及线粒体DNA拷贝数的下降。
基于这一代谢“弱点”,研究提出了一种潜在的治疗新策略。研究发现,氧化磷酸化激活剂二氯乙酸(DCA)能有效逆转ETP-ALL的代谢缺陷,通过恢复氧化磷酸化水平促使活性氧积累,进而诱导内质网应激并激活PERK信号通路,最终触发白血病细胞凋亡。在异种移植动物模型中,DCA显著降低了肿瘤负荷并延长了生存期,且表现出良好的安全性,对正常造血系统未见明显毒性。
此外,研究通过蛋白质组学发现CD109为ETP-ALL的关键生物标志物。CD109对ETP-ALL的诊断具有特异性,且在ETP-ALL的干细胞样亚群表达更高,氧化磷酸化水平更低,对DCA更敏感。靶向CD109的抗体可以进一步引起ETP-ALL细胞的凋亡。
02
研究结论
综上,该研究首次揭示了ETP-ALL以氧化磷酸化缺陷的代谢特征,进一步提出了靶向线粒体代谢弱点的治疗策略,并发现与这一代谢特征密切相关的,兼具诊断与治疗价值的关键生物标志物CD109。研究不仅深化了对ETP-ALL发生发展机制的认识,也展示了以蛋白质组学为核心的多组学整合策略在复发难治白血病精准分型、靶点发现及个体化治疗中的重要应用前景。
同济大学刘苗苗博士、陈天一博士和浙江大学医学院附属第一医院林祥杰医生为共同第一作者,浙江大学医学院附属第一医院王华锋教授、同济大学祝颖慧研究员与浙江大学医学院附属第一医院金洁教授为共同通讯作者,该研究获得浙江大学医学院附属第一医院黄金艳教授团队及中国医学科学院
原文链接:https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(26)00003-0
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)