在肿瘤生物学的历史上,很少有概念能像“Hallmarks of Cancer”这样深刻地重塑整个领域的思维方式:2000 年和 2011 年,Hanahan 与 Weinberg 先后在《Cell》发表两篇里程碑式综述,把原本纷繁复杂的癌症现象提炼成一套可操作的功能框架,成为基础研究、药物开发和临床实践共享的“通用语言”;2026 年,Hanahan 又以《Hallmarks of cancer—Then and now, and beyond》登上《Cell》,在前两部奠定的基础上,将这一框架升级为面向精准治疗的“四维指路灯”。
对制药和转化研究来说,hallmarks 同样提供了一套更高维度的“选靶与配伍坐标系”。过去设计新药,往往是从单一通路、单一分子出发,思考“这个靶点在某个癌种里是否够热门”;而在 hallmarks 视角下,更重要的问题变成了:它在整张功能版图上补的是哪一块短板,是否与现有药物形成互补的共靶组合,能否在“持续增殖、血管生成、代谢重编程、免疫逃逸、基因组不稳定”之中构建出具有协同潜力的多药打击网络。对药企而言,这意味着不再只是“往同一条通路上堆更强的单药”,而是可以围绕具体 hallmark 组合去规划双靶、多靶分子和固定剂量联合方案,把研发管线从早期就嵌入一个可解释、可扩展的机制蓝图中,从而在临床试验阶段更有针对性地选择人群、预判耐药路径,并设计出真正有机会重塑自然史的组合策略。
Douglas Hanahan 是这套 “Hallmarks of Cancer” 框架背后的灵魂人物。1951 年出生于美国西雅图,本科就读于 MIT 并主修物理,随后在哈佛大学完成生物物理学博士训练,早年在冷泉港实验室参与分子克隆与早期肿瘤基因研究,使他从物理和生物物理跨入分子肿瘤学一线。此后,他先在冷泉港担任独立课题组长,又在加州大学旧金山分校工作二十余年,建立了一系列器官特异性肿瘤的转基因小鼠模型,奠定了多步骤肿瘤发生的经典模式。2009 年起,他迁至瑞士洛桑,执掌洛桑联邦理工学院旗下的瑞士实验癌症研究所(ISREC),并在瑞士癌症中心 Leman 和 Ludwig 癌症研究所洛桑分部担任重要学术职务,持续推动肿瘤微环境与系统层面研究。凭借在实验模型与概念框架两端的深远影响,他先后当选美国国家科学院与医学院、美国艺术与科学院、EMBO 等顶级学术机构院士,并获得包括 AACR 终身成就奖在内的多项重要荣誉,成为当代肿瘤生物学公认的领军人物之一。
2000 年,Hanahan 和 Robert Weinberg 在《Cell》上发表了第一篇《The Hallmarks of Cancer》,为癌症找到了6个最核心的“共同特征”:持续的增殖信号、逃避生长抑制、抵抗细胞凋亡、获得无限复制能力、促进血管生成,以及具有侵袭和转移的能力(见下图)。真正让这篇论文具有里程碑意义的,并不是这几个描述本身,而是它提供了一种全新的看问题的方式——原本看似无比复杂、差异巨大的肿瘤类型,其实都可以被归纳为有限数量、彼此关联的功能模块。从那以后,科研人员在发现一个新的基因或信号通路时,可以直接把它放入相应的“hallmark”范畴中去理解;药物研发者能据此思考“这款药具体目标在哪个模块”;而临床医生和学生也有了一个跨癌种、跨学科的共同语言,能清楚地解释肿瘤为什么会生长、转移、复发或耐药。因为把庞杂的癌症生物学高度提炼成一套简洁且实用的框架,这篇论文在 Google Scholar 上的引用量至今超过 4万次,对癌症研究和药物开发的思维方式都产生了深远影响。
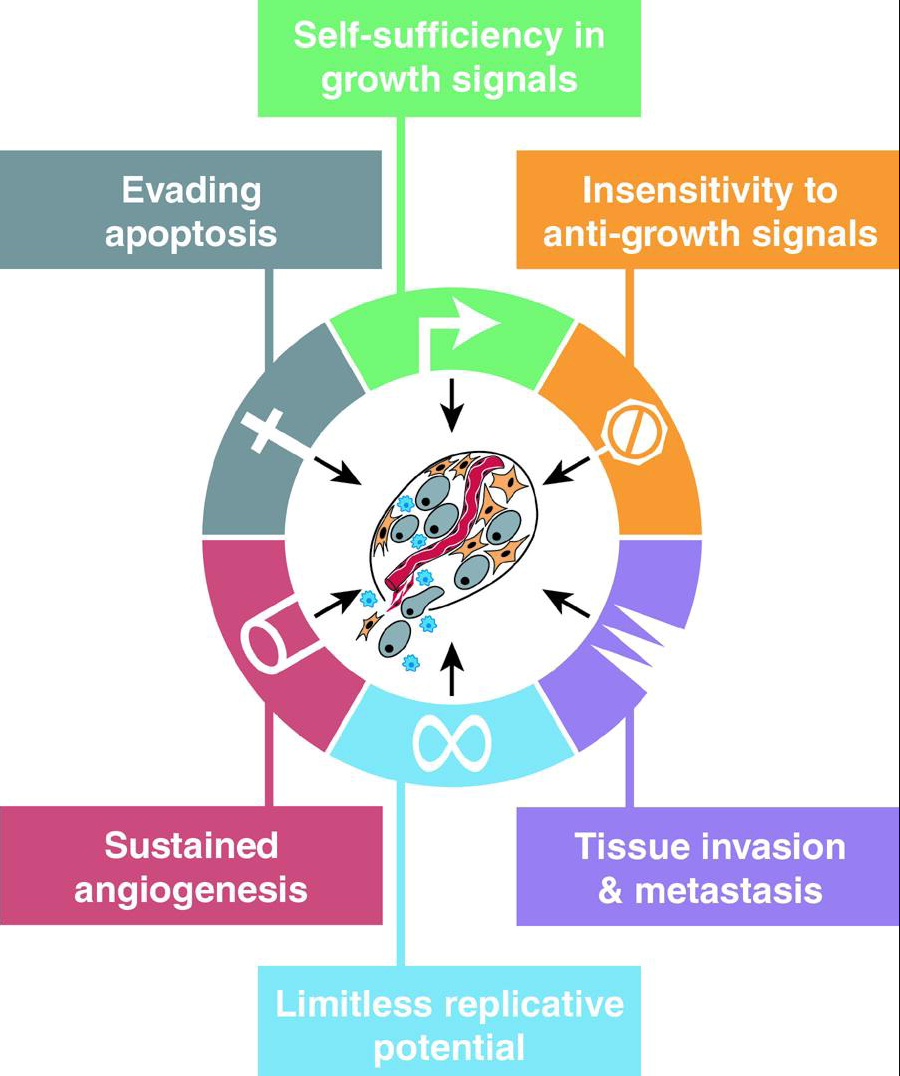
2011 年,Hanahan 和 Weinberg 在《Cell》再次发表重磅综述《Hallmarks of Cancer: The Next Generation》,可以看作他们“癌症特征”框架的升级。在原本的六大核心特征基础上,他们新增了两项重要功能:代谢重编程和逃避免疫破坏。同时,他们还提出了两种“赋能表型特征”——基因组不稳定和肿瘤促发炎症,用来解释癌细胞获得这些特征的根本动力。
这次更新有两个关键意义。首先,它让此前被视为“附属现象”的代谢和免疫研究,成为理解癌症的中心议题——肿瘤代谢不再只是课本里“Warburg 效应”的经典故事,而被重新定义为癌细胞维持增殖和生存的核心引擎;肿瘤免疫逃逸也被纳入统一的框架,成为后来免疫检查点抑制剂、CAR‑T 等治疗策略的重要理论基础。此外,基因组不稳定与炎症这两个“赋能特征”说明了肿瘤的自我演化能力:它们让癌细胞在不断积累新的突变、改造免疫反应和微环境的过程中,持续获得其他功能优势。对制药业来说,这意味着以往看似独立的抗血管生成、PARP 抑制、代谢干预、免疫治疗等方案,其实都只是针对不同“癌症特征”的平行策略;而对临床医生而言,这个“八大特征 + 两种赋能”的整体框架,则提供了一种更清晰的方式,去理解各种癌症的发生、复发与耐药规律。

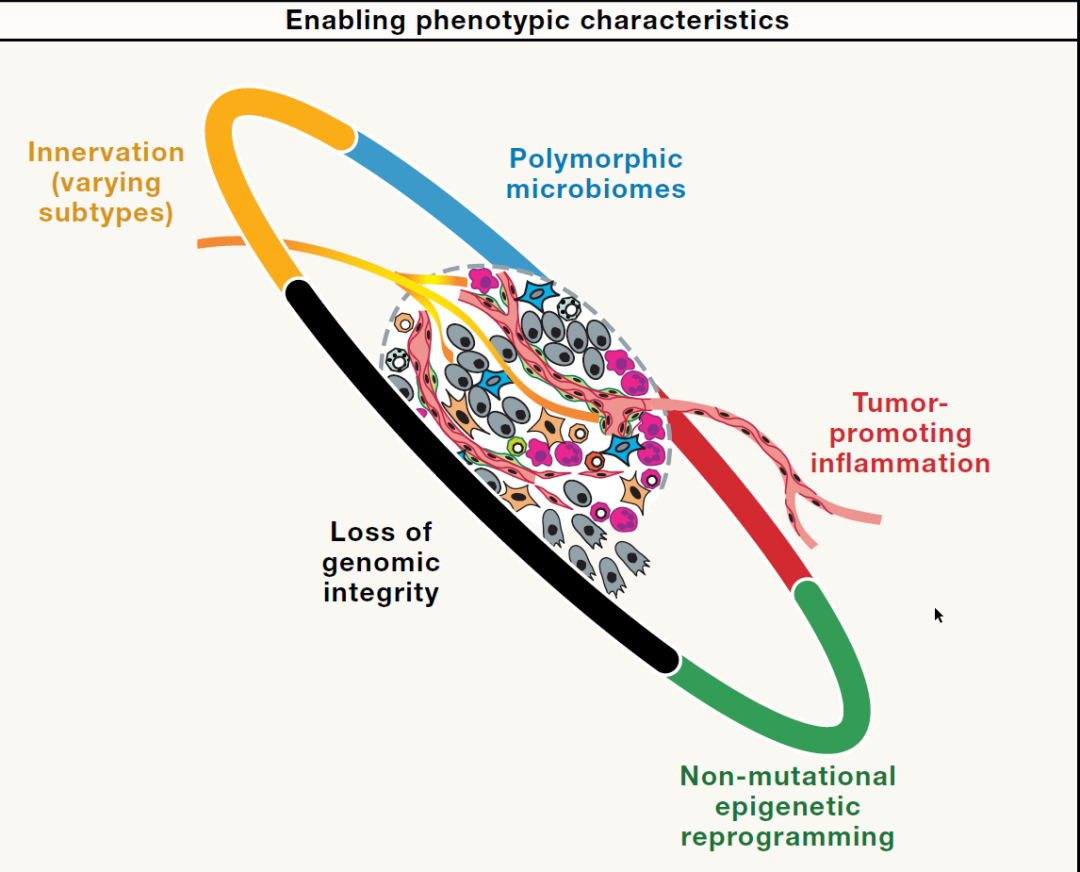
Hanahan还提出了一个由 四个相互关联的维度组成的新框架(下图)。在这个体系中,第一维是那九个获得性功能;第二维是支撑它们的五个赋能表型特征。第三维则聚焦于执行这些功能的各种肿瘤微环境细胞,既包括癌细胞本身,也包括血管细胞、癌相关成纤维细胞、免疫细胞(如巨噬细胞和中性粒细胞)、神经元及其轴突,甚至衰老细胞等。第四维进一步延伸到癌症与机体整体之间的联系——涵盖全身的代谢、免疫、内分泌系统,以及与之共同作用的微生物组。通过这样的“四维整合”,Hanahan 让原本的“平面式肿瘤特征清单”,升级为能同时描述细胞、微环境和系统互作的“立体机制地图”。
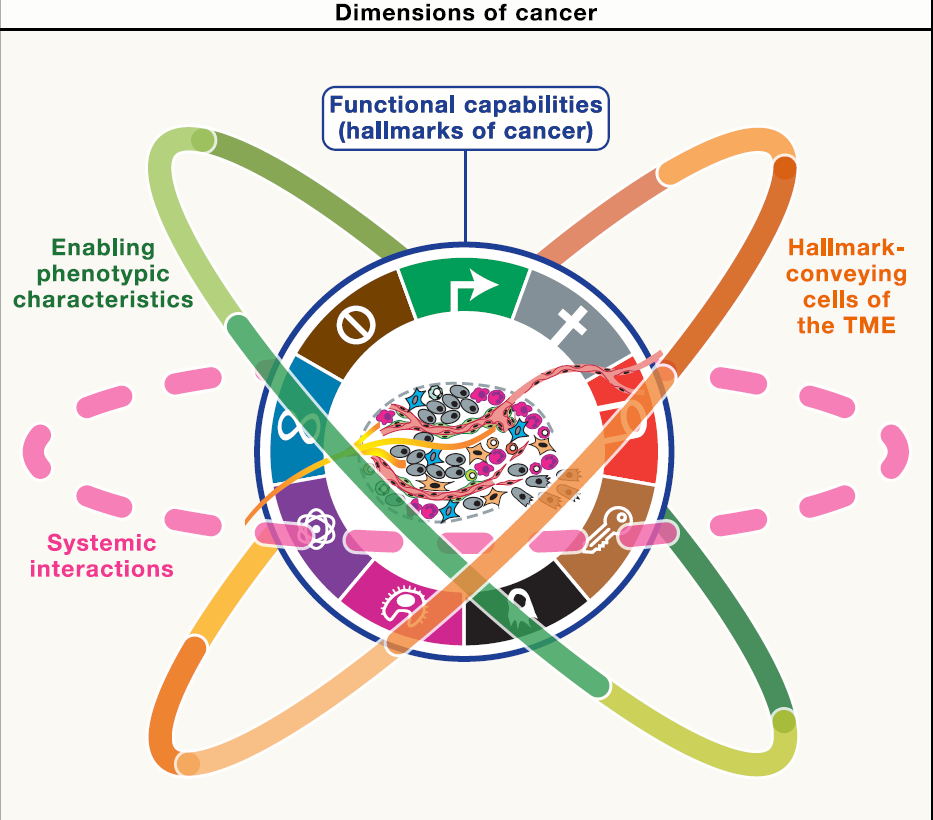
在科研应用上,这个新体系与当今的多种前沿技术天然契合,比如单细胞组学、空间转录组、系统生物学以及 AI 病理分析。研究者可以在这个“九大核心功能 + 五大赋能特征 + 细胞类型 + 系统互作”的坐标体系中,为每一种细胞亚群、信号通路或系统级变化找到清晰的位置。
从概念演化的角度来看,这篇论文延续了前两次重要飞跃:2000 年那次把癌症从杂乱无章的现象中提炼为六大功能,2011 年加入代谢和免疫元素;而这一次,则是第三次转型——把“列表式描述”真正进化为“多维机制版图”,把过去零散的概念(如神经支配、微生物组影响)整合进统一的整体结构中。
更值得注意的是,这篇 2026 年的论文在治疗思路上迈出了关键一步——让 hallmarks 从理论框架走向了真正“可操作”的应用。Hanahan 在文末提出一个面向未来的构想,称为 “机制引导的 hallmarks 共靶(mechanism‑guided hallmark co‑targeting)”。他指出:不同的肿瘤特征在机制上各自独立,却又在癌症演化中彼此配合,因此仅靠单一靶点药物难以撼动整个系统。更有前景的策略,是根据 hallmarks 的整体框架设计 联合疗法 ——用多种药物同时打击两个或多个关键功能环节。
实际上,这种思路在现有治疗中已有雏形。例如,PARP 抑制剂与抗血管生成药的联合,可以理解为同时针对“基因组不稳定”与“获得血管供应”;免疫检查点抑制剂联合代谢调控药或抗血管生成药,则对应“免疫逃逸 + 代谢 / 血管”这类双重打击。他更进一步提出一种系统性组合策略:同时解除 T 细胞疲劳,并重塑免疫抑制性的肿瘤微环境。也就是说,在阻断 PD‑1 / PD‑L1 等检查点的同时,药物作用于癌相关成纤维细胞、肿瘤相关巨噬细胞和中性粒细胞等,从整体上拆除免疫抑制网络,而不仅仅是“松开刹车”。这种从“单药对单基因”到“多药对多机制模块”的转变,为制药公司开发双靶、多靶药物和固定剂量联合方案提供了清晰的理论蓝图,也为临床试验设计开辟了新路径——医生可以依据 hallmark 功能模块来分层患者,而不再仅依赖肿瘤部位或单一分子标志物。
审校:Faline
排版:Faline
执行:Faline
医脉通是专业的在线医生平台,“感知世界医学
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)