近期,《nature reviews nephrology》发表重磅综述“Next-generation therapeutics for diabetic kidney disease”(IF=39.8),介绍了当前DKD指导性药物治疗(GDMT)的核心策略,并深入剖析了下一代靶向药物的探索路径与临床前景。本文整理文章核心内容,以飨读者。

DKD GDMT核心策略
当前DKD管理策略主要基于四大GDMT支柱:肾素-血管紧张素-醛固酮系统抑制剂(RAASi)、钠-
目前认为,SGLT2i、GLP-1RA及nsMRA通过发挥多重效应,对DKD产生肾脏保护作用(图1)。
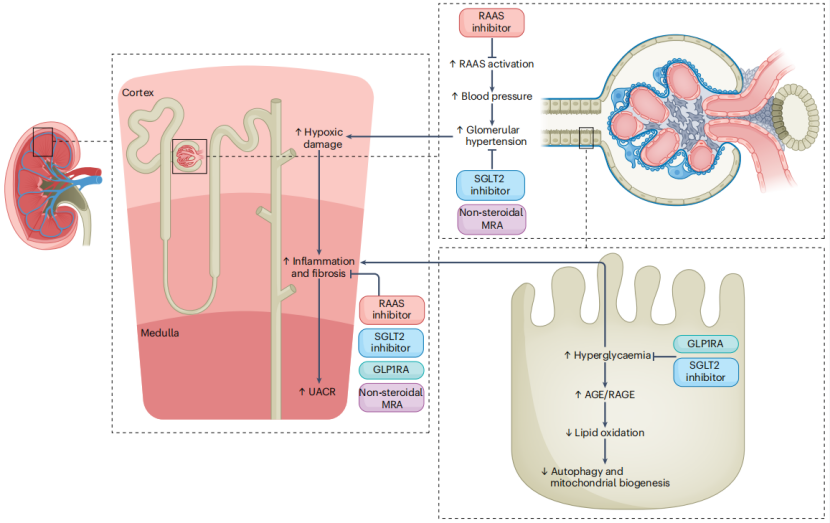
图1 DKD指导性药物治疗的作用机制
RAASi、SGLT2i、nsMRA以及GLP-1RA通过在肾脏内不同部位的多重作用,发挥多效性肾脏保护效应。AGE,晚期糖基化终末产物;RAGE,晚期糖基化终末产物受体。
DKD的新型治疗手段
当前临床试验正在评估的干预措施涵盖多种肠促
迄今为止,多数肠促胰素相关研究聚焦于GLP-1RA,证实其可改善肥胖、糖尿病及心肾结局。新近证据显示,葡萄糖依赖性促胰岛素多肽(GIP)、胰高血糖素及胰淀素等其他肠促胰素激素同样具有治疗潜力。这些激素通过减少摄食、增加能量消耗与脂肪氧化、促进胰岛素分泌等多重代谢效应,成为减重、改善代谢功能障碍相关脂肪性肝病及血糖控制的理想干预靶点。
胰高血糖素样肽-1、葡萄糖依赖性促胰岛素释放肽及胰高血糖素三重受体激动剂。胰高血糖素由胰腺α细胞分泌,主要通过促进肝脏葡萄糖生成而升高血糖。GLP-1联合输注可拮抗该效应,同时增强胰岛素分泌。胰高血糖素受体激动作用还可抑制食欲、增加静息能量消耗,从而减轻体重。此外,其能刺激脂肪酸氧化与肝脏脂解、抑制肝脏脂肪生成、增强胆固醇代谢。相较于单受体或双受体激动剂,GLP-1、GIP与胰高血糖素受体三重激动剂有望实现更优的体重管理和血糖控制。
胰淀素类似物与GLP-1RA联合疗法。胰淀素是由胰岛β细胞与胰岛素同步分泌的一种肽类激素。其受体主要分布于脑干,在调节餐后饱腹感方面发挥关键作用。此外,胰淀素还可抑制胰高血糖素释放,并延缓胃排空。
肽YY。肽YY与GLP1均由肠道L细胞在进食后共分泌,不仅具有抑制食欲的关键作用,还可能促进胰腺β细胞存活。外源性肽YY输注可降低肥胖者的食欲及24小时热量摄入。然而,其在DKD治疗中的有效性与应用价值,仍有待进一步研究证实。
CB1受体阻断。CB1受体广泛分布于肾单位各节段(足细胞、系膜细胞、内皮细胞、近/远端小管、髓袢升支粗段及闰细胞)。DKD中CB1受体表达上调,其激活可加剧肾脏纤维化,提示CB1在DKD发病中具有关键作用。
▶ 内皮素受体拮抗剂
内皮素(ET)系统由ET-1、ET-2和ET-3三种肽类构成,是
三种亚型中,ET-1是主要存在形式,因在肾脏髓质高表达并调控肾及肾小球血流动力学,成为与肾脏生理最相关者。肾脏中ET-1激活可促进细胞增殖、炎症反应及细胞外基质沉积,进而导致肾小球与肾小管间质纤维化、
醛固酮为肾上腺球状带分泌的盐皮质激素,是RAAS通路的终末效应分子。其主要通过激活肾远曲小管与集合管的上皮钠通道及钠钾ATP酶,调控钠钾稳态。醛固酮失衡可诱发高血压、炎症反应与纤维化,进而推动心血管、血管及肾脏疾病进展。在肾脏中,醛固酮活性增强可导致炎症浸润、肾小球硬化、肾小管间质纤维化及足细胞损伤,加速蛋白尿形成与CKD进展。
醛固酮的下游效应包括两类通路:经典的基因组型(盐皮质激素受体依赖)与非基因组型(非盐皮质激素受体依赖)。其中非基因组效应已在肾上皮、动脉平滑肌及心肌细胞中得到验证,可直接介导炎症与血管收缩。在盐皮质激素受体被阻断状态下,循环醛固酮水平代偿性上升可能放大该效应。传统甾体类MRA,如螺内酯,作为ACEi/ARB的附加治疗,已被证实能降低DKD患者的蛋白尿与血压。然而,其临床广泛应用受限于激素相关不良反应(男性乳房发育、阳痿、溢乳)及高钾血症风险升高——后者在已使用ACEi/ARB的CKD患者中尤为突出。
针对醛固酮的效应,除阻断盐皮质激素受体外,另一干预策略是靶向其上游信号通路。由于在受体被拮抗的情况下,醛固酮仍可能通过非基因组途径发挥效应,因此,应用醛固酮合成酶抑制剂可通过同时抑制基因组与非基因组通路,带来额外的临床获益。
▶ 可溶性鸟苷酸环化酶激活剂
一氧化氮(NO)-可溶性鸟苷酸环化酶(sGC)-环磷酸鸟苷(cGMP)通路是心血管、肺与肾脏功能的关键调节枢纽。NO弥散进入细胞后与胞质sGC结合,催化生成cGMP,进而维持血管张力,并发挥抗纤维化、抗炎效应。该通路受损如内皮功能障碍所致NO生物利用度下降,已被证实参与心力衰竭及CKD的发生发展。
数十年来,NO-sGC-cGMP通路始终是药物干预的重要靶点,相关药物涵盖硝酸酯类(抗心绞痛)、磷酸二酯酶抑制剂(勃起功能障碍、肺动脉高压)及脑啡肽酶抑制剂(心力衰竭)。通过提升cGMP水平发挥作用的sGC激活剂与刺激剂,在糖尿病合并CKD及心血管疾病中展现出潜在治疗价值。临床前研究显示,在肾小球肾炎模型中激动sGC可促进cGMP生成,从而改善肾脏炎症、纤维化、肾小球通透性及肾血流量。
▶ 靶向炎症通路的治疗
先天免疫细胞的浸润,以及促炎细胞因子、趋化因子、黏附分子和生长因子的上调,在DKD发生发展中发挥关键作用。蛋白质组学分析已识别出与肾衰竭进展相关的循环炎症蛋白特异性特征谱。在肾脏局部,炎症可导致足细胞、肾小管上皮细胞及内皮细胞损伤,进而损害肾脏灌注、肾小球滤过与肾小管重吸收功能,最终促进肾小管间质纤维化。
尽管靶向炎症通路的治疗策略已取得进展,但许多在临床前模型中验证的靶点未能转化为临床获益。选择性抑制炎性细胞因子通路在风湿性疾病中疗效确切,然而DKD涉及多重且具有冗余性的信号通路,该策略在DKD中疗效可能有限。相较于现有疗法,干预更上游炎症信号能否提供额外临床获益,是未来研究的重要方向。
▶ 间充质干细胞疗法
间充质干细胞(MSC)在T1DM、T2DM及DKD中展现出潜在的抗炎与抗纤维化效应。尽管目前仍需大规模随机对照试验以明确MSC疗法在DKD中的疗效与安全性,但现有证据已提示其具备显著的治疗潜力。
未来方向
DKD的诊疗正迈入变革与转型的关键阶段。当前的研究重点主要聚焦于以下方向:
在高风险人群中评估GDMT:包括T1DM患者、重度CKD及肾衰竭患者、系统性自身免疫病患者以及肾移植受者。
探索新型治疗靶点:重点关注晚期糖基化终末产物(AGEs)及其受体系统,以及DKD发病相关的基因变异与表观遗传学改变。
运用创新方法学优化治疗策略:适应性平台试验为高效评估DKD新型治疗方案及联合用药策略提供了富有前景的方法学路径。同时,人工智能(AI)有望在DKD诊疗优化中发挥变革性作用,其潜在应用包括:基于电子健康档案开发标准化、自动化的DKD识别算法,推动早期靶向干预,改善患者预后;此外,AI模型还可用于预测DKD疾病进展及并发症风险,精准识别需强化个体化管理的高危人群。
参考文献:
Yi TW, Sridhar VS, Scott J. et al. Next-generation therapeutics for diabetic kidney disease. Nat Rev Nephrol (2026). https://doi.org/10.1038/s41581-025-01042-0.
点击“阅读原文”,查看文献
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。仅供HCP观看。


(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)