导读
近日,上海市第六人民医院风湿免疫科
研究依托英国生物银行,纳入超50万名参与者(年龄37–73岁)数据,通过健康问卷、体格检查与生物样本采集进行全面评估。研究基于英国生物银行的首次诊断数据定义DJD暴露,基线时诊断为DJD的个体被定义为暴露组,无DJD诊断的个体作为对照组。基线后新发的DJD病例被视为时变暴露处理。通过多变量Cox回归模型,在逐层校正人口学、生活方式与合并症等因素后,评估DJD与全因痴呆(ACD)、
最终队列共包含500,805名参与者,以基线时三种主要影响人群健康的DJD——
两组人群在基线时具有不同的特征分布(表1)。与无DJD者相比,平均年龄(59.65岁 vs. 55.81岁),女性(59.0% vs. 53.3%),高加索人种(95.5% vs. 93.6%)比例更高,教育水平稍低,最贫困层级占比更高(26.3% vs. 24.6%)。肥胖(33.2% vs. 22.3%)、吸烟:49.3% vs. 43.9%)比例更高;
表1 研究人群的基线特征。
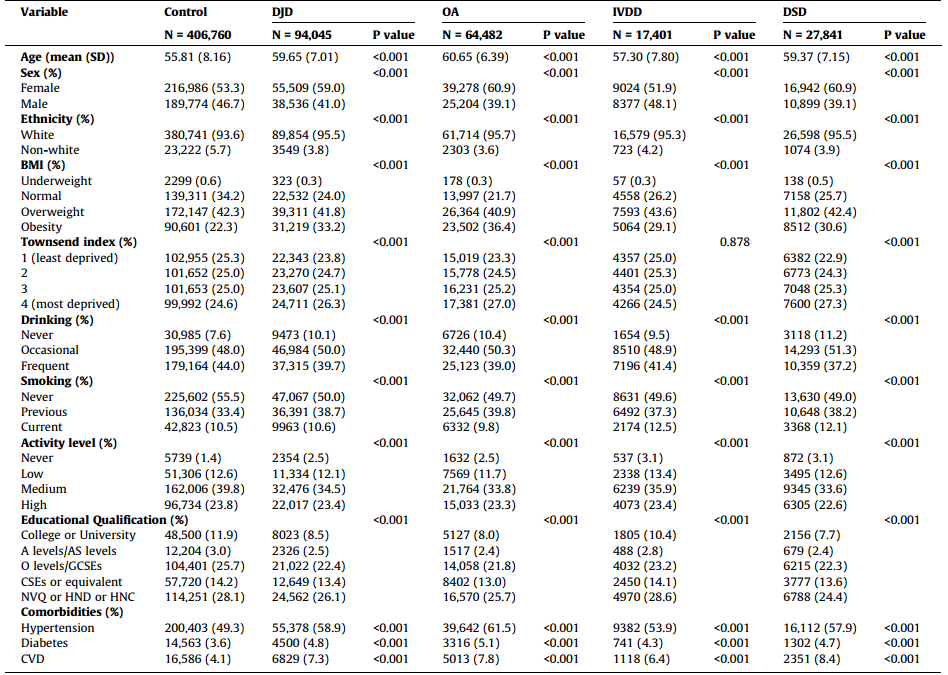
经过中位14.45年的随访,研究发现DJD显著增加ACD和VaD的发病风险(HR分别为1.271和1.587),但与AD无显著关联(图1)。
进一步分析显示,各DJD亚型(骨关节炎(OA)、椎间盘退行性变(IVDD)和退行性脊柱疾病(DSD))均与ACD风险升高相关,其中IVDD对VaD的风险影响尤为突出(HR=2.156,95% CI:1.603–2.899)(图2)。研究还发现,伴有疼痛症状的DJD患者其ACD风险更高(HR=1.597,95% CI:1.432–1.782),且该关联在年轻(<55岁)、体力活动不足或曾接受手术的人群中更为显著。所有关联均经过敏感性分析与倾向评分匹配(PSM)验证,结果稳健。

图1.使用多变量校正的考克斯比例风险模型估计DJD和痴呆风险之间的关联。
(A-C)与DJD相关的ACD(A)、AD(B)和VaD(C)风险的HR。拟合了三个模型:模型1校正基线人口统计学模型2额外调整了种族、教育资格、汤森指数、吸烟状况、饮酒和体力活动;模型3进一步调整了合并症(高血压、糖尿病和
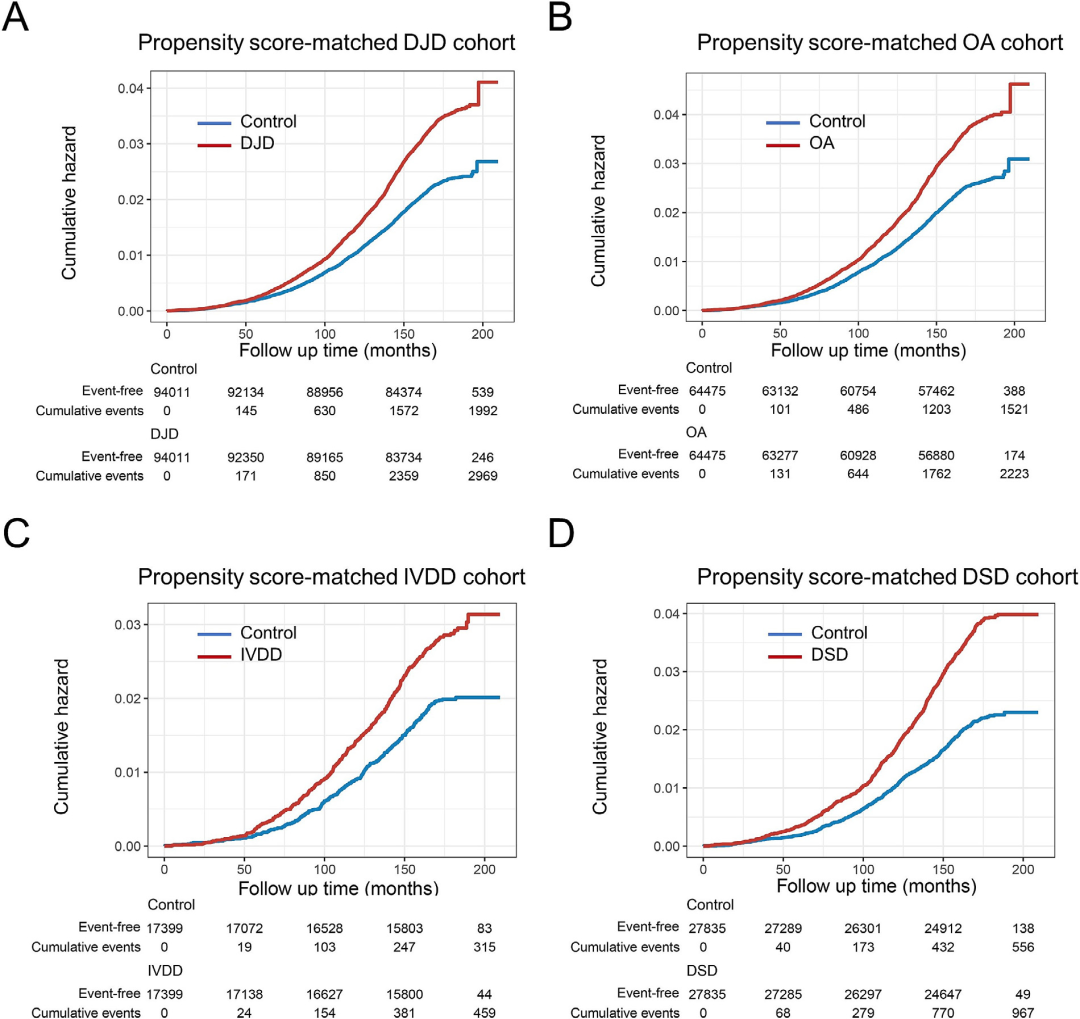
图2.不同DJD亚型与ACD风险之间的关系,使用PSM(A-D)。
累积风险曲线说明了随访期间DJD(A),OA(B),IVDD(C)和DSD(D)以及匹配对照组的ACD风险。匹配是基于年龄,性别和种族,教育资格,汤森剥夺指数,吸烟状况,饮酒,身体活动、高血压、糖尿病和CVD。在每个图下方提供了无事件个体和累积事件的数量,以指示不同随访间隔的样本量和事件发生率。
蛋白质组学分析揭示了连接DJD与ACD的关键血浆蛋白。中介分析识别出18种显著介导蛋白,其中HAVCR1、GDF15和COL6A3的中介比例最高,分别达到52.6%、22%和14.3%。
进一步分析显示,DJDs患者存在系统性的血浆蛋白表达改变:COL9A1、LEP、FABP4等蛋白普遍上调,而IFGBP1等蛋白下调。这些变化在OA、IVDD和DSD各亚型中既存在共性(共371种蛋白在所有DJD亚型中均上调),也呈现亚型特异性。功能上,这些差异蛋白显著富集于免疫炎症反应、细胞因子信号、细胞粘附与补体系统等通路,共同构成了连接关节退变与神经退行性变的复杂炎症与细胞过程网络。
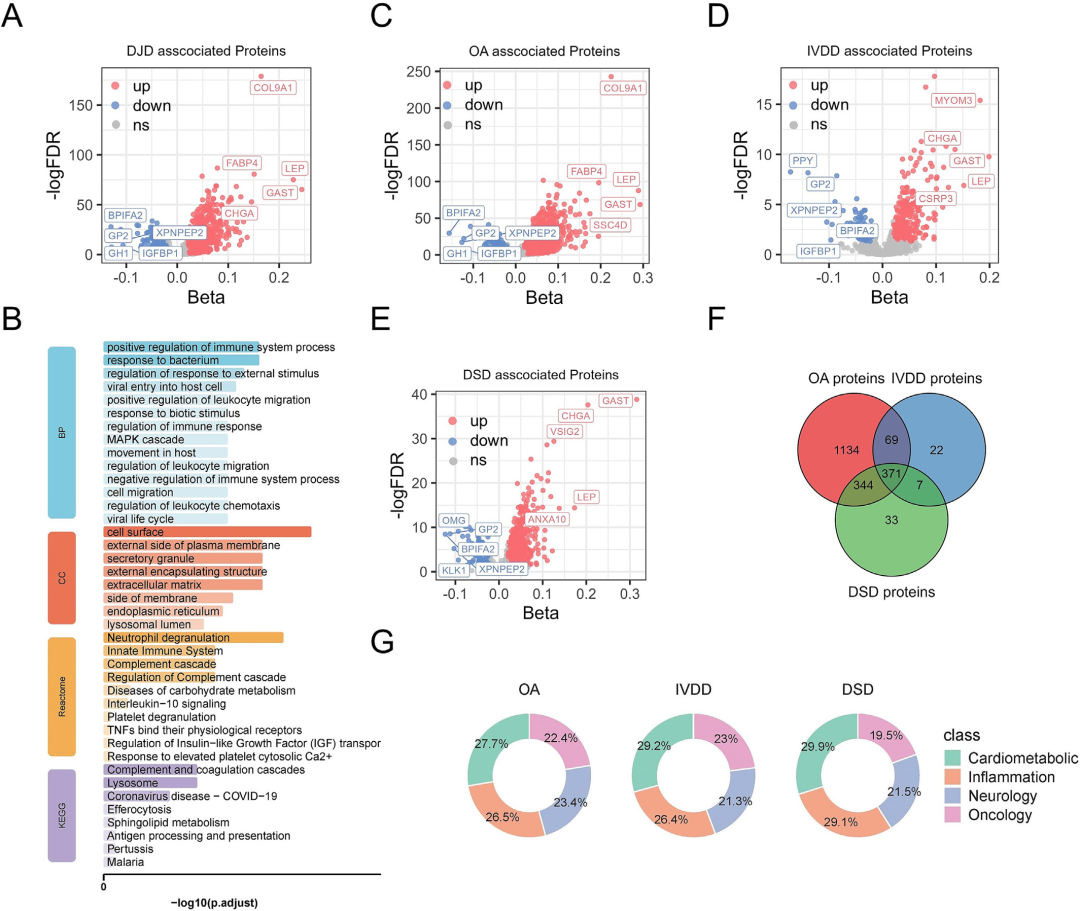
图3.与DJD相关的蛋白质的鉴定和功能富集。
(A)显示通过多元线性回归鉴定的与DJD相关的蛋白质。(B)按BP、CC、MF、Reactome和KEGG途径(C-E)通过多元线性回归鉴定的与OA(C)、IVDD(D)和DSD(E)相关的蛋白质(F)不同DJD之间蛋白质的重叠。(G)每种疾病相关的蛋白质类别(心脏代谢、炎症、神经学、肿瘤学)的分布。红点和蓝点分别表示上调和下调的蛋白质;缩写BP:生物过程;CC:细胞组分;MF:分子功能。
通过Cox回归分析,研究识别出820种与ACD风险显著相关的血浆蛋白。其中,MENT、GFAP、NEFL、PLAUR和GDF15等蛋白与风险升高相关,而APOE、EGFR等蛋白则与风险降低相关。这些蛋白主要富集于伤口愈合、Rap1/MAPK信号、细胞因子互作及细胞外基质组织等通路,提示神经炎症、细胞信号传导及细胞外基质重塑在ACD发病中的重要作用。
进一步分析显示,关键蛋白与ACD风险之间存在复杂的剂量-反应关系:MENT、GFAP和NEFL呈非线性关联,而GDF15、PLAUR等也表现出非线性模式,表明蛋白质表达影响ACD风险的机制具有多样性与动态特征。
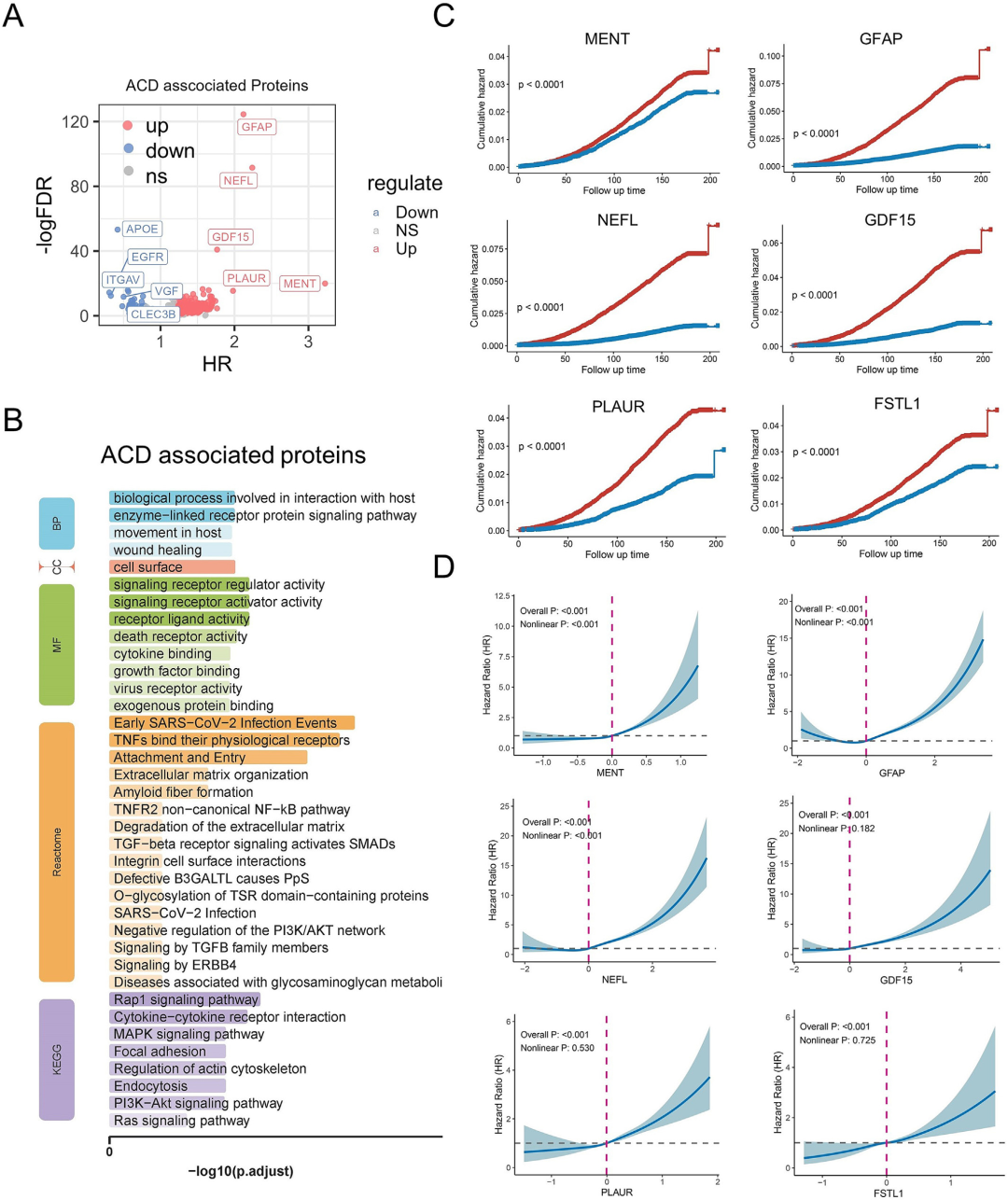
图4.与ACD风险相关的蛋白质的鉴定和功能富集分析。
(A)使用考克斯回归鉴定的与ACD相关的蛋白质。(B)ACD相关蛋白的功能富集分析。(C)说明ACD风险的累积风险曲线。较高的表达水平与增加的风险相关。(D)RCS曲线说明了顶级蛋白质的表达水平与ACD风险之间的剂量-反应关系。x轴代表蛋白质表达水平,置信区间显示为阴影区域。缩写RCS:限制性三次样条;x轴代表HR值,y轴代表FDR值。红色和蓝色点分别表示上调和下调的蛋白质。
研究聚焦DJD与ACD关系中蛋白质进行了中介分析以阐明DJD与ACD的潜在关联机制。通过整合DJD相关蛋白、ACD相关蛋白及候选介导因子(均满足FDR<0.05,且介导比例>1%),共筛选出18种可显著介导DJD与ACD关联的核心蛋白质。其中HAVCR1的介导比例最高,达52.6%;GDF15、COL6A3的介导比例分别为 22%、14.3%,此外还涵盖炎症蛋白、细胞黏附蛋白、生长因子调节蛋白及血管标志物等多类具有显著介导作用的蛋白质。
表2 DJD与ACD风险相关的蛋白质介导分析
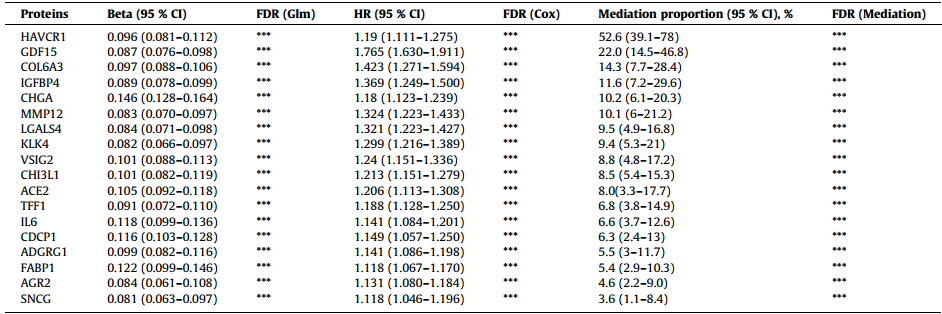
缩略语:HR:风险比;CI:置信区间。
这些发现揭示了连接DJDs与ACD的蛋白质介导因子,并为预防或治疗与肌肉骨骼疾病相关的痴呆提供了潜在的机制性见解和可能的治疗靶点。
AD是由β-淀粉样蛋白沉积和tau蛋白病理驱动的神经退行性疾病,虽血管风险因素与其进展相关,本研究提示其影响认知的机制可能独立于AD典型的淀粉样蛋白与Tau病理。影像学证据进一步支持这一发现,未来研究需重点阐释DJD通过神经炎症、血管功能障碍等非淀粉样蛋白通路促发认知下降的具体机制,以期为该人群开辟新的防治路径。
亚组分析揭示了年龄、活动水平和手术操作对关联的显著效应修饰作用,凸显了DJD相关痴呆易感性的异质性。年轻个体(<55岁)风险尤其升高,表明DJD可能通过独立于年龄相关血管负荷的中年或更早的机制促成神经退行性改变。缺乏身体活动的参与者关联性更强,这强调了运动在减轻系统性炎症和增强神经血管健康方面的潜在保护作用,而这两者对痴呆的发病机制都至关重要。
研究发现,年龄较轻(<55岁)、体力活动不足或曾接受关节手术的DJD患者痴呆风险更高,提示疾病负担与炎症状态可能在神经退行过程中起关键作用。机制上,研究通过蛋白质组学与中介分析,识别出包括HAVCR1、GDF15、COL6A3、IL-6等在内的18种血浆蛋白,这些蛋白显著介导了DJD与痴呆之间的关联,并富集于免疫炎症反应、细胞外基质重塑及血脑屏障破坏等相关通路,为两者之间的生物学联系提供了分子证据。
本研究具有优势,但仍是一项观察性研究,在DJD精确诊断、不同亚型与严重程度的分层分析以及疾病动态变化等方面存在一定局限。未来对痴呆类型进行分层的研究可能揭示亚型特异性的机制和中介因子。
参考文献:Kang Z, Zhang J, Zhu C, Lau EC, Zhu Y, Li P, Li K, Tong Q, Dai SM. Plasma proteomics mediate the association between degenerative joint diseases and dementia risk. J Adv Res. 2025 Dec 28:S2090-1232(25)01034-3. doi: 10.1016/j.jare.2025.12.044.
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)