克雷伯菌 ARO112 促进肠道菌群恢复、清除条件致病菌并预防 IBD 小鼠中的炎症发生
Klebsiella ARO112 promotes microbiota recovery, pathobiont clearance and prevents inflammation in IBD mice
Nat Commun
PMID: 41381568 [IF=15.7]
来源:IBD Daily
本研究结合基因组学分析、体外功能实验与多种小鼠模型,对Klebsiella sp. ARO112 进行了系统评估。首先,通过全基因组比较分析其与多种肠杆菌科菌株在致病性相关基因、耐药基因及水平基因转移潜力方面的差异,并辅以抗生素耐药性、生物膜形成、铁摄取及血清耐受性等体外表型实验,对其安全性进行多维度验证。在此基础上,作者利用无菌小鼠和IBD易感的Nod2-/-小鼠,构建抗生素处理及条件致病菌AIEC感染模型,评估ARO112对致病菌清除、宿主炎症反应及肠道菌群重建的影响。进一步通过16S rRNA测序和短链脂肪酸定量分析,系统解析ARO112对肠道菌群结构及代谢功能恢复,尤其是丁酸产生能力的调控作用。
➤基因组分析显示ARO112 所携带的医院感染相关致病性特征显著少于其他肠杆菌科菌株
作者首先通过系统的基因组比较分析评估 ARO112 的潜在致病风险,将其与多株
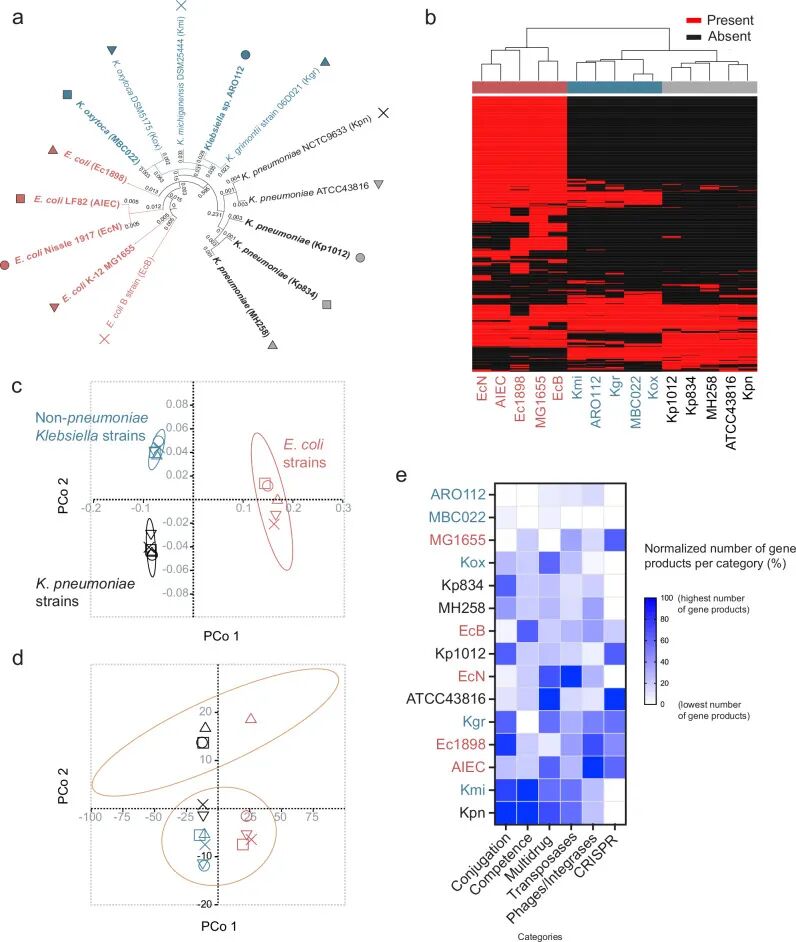
Fig1. ARO112 与
➤与其他肠杆菌科菌株相比,ARO112 表现出更少的医院感染相关致病表型
在体外功能实验中,作者从多项与肠杆菌科医院感染密切相关的表型特征入手,对 ARO112 的潜在致病风险进行了系统评估,包括抗生素耐药性、生物膜形成能力、
➤ARO112 通过水平基因转移获取和维持抗生素耐药性的能力较低
鉴于肠杆菌科细菌通过水平基因转移获取和传播抗生素耐药性所带来的临床风险,作者进一步评估了 ARO112 获取及维持耐药质粒的能力。结果显示,无论质粒来源于大肠杆菌还是克雷伯菌,ARO112 对可接合耐药质粒的获取效率均显著低于益生菌 EcN 以及多重耐药的肺炎克雷伯菌菌株,提示其在耐药基因进入层面即存在天然缺陷。在质粒维持能力方面,即便 ARO112 成功获得外源质粒,在缺乏抗生素选择压力的条件下,其对耐药质粒的稳定性明显较低,质粒丢失率显著高于对照菌株。这一特征不仅在体外培养条件下观察到,在小鼠肠道环境中表现得更为明显,表明肠道生态位进一步放大了 ARO112 对外源耐药基因的不稳定性。
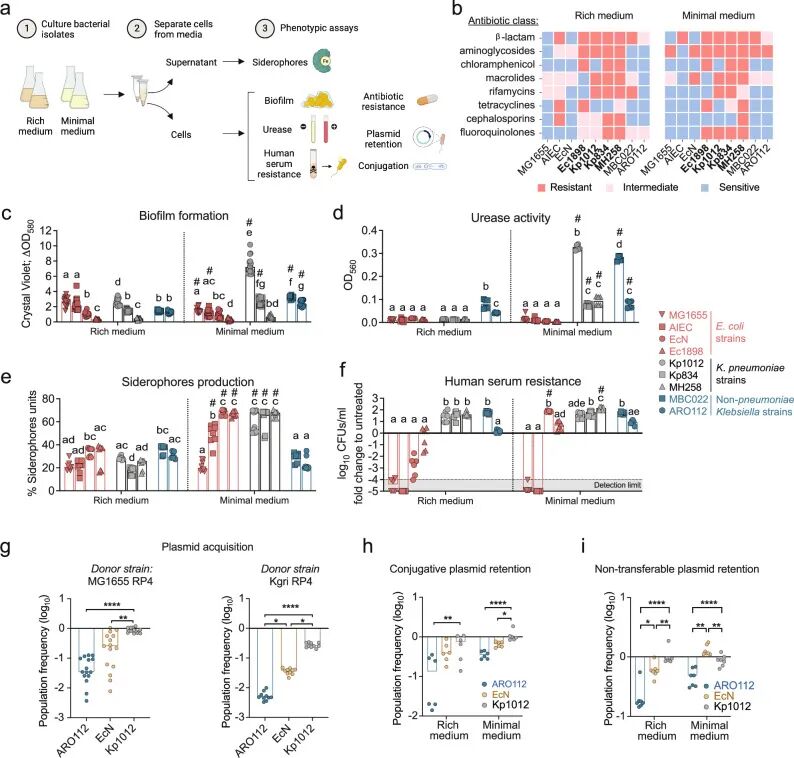
Fig2. ARO112 及其他肠杆菌科菌株与医院感染相关、涉及宿主侵袭与定植的重要致病表型评估
➤ARO112 在肠道定植过程中仍保持良好的安全性
在无菌小鼠单菌定植模型中,作者直接评估了 ARO112 在缺乏其他微生物干扰条件下对宿主的影响。与多重耐药克雷伯菌菌株相比,ARO112 定植后未引起小鼠体重、体温或血糖水平的明显变化,且在实验周期内未检测到肠外器官的细菌转移,提示其不具备显著的系统性感染风险。在炎症反应评估方面,ARO112 定植小鼠粪便中炎症标志物 Lipocalin-2 水平与无菌对照小鼠相当,未出现明显升高,表明 ARO112 本身不会触发肠道炎症反应。
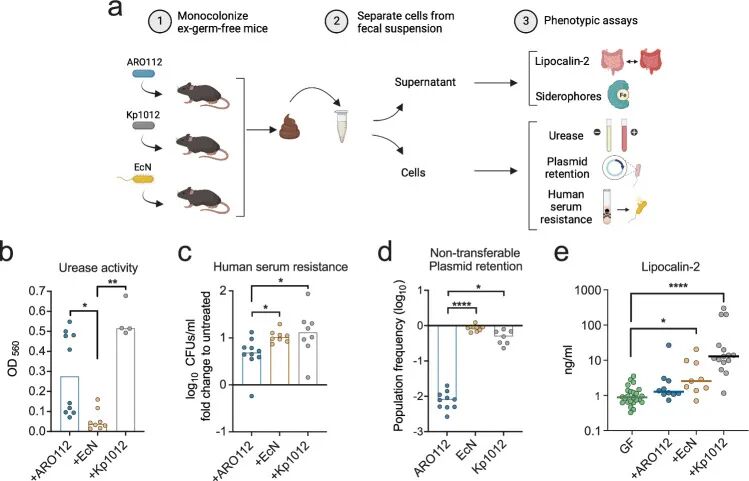
Fig3. 从单菌定植小鼠粪便中分离的 ARO112、EcN 和 Kp1012 的表型特征分析。
➤过表达ACSL4的成纤维细胞驱动结ARO112 在 IBD 小鼠模型中促进 AIEC 肠道感染的快速清除
在 Nod2-/-小鼠这一经典的 IBD 易感模型中,作者构建了抗生素处理后接种条件致病菌 AIEC 的疾病背景,以模拟 IBD 患者在菌群受损状态下对肠道感染的高易感性。在该模型中,与未接受干预的小鼠相比,ARO112 处理显著加快了 AIEC 的清除进程,大多数小鼠在实验结束前实现了病原菌的完全清除。作为对照,作者同时评估了经典益生菌 EcN 的效果,但在该模型中 EcN 并未促进 AIEC 清除,部分小鼠甚至表现出持续定植的趋势。这一对照结果凸显了 ARO112 在该特定疾病背景下的功能优势,表明其作用并非所有益生菌共有。值得注意的是,ARO112 本身并未在小鼠体内长期稳定定植,而是在 AIEC 被清除后逐渐从肠道中消失。这一现象提示 ARO112 并非通过长期占据生态位直接排斥病原菌,而更可能通过暂时性介入调节肠道生态环境,从而促进宿主和菌群系统的恢复。
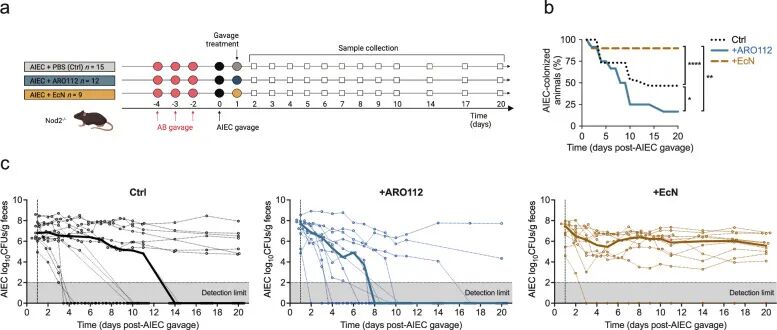
Fig4. 在抗生素处理的 IBD 小鼠模型中评估 ARO112 与 EcN 对 AIEC 肠道定植的治疗潜力
➤ARO112 治疗促进抗生素后肠道菌群恢复,尤其有利于丁酸产生菌重建
基于 ARO112 在 Nod2-/-小鼠中加速 AIEC 清除但自身并不长期定植的现象,作者进一步分析了其对抗生素后肠道菌群恢复过程的影响。16S rRNA 测序结果显示,与对照组和 EcN 处理组相比,ARO112 显著改善了抗生素处理后肠道菌群的物种丰富
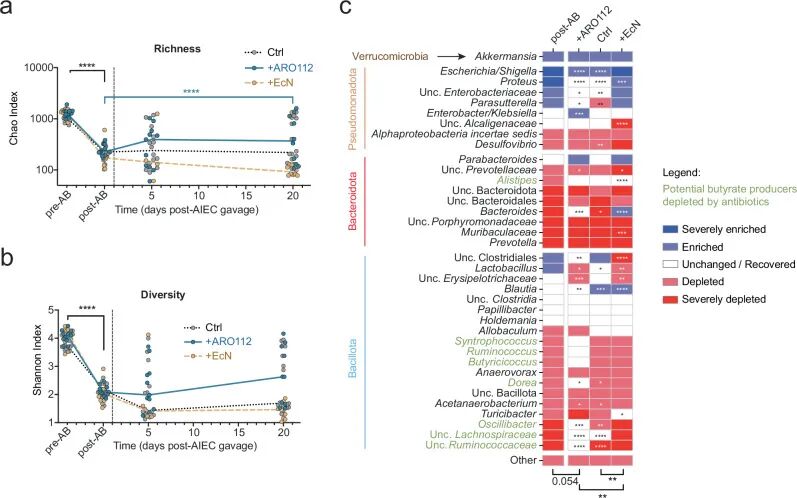
Fig5.益生菌处理(ARO112、EcN)或未处理条件下小鼠肠道菌群组成的变化
➤ARO112 益生菌治疗增强肠道菌群的丁酸产生能力
与前述菌群结构重建结果相一致,代谢组学分析显示,ARO112 处理组小鼠粪便中丁酸水平显著回升,并恢复至抗生素处理前的水平,而对照组及 EcN 处理组在实验结束时仍维持在较低水平。该结果表明,ARO112 促进的菌群重建不仅体现在群落结构层面,也伴随着关键代谢功能的有效恢复。与此同时,在整个 AIEC 感染和恢复过程中,ARO112 处理组小鼠粪便中炎症标志物 Lipocalin-2 始终维持在较低水平,未出现明显升高。相比之下,对照组和 EcN 处理组则表现出持续或短暂的炎症反应。上述结果提示,ARO112 在促进病原清除和代谢功能恢复的同时,还能够稳定抑制感染相关的轻度肠道炎症。
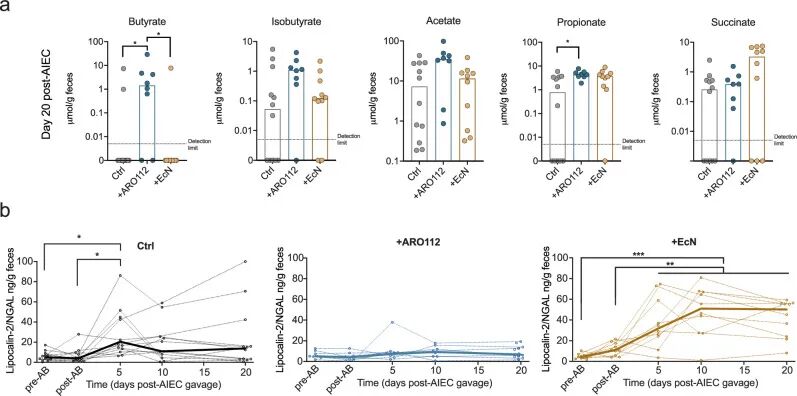
Fig6. 不同益生菌处理(ARO112、EcN)或未处理条件下小鼠短链脂肪酸水平及肠道炎症特征。
➤非肺炎克雷伯菌在低炎症状态的 IBD 及非 IBD 人群中相对富集,并伴随较高水平的潜在丁酸产生菌
为评估上述发现在人群中的相关性,作者对 HMP2数据库进行了再分析,在排除抗生素干预等潜在混杂因素后,比较不同炎症状态样本的菌群特征。结果显示,在低炎症水平的样本中,非肺炎克雷伯菌相对丰度较高,其中包括 ARO112 所属的菌群类群。进一步分析发现,这些样本同时富集多种潜在丁酸产生菌,提示非肺炎克雷伯菌的存在与更有利的菌群功能状态相伴。
➤ARO112 治疗在化学诱导的 IBD 小鼠结肠炎模型中预防疾病进展并减轻肠道炎症
在前述抗生素处理并伴随 AIEC 感染的 IBD 模型中,ARO112 已显示出促进病原清除并抑制炎症的作用,但该模型中的炎症程度相对有限,且与条件致病菌感染密切相关。为进一步明确 ARO112 是否具备独立于病原菌清除之外的抗炎保护能力,作者进一步采用 DSS 诱导的结肠炎模型,对其在炎症驱动型肠道损伤中的作用进行评估。在 DSS 处理过程中,小鼠同步接受 ARO112 干预,并与未处理对照组进行比较。结果显示,ARO112 处理显著减轻了结肠炎的疾病严重程度,表现为体重下降幅度减轻、
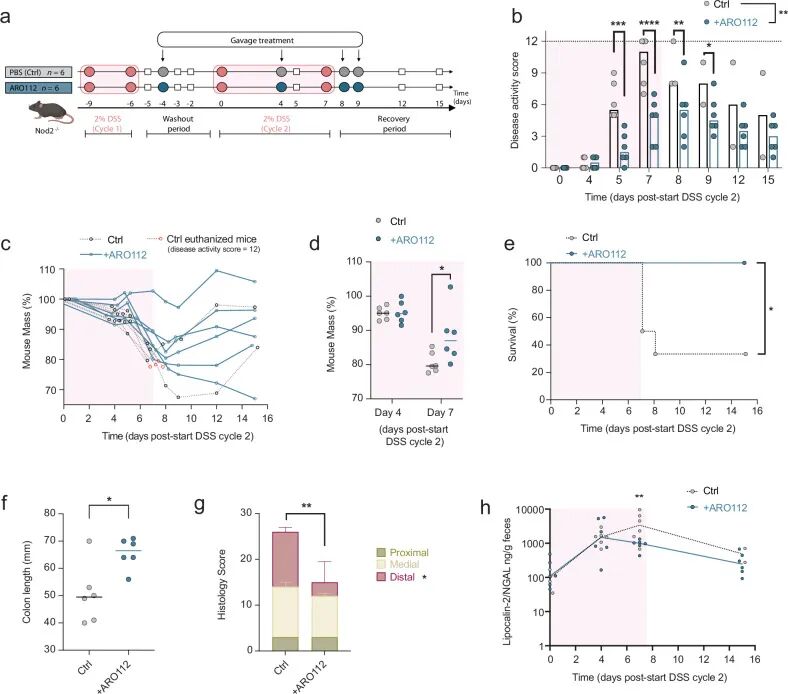
Fig7. ARO112 在 DSS 诱导的结肠炎小鼠模型中的保护作用。
本研究系统证明,Klebsiella sp. ARO112 兼具良好的安全性与显著的治疗潜力。在基因组和表型层面,ARO112 均缺乏典型致病菌特征,并在抗生素耐药基因的水平获取与维持方面表现出明显受限,从而降低了潜在的临床风险。在多种 IBD 相关小鼠模型中,ARO112 不仅能够加速条件致病菌 AIEC 的清除,还可促进抗生素处理后肠道菌群结构和功能的恢复,尤其有利于丁酸代谢能力的重建,并在不同炎症背景下持续抑制肠道炎症反应。更为重要的是,本研究提出了一种区别于依赖长期稳定定植的益生菌干预模式,表明短期生态调节即可有效改善肠道微生态失衡并限制炎症扩增。该发现为 IBD 等慢性肠道炎症性疾病的精准微生态干预奠定了重要的理论和实验基础。
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)