急性
中山市人民医院重症心脏科陈妙莲教授、牛海名教授团队,利用潜在类别分析(LCA),将接受VA-ECMO辅助的AFM患者分类为特定的临床表型研究成果,近日已发表于中科院二区期刊International Journal of Cardiology上。研究成果对于解释这种疾病的异质性至关重要;深入了解这些表型之间的临床表现和预后差异,也可以改善患者的选择、预后分析,并为优化治疗和管理策略提供指导。

我们回顾了2003年5月1日至2022年1月1日中山市人民医院因AFM住院并接受VA-ECMO治疗的55例成人患者。AFM的诊断是基于多个指南建立的临床标准。所有55例患者的
AFM患者可在以下三种情况之一时启动VA-ECMO:①
本研究获得了中山市人民医院机构审查委员会的伦理批准。来自电子医疗记录的数据被去识别、加密并安全存储。由于去识别过程,免除知情同意;这项研究是根据《赫尔辛基宣言》进行的。
LCA是一种统计方法,可以根据变量在数据集中识别不同的、互斥的组。与传统的建模方法不同,LCA不依赖于线性、正态分布或同质性的假设,这使得它非常适合于识别亚组。它通过计算每个个体根据其类别成员对特定项目的响应概率来确定最佳簇数。然后将个体分配到具有最高成员概率的类型中,从而在群体中定义不同的表型。多个预后因素已被报道和提出,包括初始症状[包括体外心肺复苏、VA-ECMO前较低的平均动脉压(MAP)和较高的乳酸水平]、心肌酶谱水平、主动脉瓣不开放、LVEF、ECMO启动时间等。
我们还纳入了患者的人口统计学特征、合并症、并发症和治疗方案。这些预测因素反映了AFM的异质性,并作为接受VA-ECMO辅助的AFM患者表型的临床因素。由于所有AFM患者均接受糖皮质激素治疗,因此在我们的研究中,糖皮质激素并没有作为表型分类的临床参数。
我们计算了数据集中的表型反应概率(IRP),以定义三种不同表型的特征。IRP越高,表明属于特定亚组的可能性越大。这种方法使我们能够清楚地区分表型,并对每组相关的独特临床特征有了详细的了解。
在研究纳入的55例接受VA-ECMO治疗的AFM患者中,前驱疾病是重要的临床诊断标准,但并非所有患者都有可识别的病原体。本研究共检出32例潜在病原体,包括2019冠状病毒病(2例)、甲型流感病毒(6例)、乙型流感病毒(2例)、柯萨奇病毒(3例)、人疱疹病毒1(5例)、人疱疹病毒6(3例)、腺病毒(4例)、细小病毒B19(2例)、呼吸道合胞病毒(5例)、肺炎支原体(6例)。6例患者检出1种以上病原菌,提示合并感染。
入院至VA-ECMO启动的平均时间为8.51h, VA-ECMO支持的平均持续时间为4.24天,28天生存率为85.5%。随访显示,所有出院患者在1年时仍然存活,心功能NYHA I级。重要的是没有患者进展为心肌病,也没有与他们的疾病或VA-ECMO相关的明显心功能障碍或持续神经功能障碍。
与以往研究相似,58.2%的患者为女性,平均年龄为31.53岁。少数患者有合并症,包括糖尿病(1.8%)、高血压(1.8%)和冠心病(3.6%)。我们的AFM患者表现出乳酸、TnT、CK、CK-MB和NT-pro BNP水平升高。详细的患者特征见表1。
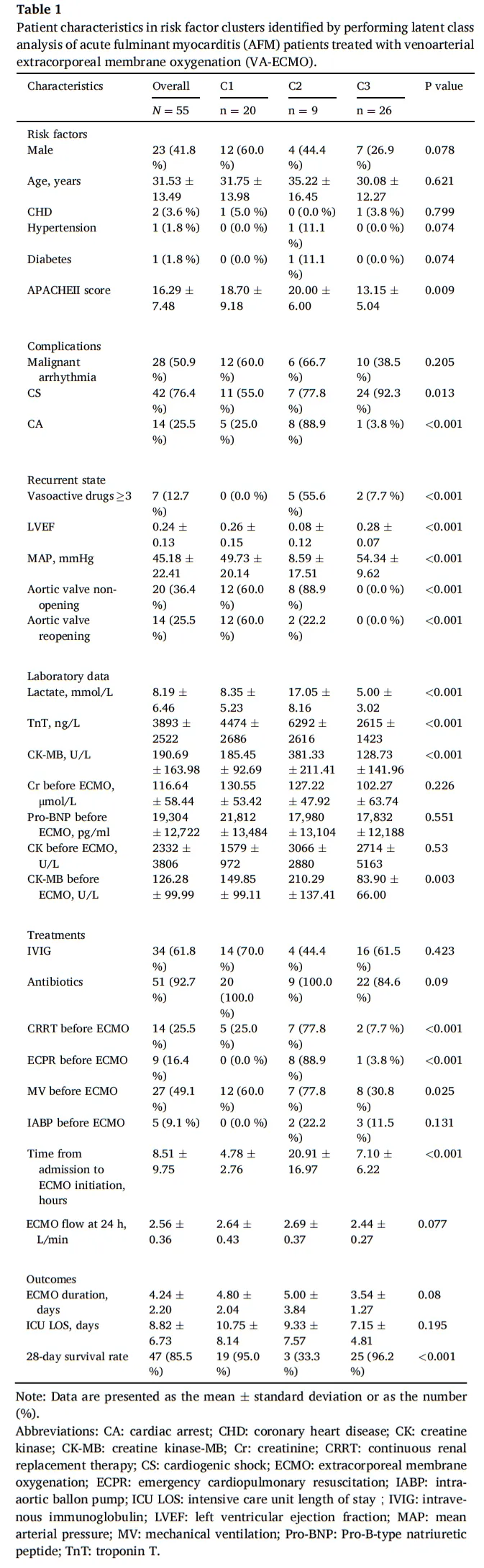
通过使用患者人口统计学、合并症、并发症、初始症状、治疗方案、实验室数据和VA-ECMO启动时间对变量进行聚类分析,我们确定了三个接受VA-ECMO辅助的AFM患者的聚类:聚类1 (C1; n = 20),聚类2 (C2; n = 9),聚类3 (C3; n = 26)。三组患者的性别比例(60.0% vs 44.4% vs 26.9%, p = 0.078)、年龄(31.75±13.98 vs 35.33±16.45 vs 30.08±12.27,p = 0.621)、V-A ECMO流量(2.64±0.43 vs 2.69±0.37 vs 2.44±0.27 L/min, p = 0.077)无统计学差异(表1和图1)。
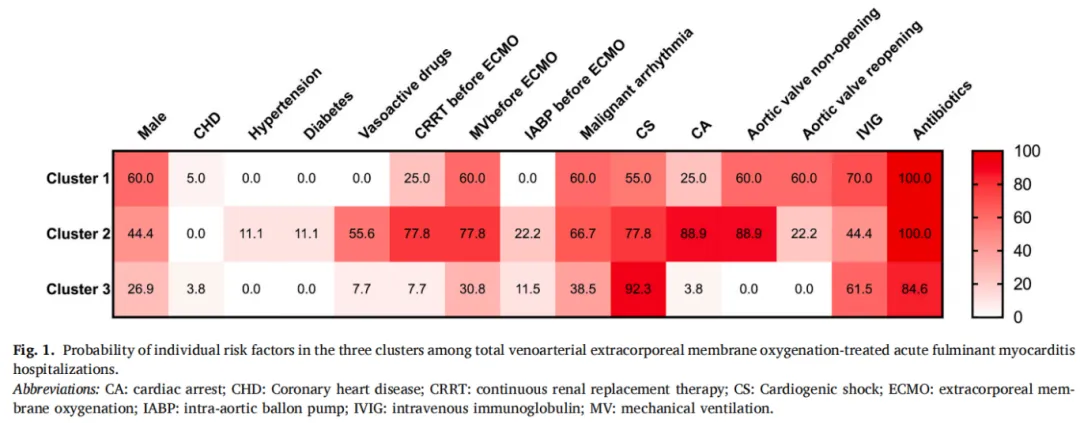
在研究中,我们还计算了3组聚类总计12个预后因素,包括年龄、VA-ECMO启动时间、LVEF和实验室数据等。密度图突出了不同类别之间分布的不同(图2)。
我们发现C1 (n=20)从入院到VA-ECMO启动的时间最快(4.78±2.76 h)。值得注意的是,C1组使用的血管活性药物不超过3种,没有在体外循环辅助下行心肺复苏 (ECPR)的患者。该亚组的住院死亡率较低 (5%)。
C2(n=9) 表现出最高的乳酸(17.05±8.16 mmol/L)、CK-MB (381.33±211.41 U/L) 和 TnT (6292.33±2615.87 ng/L) 水平。该亚组的主动脉瓣未开放率(88.9%) 和心脏骤停发生率 (88.9%)最高,从入院到 V-A ECMO 启动的时间最晚 (20.91±16.97 h)。该组患者的总体结局最差,院内死亡率最高 (66.7%)。
C3(n=26) 具有最高的LVEF(0.28±0.07) 和MAP(54.34±9.62 mmHg)。该亚组中无主动脉瓣不开放的患者。有趣的是,C3组患者的住院死亡率最低 (3.8%)。
我们纳入近20年VA-ECMO治疗的AFM患者,根据其人口统计学特征、合并症、并发症、初始症状、实验室检查、常规治疗和VA-ECMO治疗参数分为三个表型。我们发现,C1表型入院至VA-ECMO启动时间最早,C2表型乳酸水平和主动脉瓣不开放率最高,C3患者LVEF和MAP最高,无主动脉瓣不开放。值得注意的是,C2表型住院死亡率最高,C3表型最低。
C1患者最早行VA-ECMO治疗。虽然显示出相对较高的主动脉瓣未打开率,但随后主动脉瓣完全重新打开。该亚型患者的住院死亡率较低。早期ECMO启动可能反映了临床医生对患者病情严重程度的认识;然而,CS患者早期启动ECMO是必不可少的,并且与更高的生存率相关。急性和慢性心力衰竭的ESC指南建议在具有多学科专业知识的专业中心对CS患者选择性地使用MCS策略。
既往研究也表明,标准化的团队方法,包括早期植入MCS,可能改善预后。关于AFM合并CS患者启动VA-ECMO的标准和时间尚未达成共识。近年来,越来越多的人开始重视早期ECMO,研究表明早期使用VA-ECMO可以提高CS患者的生存率,这与我们的研究结果一致。
值得注意的是,在我们的研究中,只有5名患者是从外院转过来的。考虑到这一小部分,我们在分析中没有将转院作为一个变量。然而,我们承认从首次就医到VA-ECMO启动的时间是影响患者预后的关键因素。这些临床亚型的表型分析表明,早期开始VA-ECMO有利于AFM合并CS患者的心功能恢复,这可能是他们预后更好的原因。
C2组患者乳酸水平最高,主动脉瓣不开放和心脏骤停发生率最高,入院至VA-ECMO启动时间最晚,住院死亡率也最高。VA-ECMO治疗前后24 h乳酸水平是CS患者院内死亡率的独立预测因子,与C2患者的不良结局一致。
主动脉瓣关闭表现为无搏动性血流,增加血栓形成的风险,可导致致命的全身血栓栓塞并发症。进一步的心脏病理生理变化包括肺水肿、心肌缺血恶化以及左室壁张力增加和舒张末期压升高引起的恶性连房性心律失常。
C2患者最晚启动VA-ECMO可能导致长时间的灌注不足、器官衰竭和高死亡率。
我们的研究结果显示,在C2患者中,最晚启动VA-ECMO与不良预后之间存在关联,而在C1患者中,早期启动VA-ECMO与良好预后之间存在相关性,进一步支持了这一相关性。
关于ECMO治疗的CS研究显示了相互矛盾的证据。例如,一项多中心随机研究指出,VA-ECMO并不能改善快速恶化或严重CS患者的临床结果。而另一项使用体外生命支持组织(ELSO)登记数据的研究发现,VA-ECMO前的休克严重程度是CS患者院内死亡率的一个强有力的预测因子。AFM合并CS患者的严重程度可能解释了这种异质性。
C2患者最高的乳酸水平、主动脉瓣不开放率和心脏骤停发生率反映了极其严重的CS情况,与三组中最高的住院死亡率一致。
我们的亚型分析表明,心功能特别差的AFM患者可能只能从ECMO中获得有限的益处。对于这些患者,临床医生需要仔细评估ECMO在医疗资源、住院费用和整体治疗计划方面是否具有成本效益。
C3组患者LVEF和MAP最高,无主动脉瓣不开放,住院死亡率最低。C3患者无主动脉瓣不开放,表明他们左室舒张末期压升高、左室扩张、肺水肿和血栓形成的风险较低;与C1和C2相比,C3患者完整的主动脉瓣功能可能反映了较低的初始左室压。
大型多中心研究显示,早期左心室减压与30天死亡率显著降低相关。既往荟萃分析也得出结论,左心室减压有利于降低住院死亡率。LVEF反映AFM期间心肌损伤程度和炎症程度,是AFM进展的独立预测因子。
一项对220例AFM患者的回顾性研究证实LVEF是住院结局、30天后心脏恢复和全因死亡率的有效预测因子。MAP与器官灌注和死亡率有关,入院时的MAP已被确定为重症监护病房患者死亡的危险因素。对接受VA-ECMO的患者进行回顾性分析发现高MAP与生存率呈正相关,而低MAP和ECMO脱机失败与院内死亡率增加相关。我们的发现与这些报告是一致的。
一般来说,C3表型患者在发病时可能保持了较好的残余心功能,这可以从无主动脉瓣不开放和最高的LVEF和MAP值中看出。这些因素可能是他们比其他两组结果更好的原因。尽管C1和C3组均表现出较高的28天生存率,但在结果上仍存在细微但统计学上显著的差异。表1显示,C1表型男性比例较高,且APACHE II评分较高,这两者均被认为是心肌炎死亡的危险因素。此外,C1表型表现出相对较高的主动脉瓣不开放发生率,而C3则未见此类病例。主动脉瓣不开放可导致进一步的心脏病理生理变化,对AFM患者的预后产生不利影响。这些差异可能为观察到的结果差异的潜在原因提供有价值的线索。
这是一个小样本量的单中心回顾性研究。虽然研究中将接受VA-ECMO治疗的AFM患者分为不同的临床表型,且结果明显不同,但需要更大规模的队列研究来验证和推广这些发现。
本研究采用LCA的方法,将经VA-ECMO治疗的AFM患者根据人口学特征、合并症、并发症、初始症状、实验室检查、常规治疗和ECMO治疗参数等因素分为三组。这三组患者的预后具有显著差异,凸显了经VA-ECMO治疗的AFM患者的临床异质性。我们建立了三个模型来帮助识别这种异质性并预测患者预后,从而更好地制定治疗方案,利用医疗资源。未来的研究将全面整合临床和生物学数据,进一步验证和增强我们模型的可靠性。
牛海名 教授
•博士研究生,副主任医师,硕士生导师
•美国心脏病学会(ACC)青年医生和研究者(FIT)成员
•广东省医疗安全协会重症医学分会 常委
•广东省医疗行业协会、病理生理学会、临床医学会等重症医学分会 委员
•重症心脏亚专业组,擅长机械辅助治疗心源性休克、应激性心肌病
•牵头Ramp Study动态优化策略指导规范化治疗心源性休克。
•以第一作者发表SCI论文10篇,主持市级以上科研基金4项
•2024年美国心脏病学会(ACC)年会受邀2项应激性心肌病研究成果展示,2025长城心脏病学大会暨亚洲心脏大会受邀参加国际联合论坛
•2025年中华医学会第19届重症医学大会受邀高分SCI版块担任授课讲者
陈妙莲 教授
•主任医师,内科ICU科主任
•“2023年广东省广东省卫生系统先进个人”
•中国医师协会重症医学分会委员
•广东省医师协会重症医学医师分会常务委员
•广东省医学会重症医学分会青年委员
•广东省临床医学学会临床重症医学专业委员会常务委员
•中山市医学会生命支持专业委员会副主任委员
•中山市医学会重症医学专业委员会常务委员
•中山市重症医学专业质量控制中心副主任
•从事重症医学临床工作15年,擅长机械辅助治疗心源性休克;在脓毒症心肌病、危重病人床旁血液净化技术等方向经验丰富
•以第一和通讯作者发表SCI和国内核心期刊多篇,主持多项省市级科研基金
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)