一名18岁男性,既往无病史,因进行性加重的骨痛6个月就诊。疼痛位于右侧后肋、胸椎中段及右侧髂骨,性质为深部搏动性疼痛,体力活动后加重,严重限制其活动能力。同时,存在反复发作的
初始常规X线平片检查显示多发溶骨性病变,累及右侧第6、7肋及右侧髂骨,伴皮质变薄和骨小梁破坏;同时存在双侧
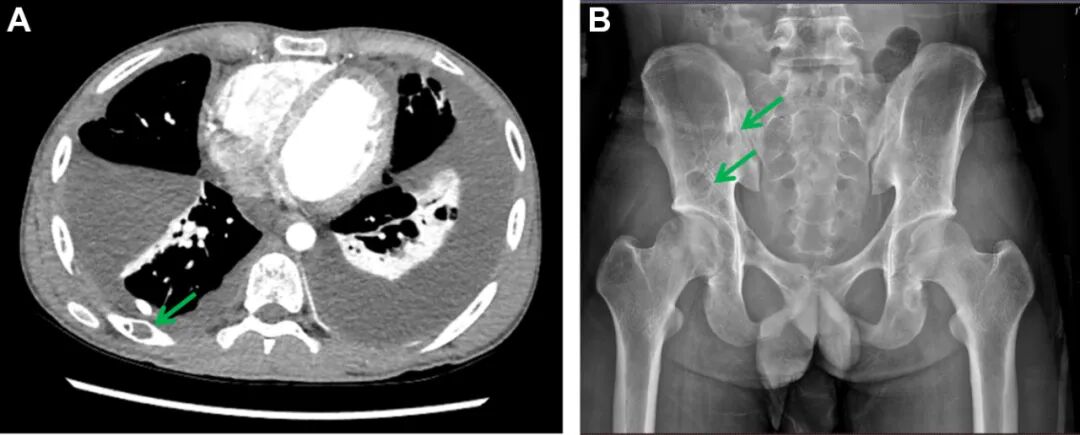
图1. A, B肋骨及骨盆囊性病变的影像学特征。A累及右侧后肋的多发边界清晰的囊状低密度病灶(箭头所示)。B分布于双侧骨盆骨内的散在囊性液体密度病灶(箭头所示)。
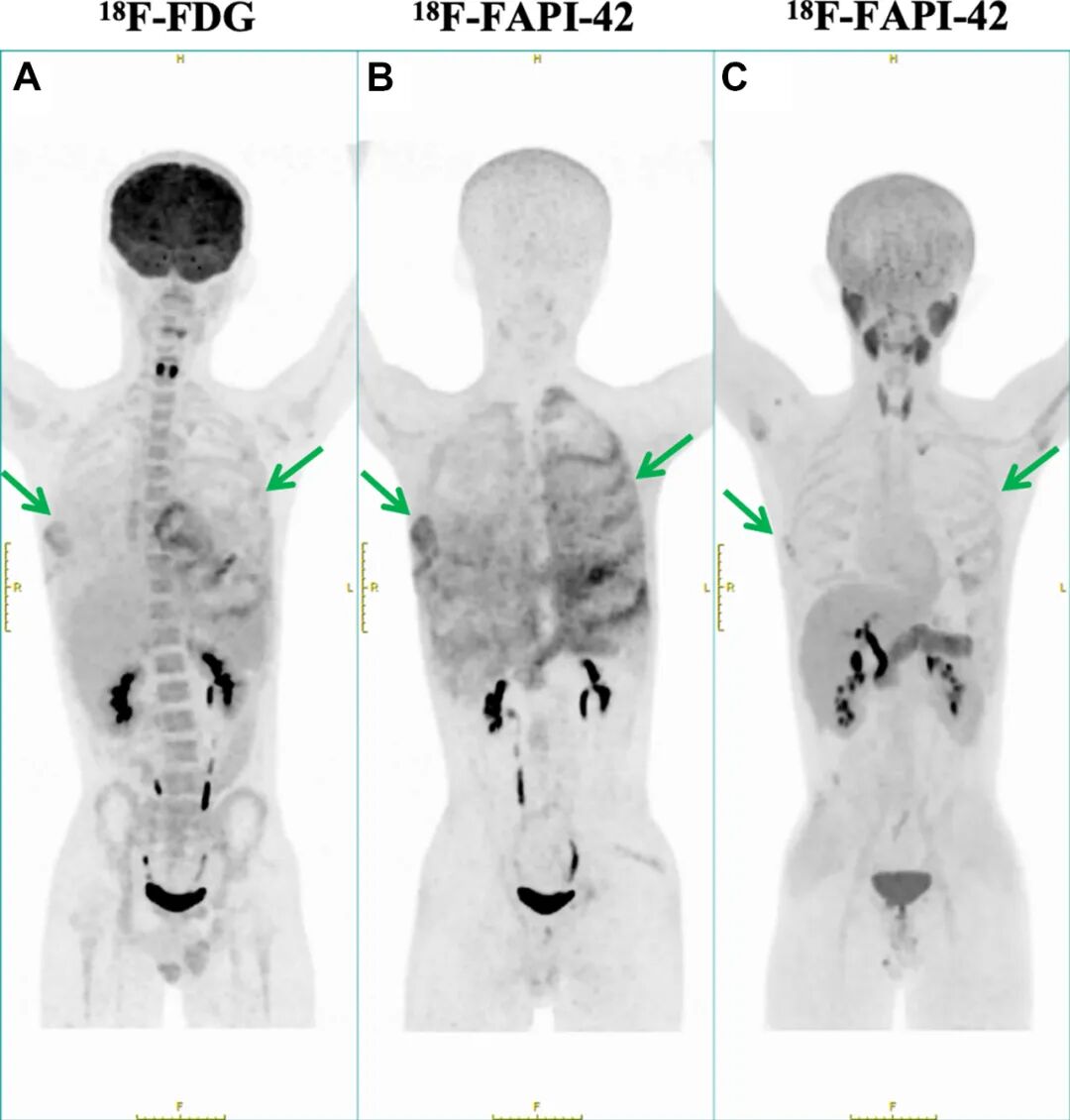
图2. A-C该患者接受了¹⁸F-FDG和¹⁸F-FAPI-42两种示踪剂的PET/CT显像。A¹⁸F-FDG PET/CT显像显示骨质流失区域呈轻度摄取,提示存在高糖代谢区域。B相比之下,¹⁸F-FAPI-42 PET/CT显像则显示出更高的特异性,凸显了受累骨骼内广泛的纤维化活性。C经过1年随访评估,¹⁸F-FAPI-42 PET/CT显像显示胸腔积液减少,且双侧胸膜、心包及骨骼(包括肋骨、脊柱和骨盆)的示踪剂摄取均显著降低。箭头指示示踪剂摄取的特异性区域。¹⁸F-FDG = 氟-18氟代脱氧葡萄糖;¹⁸F-FAPI-42 = 氟-18成纤维细胞活化蛋白抑制剂-42。
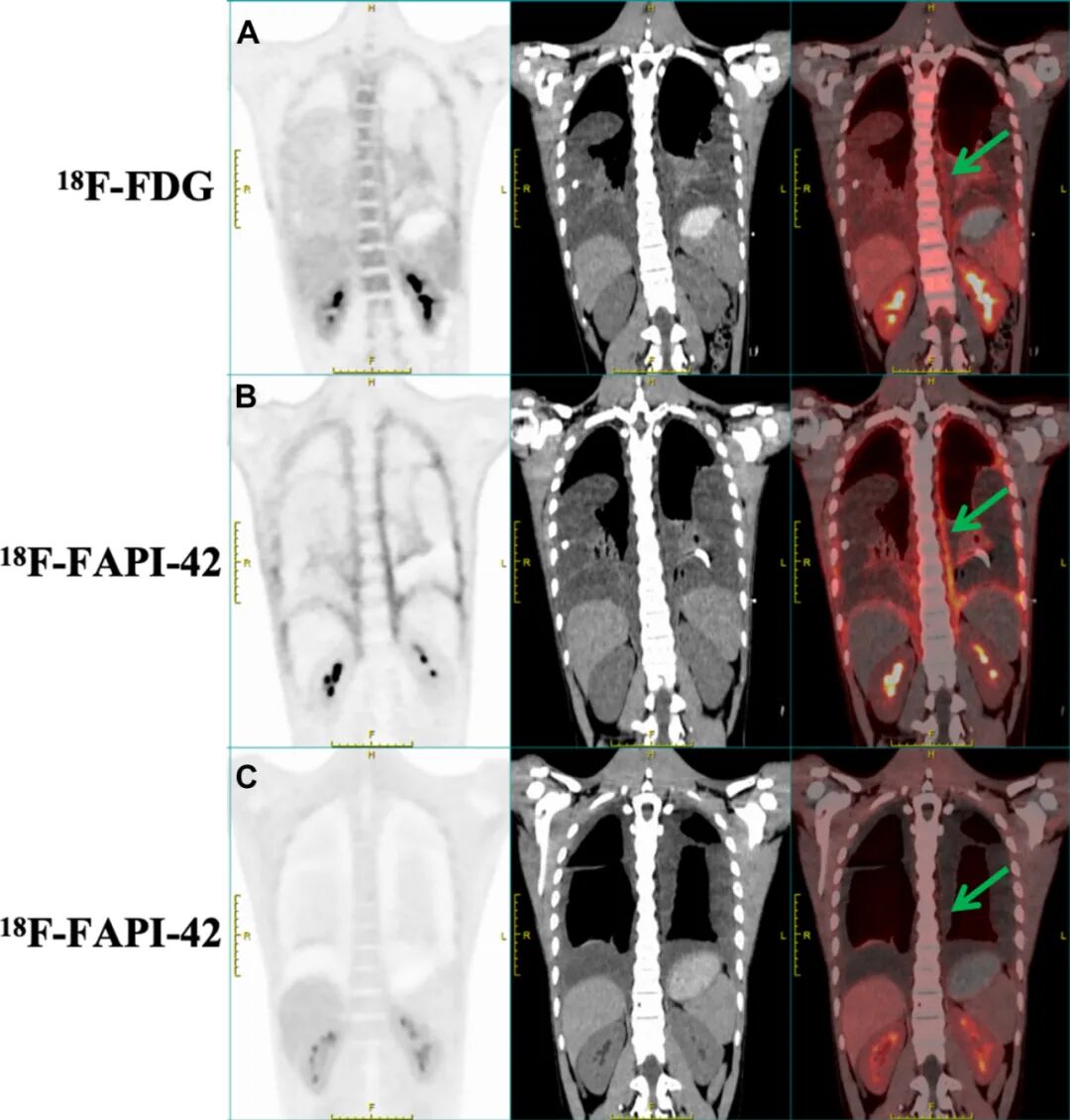
图3. A-C戈勒姆-斯托特综合征患者脊柱的PET/CT影像学表现。A ¹⁸F-FDG PET/CT显像显示脊柱区域示踪剂呈轻度摄取。B ¹⁸F-FAPI-42 PET/CT显像则显示受累脊柱区域的摄取更高。C 经过1年随访评估,¹⁸F-FAPI-42 PET/CT显像显示脊柱区域的示踪剂摄取显著降低。箭头指示示踪剂摄取的特异性区域。¹⁸F-FDG=氟-18氟代脱氧葡萄糖;¹⁸F-FAPI-42=氟-18成纤维细胞活化蛋白抑制剂-42。
实验室检查提示轻度正细胞性贫血(
右侧胸腔积液的诊断性穿刺引流出乳糜状液体,其特征如下:甘油三酯水平,480 mg/dL(参考值:< 110 mg/dL);
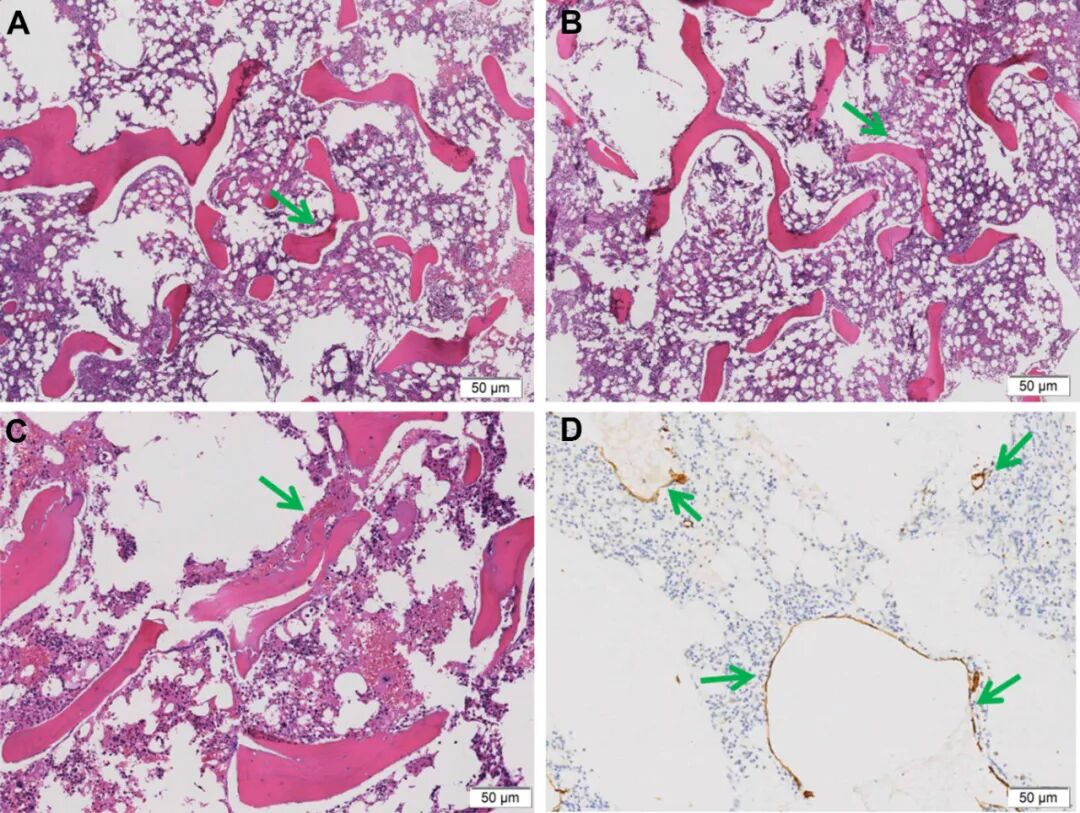
图4. A-D,该18岁男性患者右侧髂骨标本的组织病理学特征。A,骨小梁结构基本保持完整,伴局灶性骨小梁分布稀疏区域。B,骨髓腔内可见造血组织及成熟脂肪组织,且(C)未见肿瘤性增生证据。(A-C,苏木精-伊红染色)。D,D2-40阳性的淋巴管(箭头所示)浸润骨髓组织。(D2-40免疫组织化学染色)。
戈勒姆-斯托特综合征(GSS)
戈勒姆-斯托特综合征的诊断基于以下几点确立:(1)呈特征性"虫蚀样"影像学模式的进行性多中心性溶骨;(2)髂骨活检标本组织学证实存在淋巴管增生(D2-40阳性);(3)乳糜胸的生化证据(胸腔积液甘油三酯>110 mg/dL且证实有乳糜微粒);(4)通过血清学和病理学评估全面排除了恶性肿瘤、感染和自身免疫性疾病。基于这些发现,多学科团队启动了哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂治疗,并密切监测肾功能、血脂谱和血液学参数。未观察到明显的不良反应(如
治疗12个月后,随访¹⁸F-FAPI-42 PET/CT扫描显示肋骨(SUVmax,2.1)、心包(SUVmax,1.8)和双侧胸膜(SUVmax,2.0)内的放射性示踪剂摄取显著减少,表明成纤维细胞活性受到抑制(图2C和图3C)。胸部超声扫描显示胸腔积液量减少80%,下肢水肿完全消退。重复实验室检查显示CRP(2.1mg/L)和碱性磷酸酶(63U/L)恢复正常,进一步证实了疾病静止。患者在1年随访时已恢复全部学业活动,且报告无功能受限。
临床讨论
影像学讨论
GSS的影像学评估依赖于多模态方法,以区别于相似疾病。常规X线平片和CT成像通常显示无硬化边界的"虫蚀样"溶骨性病变(图1B),这是GSS的特征性表现,与常伴有骨膜反应或软组织肿块的转移瘤或
病理学讨论
髂骨活检的组织病理学评估揭示了GSS的诊断特征,即D2-40阳性的淋巴管浸润骨髓。这些缺乏内皮细胞异型性的管道,明确地将该病变与血管
鉴别诊断
GSS的异质性表现需要一个系统性的方法来排除相似病症。关键的鉴别诊断包括

1.对于原因不明的骨溶解和乳糜胸的年轻患者,尤其在排除恶性肿瘤和自身免疫性病因后,应怀疑GSS。
2.¹⁸F-FAPI-42 PET/CT成像在检测纤维化活性方面优于传统氟代脱氧葡萄糖成像,可作为诊断和治疗监测的关键工具。
3.靶向mTOR介导淋巴管生成的疗法,在稳定疾病进展与缓解乳糜胸方面显示出确切疗效。
参考文献:Le X, Li N, Zeng Y, Wang X, Wang J. Rare Case of Progressive Osteolysis and Chylothorax in an Adolescent Male. Chest. 2025;168(6):e187-e193.

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)