神经脊髓炎谱系疾病(NMOSD)是一种以视神经和脊髓受累为主的中枢神经系统自身免疫性炎性疾病,80% 以上的患者体内存在针对水通道蛋白4(AQP4)的自身抗体免疫球蛋白G(AQP4⁃IgG)[1]。NMOSD的发病机制主要与致病性 AQP4⁃IgG相关,AQP4⁃IgG攻击中枢神经系统内的星形胶质细胞,造成严重的轴索损害和脱髓鞘反应,是不同于
NMOSD主要指AQP4⁃IgG阳性的患者,也包括与之密切相关的AQP4⁃IgG阴性的临床综合征患者,后者的血清AQP4⁃IgG和MOG⁃IgG均为阴性,一般称为抗体阴性的NMOSD[1]。自2021年开始,国家药品监督管理局已批准多种单抗类药物用于治疗NMOSD,极大地改善了我国 NMOSD患者的诊疗状况。本文总结了B细胞在 NMOSD 病理生理中作用的最新证据,重点阐述 B 细胞驱动疾病的细胞与分子机制,最终聚焦 B 细胞靶向疗法的作用机制及其与疾病机制的关联。

南阳市中心医院神经内科病区副主任,副主任医师
擅长脑血管病、神经感染与免疫疾病的诊疗、神经影像、分析与治疗
参与编写《神经影像学》等著作5本,发表论文10余篇,SCI 4篇
中国研究型医院学会神经科学专业委员会委员
河南省医学会免疫学组委员
南阳市
01
NOMSD与B细胞耗竭疗法
随着对 NMOSD 认识的深入,新型靶向单克隆抗体治疗逐渐研发问世,这类药物可改善患者预后并减轻疾病影响与负担。由于治疗领域发展迅速(2019 年首个 NMOSD 靶向药物获批),临床医生可能对将患者从传统口服
02
NMOSD的病理生理机制
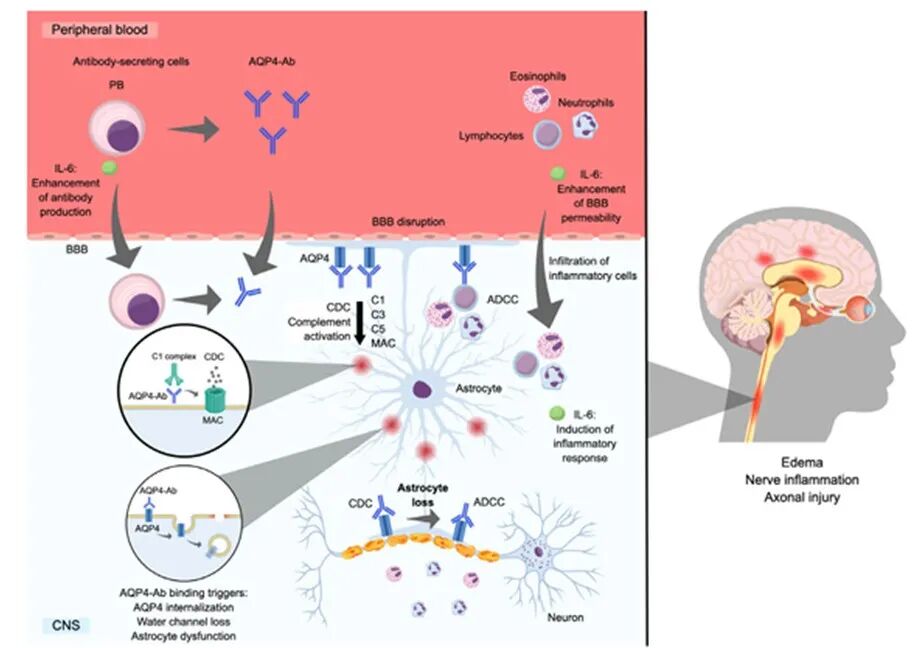
图 1 展示了 AQP4-Ab 在 NMOSD 患者中的致病作用(本文所有图片来源:参考文献[6])
体外研究表明,星形胶质细胞暴露于 AQP4-Ab 后,会导致血脑屏障破坏,且星形胶质细胞分泌IL-6增加,进而促进白细胞迁移。血脑屏障受损使外周 AQP4-Ab 得以进入中枢神经系统,并与血管附近星形胶质细胞终足表面高表达的 AQP4 结合。抗体结合会引发补体依赖的细胞毒性作用(CDC)、抗体依赖的细胞毒性作用(ADCC,即细胞死亡)、AQP4 内化及水通道功能破坏 [2],这些过程共同导致 NMOSD 的临床症状。
补体抑制是减轻 NMOSD 患者组织损伤的重要策略。
03
AQP4-Ab的产生机制
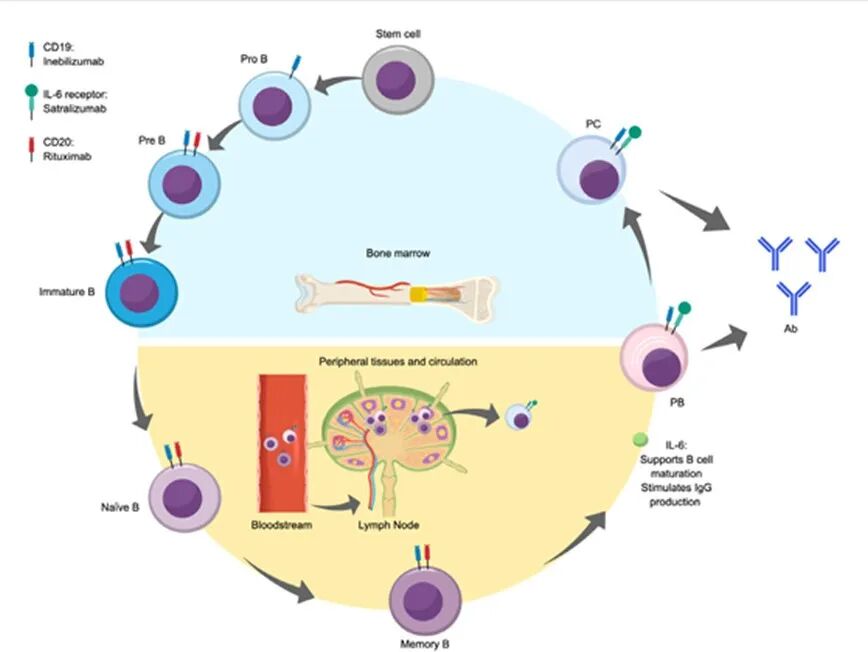
图 2 展示了 B 细胞从骨髓造血干细胞分化成熟为产生抗体的浆母细胞和浆细胞的各个阶段
骨髓中造血干细胞分化成熟为前 B 细胞和未成熟 B 细胞,进而形成初始 B 细胞。分化早期,初始 B 细胞接触抗原后,会在生发中心将抗原呈递给滤泡效应 T 细胞;随后,细胞发生类别转换,形成记忆 B 细胞;当再次接触初始抗原时,记忆 B 细胞通过与外周辅助 T 细胞相互作用,进一步分化为浆母细胞 [3]。IL-6 在 B 细胞生命周期中发挥重要作用:它可作为 B 细胞生长因子,提高 B 细胞存活率,支持 B 细胞成熟与浆细胞分化,并刺激 IgG 产生。
在 NMOSD 中,逃脱自身抗原免疫耐受的 B 细胞可能分化为产生 AQP4-Ab 的浆母细胞和浆细胞。这种免疫系统失调通过以下三种机制发生:胸腺耐受异常、早期 B 细胞耐受异常以及 B 细胞活化与分化异常。
胸腺耐受异常:正常情况下,胸腺 B 细胞以 CD40 依赖的方式表达 AQP4,促进 AQP4 特异性 T 细胞的阴性选择,阻止其存活。但若该机制失效,AQP4 特异性 T 细胞无法被清除,进而可在生发中心为 B 细胞提供共刺激信号,支持自反应性 B 细胞的分化与存活。
早期 B 细胞耐受异常:正常情况下,无反应性诱导、活化诱导的细胞死亡或受体编辑等过程可阻止自身抗体形成。当这些耐受检查点受损或被绕过时,自身抗体便可能产生。
B 细胞活化与分化异常:在 B 细胞活化与分化过程中,CD40 配体及 IL-21 等细胞因子可激活 B 细胞,促进 AQP4 表达并将其呈递给 T 细胞,这种相互作用对 AQP4-Ab 的产生至关重要 [4]。
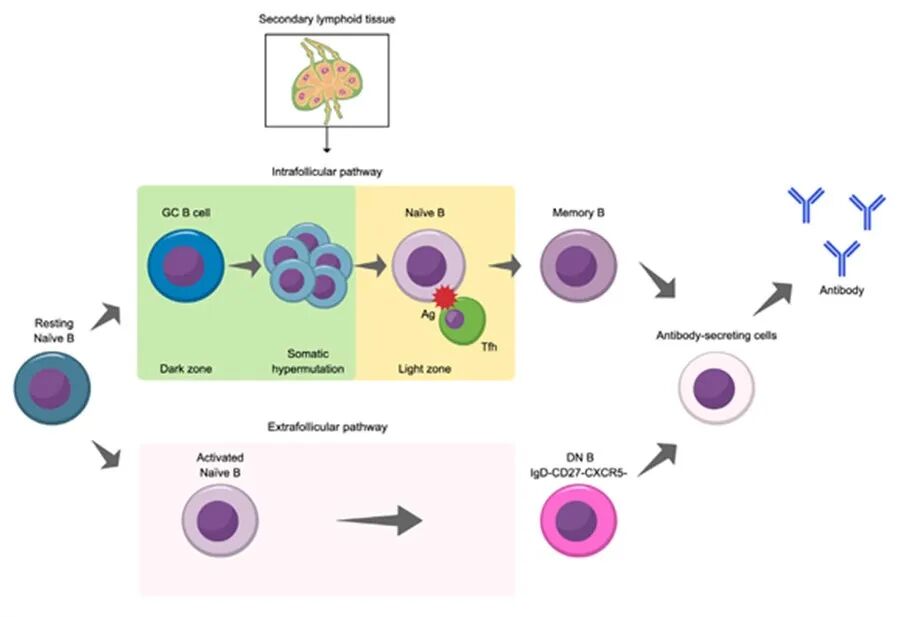
图3
如图 3 所示,B 细胞分化为抗体产生细胞存在两条途径:发生于生发中心内的滤泡内途径,以及发生于生发中心外的滤泡外途径。两条途径存在关键差异:滤泡内 B 细胞活化发生于生发中心,且有证据表明滤泡辅助 T 细胞与滤泡效应 T 细胞参与 NMOSD 病理:在滤泡效应 T 细胞方面,B 细胞作为抗原呈递细胞可促进滤泡效应 T 细胞的发育与活化;反过来,滤泡效应 T 细胞与滤泡辅助 T 细胞类似,也参与 B 细胞分化与类别转换。
04
B细胞耗竭在NMOSD治疗中的疗效与意义
NMOSD 患者血清和脑脊液中,影响 B 细胞的细胞因子(IL-6、IL-17、肿瘤坏死因子家族 B 细胞活化因子(BAFF)、增殖诱导配体)水平升高,因此抑制这些细胞因子可能对患者有益。例如,促炎性细胞因子 IL-6 在 B 细胞分化成熟中起关键作用,而靶向 IL-6 受体的萨特丽珠单抗活
鉴于 B 细胞通过产生致病性 AQP4-Ab 及其他非抗体介导途径在 NMOSD 发病中起核心作用,针对 NMOSD 的新型治疗策略(尤其是靶向 B 细胞耗竭疗法)应运而生。值得注意的是,目前尚无直接比较抗 CD19 与抗 CD20 疗法治疗 NMOSD 疗效的头对头研究。
图 4 总结了 NMOSD 的疾病进程,以及靶向 B 细胞、IL-6 和补体成分 C5 的单克隆抗体药物在作用上的差异。
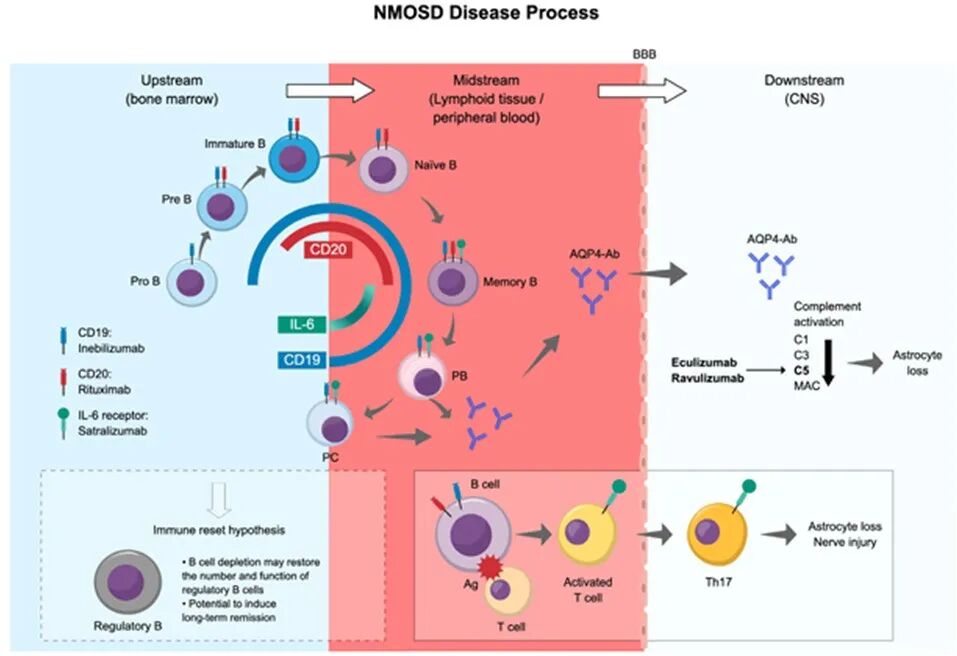
图4
CD19、CD20 等细胞表面标志物的表达与分布,对识别和选择性靶向 B 细胞至关重要 [5]。与抗 CD20 相比,抗 CD19 的优势在于可清除更广泛的 B 细胞谱系,包括产生致病性 AQP4-Ab 的浆细胞和幼年早期原 B 细胞。值得注意的是,即使少量 CD27 + 记忆 B 细胞出现,也会增加疾病复发风险。已有研究报道,深度且持续的 CD20+B 细胞耗竭与长期临床稳定相关,而早期深度 B 细胞耗竭与疾病活动度改善相关。然而,NMOSD 患者外周血中参与抗体产生且数量增多的浆母细胞和双阴性 B 细胞,其 CD20 表达水平较低,因此抗 CD20 抗体可能难以对其实现深度耗竭。
由于产生致病性 AQP4-Ab 的浆细胞不表达 CD20,
未来需进一步研究,明确 NMOSD 患者中 B 细胞耗竭除降低 AQP4-Ab 外的其他作用。已有研究报道,接受伊奈利珠单抗和利妥昔单抗治疗的患者,其 B 细胞计数与 NMOSD 疾病活动度相关—— 这一发现具有重要意义,因为监测 B 细胞计数可能有助于指导治疗决策、预测复发及评估治疗效果,最终帮助临床医生为 NMOSD 患者提供更具针对性的诊疗。
长期使用 B 细胞耗竭药物可能增加严重感染(包括新型冠状病毒感染)的理论风险,这是临床关注的问题之一。然而,一项对利妥昔单抗治疗 NMOSD 患者的 14 年随访研究显示,患者感染率仍较低,且尽管免疫球蛋白水平降低,但感染率与 IgG 水平无相关性。
此外,临床还担忧接受 B 细胞耗竭药物治疗的 NMOSD 患者,其新型冠状病毒疫苗接种后的体液免疫应答可能受损。但需注意,即使血液中的 B 细胞被耗竭,残留的组织驻留 B 细胞仍可能与 T 细胞介导的免疫共同提供一定的免疫保护;此外,即使 B 细胞被清除,骨髓中 CD19−长寿浆细胞仍可维持部分抗体产生。未来需进一步研究,明确 B 细胞清除和 IgG 降低对长期安全性的影响。
晚期 B 细胞(如浆母细胞、浆细胞)表面 CD19 和 CD20 表达的差异,会影响 B 细胞靶向疗法的疗效。选择抗 CD19 或抗 CD20 进行 B 细胞耗竭治疗时,需在疗效与安全性之间寻求最佳平衡:由于 CD19 在 B 细胞谱系中的表达范围比 CD20 更广,抗 CD19 疗法清除 B 细胞的范围比抗 CD20 疗法更广泛,但这种更持久的作用可能导致更高的免疫抑制风险。利妥昔单抗等抗 CD20 疗法不靶向浆细胞等抗体分泌细胞,因此 AQP4-Ab 的产生可能持续存在,需持续或重复治疗。
对于疾病严重风险较高或复发频繁的患者,可能更适合采用抗 CD19 疗法进行更积极的 B 细胞耗竭;而对于疾病较稳定或感染风险较高的患者,抗 CD20 疗法可能是更优选择。但需注意,CD20 也表达于 T 细胞、中性粒细胞等非 B 细胞免疫细胞,可能导致中性粒细胞减少、T 细胞低应答等不良事件。
B 细胞耗竭后,BAFF 的出现可能导致促炎性 B 细胞复苏。但近期一项关于多发性硬化(MS)和实验性自身免疫性脑脊髓炎(EAE)模型的研究显示,BAFF 具有神经保护作用,因此可能也存在有益效应。
遗传因素(如 Fcγ 受体 IIIa(FCGR3A)基因多态性)在 NMOSD 患者的个体化 B 细胞耗竭治疗中也具有重要意义,因为这些因素已知会影响单克隆抗体药物的细胞毒性。研究显示,FCGR3A 基因 158 位氨基酸的 F 等位基因多态性会对利妥昔单抗(抗 CD20 疗法)的疗效产生负面影响,但对伊奈利珠单抗(抗 CD19 疗法)无影响。因此,基因检测可能有助于治疗决策制定,以优化疗效并降低无效治疗的风险。
05
B 细胞清除疗法作为NMOSD治疗策略的未来展望与结论
“免疫重置” 指 B 细胞耗竭后免疫系统的重建过程,即通过清除致病性 B 细胞、再生正常 B 细胞,恢复免疫平衡。评估免疫重置不仅需要分析循环淋巴细胞,还需全面检查血液以外器官和组织中的 B 细胞谱系; 近期一项研究发现,循环 CD11c+B 细胞与 NMOSD 患者脑萎缩相关,这提示需进一步研究 B 细胞耗竭疗法能否长期预防 NMOSD 患者的复发和脑病灶进展。NMOSD 主要通过复发而非持续性无症状进展的观点,将影响未来的治疗方向 —— 强调需同时关注预防症状性复发和亚临床疾病活动。此外,未来 NMOSD 治疗决策中,利用生物标志物判断疾病状态和治疗反应的研究也备受关注;对于利妥昔单抗或伊奈利珠单抗等 B 细胞耗竭疗法,治疗期间的血液 B 细胞计数可能是判断药物应答持续时间的有效生物标志物。
未来研究应关注:NMOSD 患者从其他生物制剂转换为 B 细胞耗竭疗法的影响;伊奈利珠单抗治疗后是否会像利妥昔单抗那样出现 B 细胞重建;继续探索 AQP4-Ab 滴度和非抗体依赖机制在 NMOSD 发病中的作用(这些研究可能为优化治疗策略提供依据)。总体而言,NMOSD 治疗的首要目标是预防复发,因此选择作用机制与患者个体背景特征匹配的生物制剂至关重要。
参考文献:
[1]中华医学会神经病学分会神经免疫学组. 中国视神经脊髓炎谱系疾病诊断与治疗指南(2025版)[J]. 中华神经科杂志,2025,58(7):687-703.
[2] Pittock SJ, Zekeridou A, Weinshenker BG. Hope for patients with neuromyelitis optica spectrum disorders- from mechanisms to trials. Nat Rev Neurol. (2021) 17:759 73.
[3]Asashima H, Mohanty S, Comi M, Ruff WE, Hoehn KB, Wong P, et al. PD 1highCXCR5-CD4+ peripheral helper T cells promote CXCR3+ plasmablasts in human acute viral infection. Cell Rep. (2023) 42:111895.
[4]Wilson R, Makuch M, Kienzler AK, Varley J, Taylor J, Woodhall M, et al. Condition-dependent generation of aquaporin-4 antibodies from circulating B cells in neuromyelitis optica. Brain. (2018) 141:1063–74.
[5]Forsthuber TG, Cimbora DM, Ratchford JN, Katz E, Stüve O. B cell-based therapies in CNS autoimmunity: differentiating CD19 and CD20 as therapeutic targets. Ther Adv Neurol Disord. (2018) 11:1756286418761697.
[6]Ochi H, Nakamura S, Nakahara J. B cell depletion as a therapeutic strategy for neuromyelitis optica spectrum disorder: rationale, evidence, and challenges. Front Immunol. 2025 Aug 18;16:1635989.
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)