随着人们对衰老问题的关注度日益提升,表观遗传学(epigenetics)在皮肤老化领域的研究逐渐成为热点,其相关改变也被视作衰老的关键生物学标志之一。表观遗传作为一种特殊的基因表达调控机制,其核心特点在于不涉及基因序列的改变。而皮肤作为人体最大的器官,直接暴露于多种外界因素,更容易受到相关表观遗传学失衡的影响。表观遗传学不仅为深入剖析皮肤老化的复杂机制开辟了新的路径,还为开发新的衰老评价方式和干预方法提供了思路。
1.皮肤老化与表观遗传学的概念及联系
衰老是身体各器官机能随年龄增长而逐渐退化的过程。在这一过程中,皮肤的老化表现尤为显著。在外观上,老化皮肤会出现异常色素沉着、皱纹形成、粗糙、干燥、弹性下降,以及
表观遗传学是一种可逆的生物学机制,在个体对环境刺激的响应及调控衰老进程的调控中发挥着重要作用。其通过DNA甲基化(DNA methylation)、组蛋白修饰(histone modification、非编码RNA(non-coding RNA, ncRNA)介导的调控以及染色质重塑(chromatin remodeling)等机制,能够在不改变DNA序列的前提下影响基因表达(图1)。这些表观遗传学模式的形成和维持需要多种酶的参与,如DNA甲基转移酶(DNA methyltransferases, DNMT)、组蛋白乙酰转移酶(histone acetyltransferase)、组蛋白去乙酰化酶(histone deacetylase,HDAC)等。
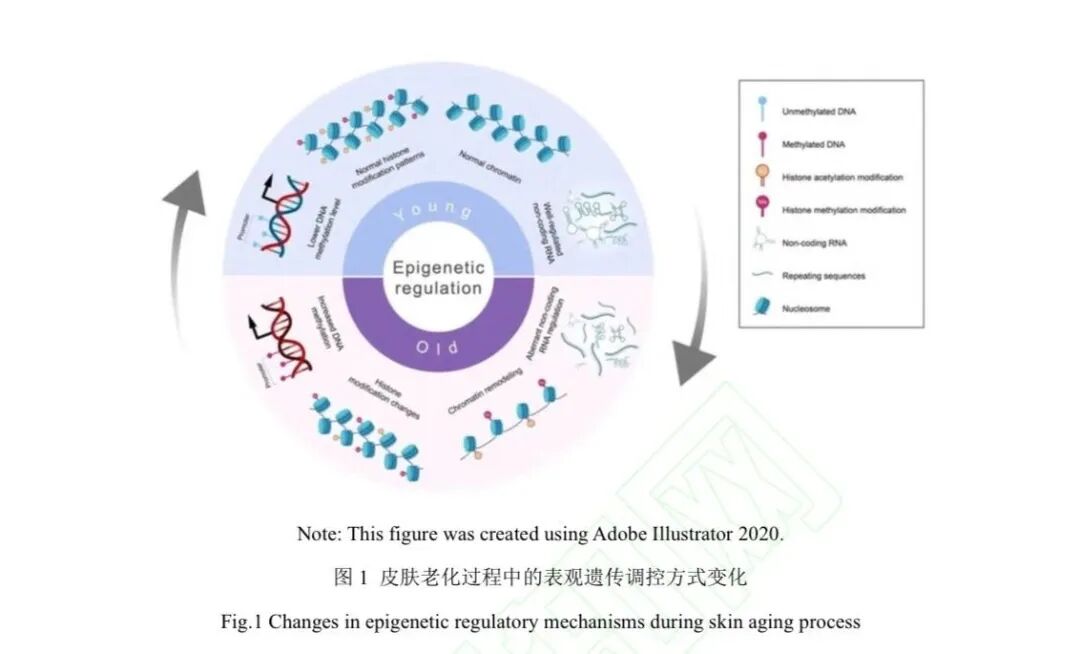
皮肤因其易于采样、可直观呈现环境因素影响、表观遗传标记相对稳定、主要由大量同 一类型的细胞构成且具有为人熟知的衰老表型,成为表观遗传学研究的理想载体。此外,皮肤的甲基化模式在个体之间存在高度一致性,这一特点便于研究者用小样本识别统计学上的变化。
2.皮肤老化中的表观遗传学机制
2.1DNA甲基化
DNA甲基化是皮肤老化表观遗传学研究中最为深入的领域之一。这一过程由DNA甲基转移酶(包括DNMT1、DNMT3A、DNMT3B)催化,通过在DNA分子的特定关键位置添加甲基基团(通常是CpG岛中的胞嘧啶核苷酸),改变相应位点的化学修饰状态,进而影响基因的转录活性。
随着年龄的增长,皮肤组织的DNA甲基化模式会发生明显的变化,表现为全基因组的整体甲基化水平降低,而在某些特定区域(例如CpG岛)则呈现高甲基化特征。甲基化变化在衰老过程中主要集中在增强子区域,提示增强子在衰老调控中发挥关键作用。值得注意的是,皮肤老化过程中甲基化模式的改变呈现非线性特征,这种不连续的甲基化变化 可能成为皮肤老化的独特标志。年龄的增长还会导致甲基化模式的稳定性降低,老年表皮样本间的甲基化模式异质性显著高于年轻群体。外源性因素所导致的皮肤衰老同样影响DNA甲基化,例如:长期日晒导致的光老化与低甲基化趋势相关,而紫外线急性照射则引发表皮全基因组的广泛去甲基化。
关键酶的表达变化是DNA甲基化模式改变的重要原因。DNMT1主要负责维持甲基化水平,在衰老的皮肤成纤维细胞中浓度显著降低,进而导致低甲基化状态的出现;但在急性的窄谱中波紫外线(UVB)照射后,成纤维细胞中DNMT1表达反而增加。DNMT3A和DNMT3B负责在未曾甲基化的DNA区域添加新的甲基化标记。研究发现,衰老的皮肤成纤维细胞中DNMT3A与 LOXL1启动子区域的结合增强,影响弹性纤维的生成,导致皮肤的弹性以及修复能力下降。10-11易位双加氧酶(Ten-eleven translocation, TET)是参与DNA去甲基化的关键酶,其表达水平呈年龄依赖性下调。体外实验显示,TET1和TET2的过表达会在不同程度上抑制皮肤成纤维细胞的增殖、诱导衰老并引起DNA损伤,表明TET的异常表达可能参与了衰老相关的细胞功能调控。此外,在经过UVB照射的光老化角质形成细胞中,TET的表达显著增高,进而导致细胞内羟基胞嘧啶的表达水平升高。这些发现提示,针对酶的调控可能成为逆转或减缓衰老进程的重要靶点。
2.2.非编码
RNA非编码RNA指不编码蛋白质的RNA分子,包括长非编码RNA、微小RNA(microRNA, miRNA)、小干扰RNA和环状RNA等,这些表观遗传因子在衰老过程中扮演重要角色。
miRNA是目前研究的热点领域之一,在皮肤老化过程中,多个miRNA的表达发生显著变化并参与衰老调控。miR-31在老化皮肤中显著上调,通过靶向关键昼夜节律基因Clock并激活MAPK/ERK通路,导致毛囊干细胞功能衰竭。条件性敲除miR-31或使用MAPK/ERK抑制剂均可以有效抑制皮肤老化过程。miR-126是内皮细胞中最丰富的miRNA,具有保护血管、诱导新生血管生成的重要功能。随年龄增长,miR-126的表达水平下降,这是老化皮肤中毛细血管数量减少和结构退化的重要原因。此外,miR-146a的下调会加剧胶原蛋白的降解,增加紫外线照射后的DNA损伤,同时抑制成纤维细胞和角质形成细胞的增殖。DNMT1在皮肤干细胞维持和组织自我更新中通过抑制INK4a/ARF基因座发挥关键作用,对于成纤维细胞和角质形成细胞的功能具有重要调控意义。然而,DNMT1的表达受到miR-377的负向调控,miR-377可通过靶向DNMT1来调控p53的甲基化水平,从而介导人皮肤成纤维细胞衰老过程。
除了基于miRNA的研究视角,在一项基于健康人群原代皮肤成纤维细胞的体外模型中,研究者利用高通量RNA测序技术,系统地鉴定了随着年龄增长而差异表达的长非编码RNA。研究结果表明,部分长非编码RNA和环状RNA的表达变化呈现出非线性特征,且在50岁以后更为显著。进一步分析揭示,非编码RNA可能通过与转录因子和RNA结合蛋白相互作用,以跨分子机制调控衰老相关基因表达,为开发相应治疗策略提供了新的视角。
2.3.组蛋白修饰
组蛋白是染色质的主要结构蛋白,其修饰主要指针对组蛋白上
组蛋白甲基化受到组蛋白甲基转移酶和去甲基化酶的共同调控。衰老会导致表皮干细胞的干性下降,表现为数量减少、功能减退以及再生周期延长等。研究证据表明,组蛋白H3在
组蛋白的乙酰化修饰通过松弛核小体结构,使转录因子能够更易于结合特定的DNA序列,从而激活基因转录。在老化皮肤中,组蛋白H3的乙酰化水平显著增加,而HDAC的整体活性下降,其中HDAC4和HDAC11的表达均显著降低。进一步研究发现,HDAC4的低表达通过激活JNK通路导致MMP1表达增加以及I型前胶原蛋白减少。Sirtuin1(SIRT1)是研究最为广泛的去乙酰化酶之一,其表达水平随着年龄的增长而下调。SIRT1与成纤维细胞的数量以及增殖能力密切相关,维持其表达水平可以有效延缓成纤维细胞的衰老。此外,SIRT1还调控丝聚蛋白的表达,丝聚蛋白的表达减少会导致皮肤屏障功能受损。紫外线辐射会抑制SIRT1的表达,导致乙酰化的p53激活细胞凋亡通路。这些组蛋白修饰的变化为皮肤老化提供了可干预的靶点。
2.4.染色质重塑
染色质重塑是一种通过改变染色质结构来调控基因表达的表观遗传调控机制,可使染色质在紧密异染色质与松散常染色质两种状态间转换,从而调节基因的激活和沉默。
染色质结构的改变在衰老过程中影响基因表达的效率和稳定性,从而加速老化进程。研究表明,p63对于表皮细胞的发育和分化至关重要,通过协调多个染色质重塑通路维持表皮稳态。例如,p63通过结合SATB1基因上游的调控区域促进其表达;而SATB1可以通过结合表皮分化相关的基因簇对这些基因的染色质结构进行组织,从而支持表皮的形态发生和功能分化。此外,p63还直接调控ATP依赖性染色质重塑酶BRG1,该酶在表皮分化复合体的高级染色质结构重塑中起着关键作用。表皮分化复合体是一组基因簇,包含了多个与角质形成细胞分化以及角质层形成相关的基因,在表皮形态发生过程中起到重要的调控作用。值得注意的是,由于染色质重塑机制的复杂性和当前技术的限制,其在皮肤老化过程中的作用尚未被阐明。未来,染色质重塑在皮肤老化研究中有望得到更多关注,其与其他表观遗传机制的协同作用可能为理解衰老过程提供新的视角。
3.皮肤老化表观遗传调控机制研究的应用现状
3.1.基于表观遗传学的皮肤老化检测工具
目前,研究人员已开发了众多基于表观遗传学的衰老检测工具,其中表观遗传时钟被认为是其中最有前景的模型。
表观遗传时钟基于CpG位点的甲基化水平来估计个体年龄,现已开发的第一代表观遗传时钟(包括Horvath表观遗传时钟,Hannum表观遗传时钟)和第二代表观遗传时钟(包括PhenoAge和GrimAge)之间的差别主要在于:①纳入的年龄相关CpG位点的数量和 种类不同;②所适用的组织及细胞类型不同;③所使用的芯片平台不同。Horvath表观遗传时钟是目前应用最广泛的年龄预测模型,其测量的表观遗传年龄与实际年龄的相关性可达0.96,误差低至3.6年。第二代表观遗传时钟则在第一代表观遗传时钟的基础上纳入了多种临床生物标志物,进一步提升了准确性。近年来,研究人员还开发了了针对皮肤组织的表观遗传时钟,如Skin&Blood Clock。
值得注意的是,现有的表观遗传时钟模型主要基于欧美人群,针对亚洲人群(尤其是中国人群)的模型亟待建立。目前,表观遗传时钟的发展正呈现出多元发展趋势,模型的研发正在朝着精准、个性、无创,乃至跨物种的方向前进。近年来,研究者提出了一系列创新模型,包括基于单细胞甲基化数据建立的单细胞年龄时钟(scAge),通过颊黏膜拭子获取DNA甲基化数据的CheekAge,以及利用表皮样本DNA甲基化水平来预测皮肤的皱纹等级、视觉面部年龄和视觉衰老进展的第二代表观遗传时钟VisAgeX。随着技术的进步,尤其是与人工智能的深度融合,研究人员有望开发出更加精准和高效的预测模型。同时也期待通过全国范围内的多中心研究,收集中国人群的表观遗传数据以及临床数据,建立具有代表性的大样本数据库。
3.2.基于表观遗传学的延缓皮肤老化策略
已有的表观遗传学研究为表观遗传调节剂的应用提供理论基础,除此之外,干细胞重编程技术以及改善生活方式也是潜在的延缓皮肤老化策略(图2)。多样的干预手段使制定个性化的抗衰策略以及真正实现精准干预成为可能。
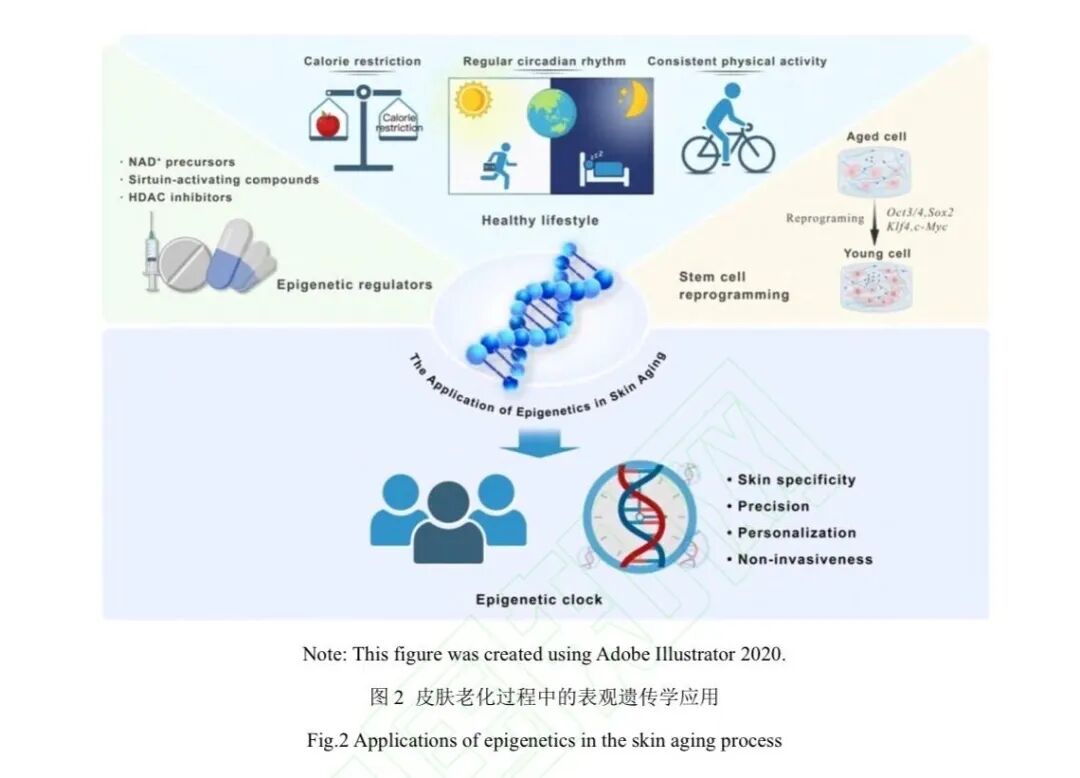
3.2.1表观遗传调节剂:表观遗传调节剂是一类可以调节细胞的表观遗传特征的化合物或分子,常见类型包括:NAD+前体、SIRT激活剂、DNMT1抑制剂等。NAD+是细胞中重要的氧化还原辅酶,在表观遗传的调控中发挥重要作用。作为SIRT的底物,SIRT的组蛋白去乙酰化作用高度依赖于NAD+的水平。研究表明,随着年龄的增加,NAD+的水平逐渐下降,而通过补充 NAD+的前体物质(包括
SIRT激活剂是另一类潜在的具备抗衰作用的表观遗传调节剂。白藜芦醇(Resveratrol)是一种代表性的SIRT2激活剂,研究表明其可通过降低DNA甲基化水平及调节线粒体动力 学延缓脂肪干细胞衰老。然而,目前关于其在皮肤老化方面的研究相对匮乏,亟待进一步深入探究。 DNMT1作为表观遗传的重要调控靶点,其抑制剂被视为潜在的表观遗传调节剂。近期研究开发了针对一种DNMT1选择性活性位点的小分子抑制剂GSK3685032,在体内实验中展现出了良好的耐受性,提示选择性的DNMT1抑制可能是一种兼具有效性与安全性的延缓衰老策略。此外,二氢杨梅素(DHM)作为一种DNMT1的活性位点抑制剂,能够有效 逆转人角质形成细胞的表观遗传年龄,并在人类皮肤模型中展现出显著的抗衰老效果。
3.2.2干细胞重编程:干细胞重编程技术为抗衰老研究开辟了全新的视角,其核心是通过山中因子(Yamanaka factors)诱导已分化的体细胞重新编程,使其恢复到类似胚胎干细胞的多能状态。这一突破有望逆转与衰老相关的功能退化,并提高组织的再生能力。研究发现,山中因子的持续表达可以导致广泛的染色质重塑,甚至使部分细胞恢复至年轻状态。然而,潜在的致瘤风险限制了该技术的临床转化。进一步的研究显示,短暂的重编程同样可以使衰 老的体细胞年轻化,同时有效规避了体细胞被重编程为诱导多能干细胞的风险。已有研究发现,通过转染山中因子以及LIN28、NANOG的mRNA能显著逆转人类多种细胞类型的表观遗传年龄。然而,尽管重编程的体外相关研究已展现初步成效,其向体内应用的转化仍面临诸多挑战。
3.2.3改善生活方式:生活方式的改变是有效的抗衰老策略,包括热量限制、规律作息以及坚 持运动等。多项临床研究结果表明,热量限制有助于降低生物学年龄、改善器官功能,并预防疾病的发生。在小鼠模型中,昼夜节律的紊乱会增加老年小鼠的死亡率。类似地,在人类中,短期的不规律作息会导致血压升高和炎症指标上升。运动作为一种重要的抗衰手段,同样展现了显著的益处,例如,耐力训练可以改善老年人的肌肉功能,而阻力训练 可以降低老年人骨骼肌线粒体甲基化组的水平,从而部分逆转与衰老相关的表观遗传变化。
4.结论与展望
随着全球老龄化的加剧,衰老相关研究的重要性日益凸显。皮肤作为人体最大的器官,其老化过程直接影响到个体的健康和生活质量。近年来,皮肤老化的表观遗传学研究成果丰硕,充分彰显了表观遗传学在皮肤老化调控进程中的关键作用。
参考文献:
1.成夕,付乔雨,鲁楠,李青峰.皮肤老化的表观遗传学调控:研究进展与应用前景[J/OL].中国皮肤性病学杂志.https://link.cnki.net/urlid/61.1197.
2.López-Otín C,Blasco MA,Partridge L,et al.Hallmarks of aging:an expanding universe[J].Cell,2023,186(2): 243-78.
3.Kroemer G, Maier AB,Cuervo AM, et al. From geroscience to precision geromedicine:understanding and managing aging[J].Cell,2025,188(8): 2043-2062.
4.其他文献略。
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)