
来源:IBD Daily
利生奇珠单抗是一种选择性白细胞介素-23 p19抑制剂,已获批准用于治疗成人中重度活动性克罗恩病 (CD)。该研究报告了正在进行的SEQUENCE试验第二部分的中期结果,旨在评估利生奇珠单抗在既往抗肿瘤坏死因子 (TNF) 治疗失败的活动性CD患者中的长期疗效与安全性。
SEQUENCE 是一项正在进行的3b期、多中心、开放标签、疗效评估者盲法的随机试验;入组对象为对抗TNF治疗反应不足或不耐受的中度至重度活动期CD患者,患者被随机分配接受利生奇珠单抗或
疗效不足的定义为:平均日大便次数 (SF) ≥3.3和/或平均日腹痛评分 (APS) ≥1.5,并伴随炎症指标异常。炎症指标包括高敏感C反应蛋白 (hs-CRP) ≥5mg/L,
研究采用OLE意向性治疗人群进行中期分析,评估至第100周的疗效与安全性。疗效采用观测值 (AO)、缺失视为无应答 (NRI) 及
共计224名接受600 mg IV诱导并随后接受360 mg SC维持方案的患者进入SEQUENCE试验的OLE。OLE利生奇珠单抗维持治疗的临床疗效总体稳定。自第52至第100周,按CDAI计算的临床缓解率维持≥76%,按SF/APS计算的临床缓解率维持≥72%。接受额外治疗者亦可获得显著改善,其在首次额外治疗后24与48周CDAI与SF/APS计算的临床缓解率均≥57%。大多数 (≥99%) 实现临床缓解的患者在随访日或随访日前90天内均未使用
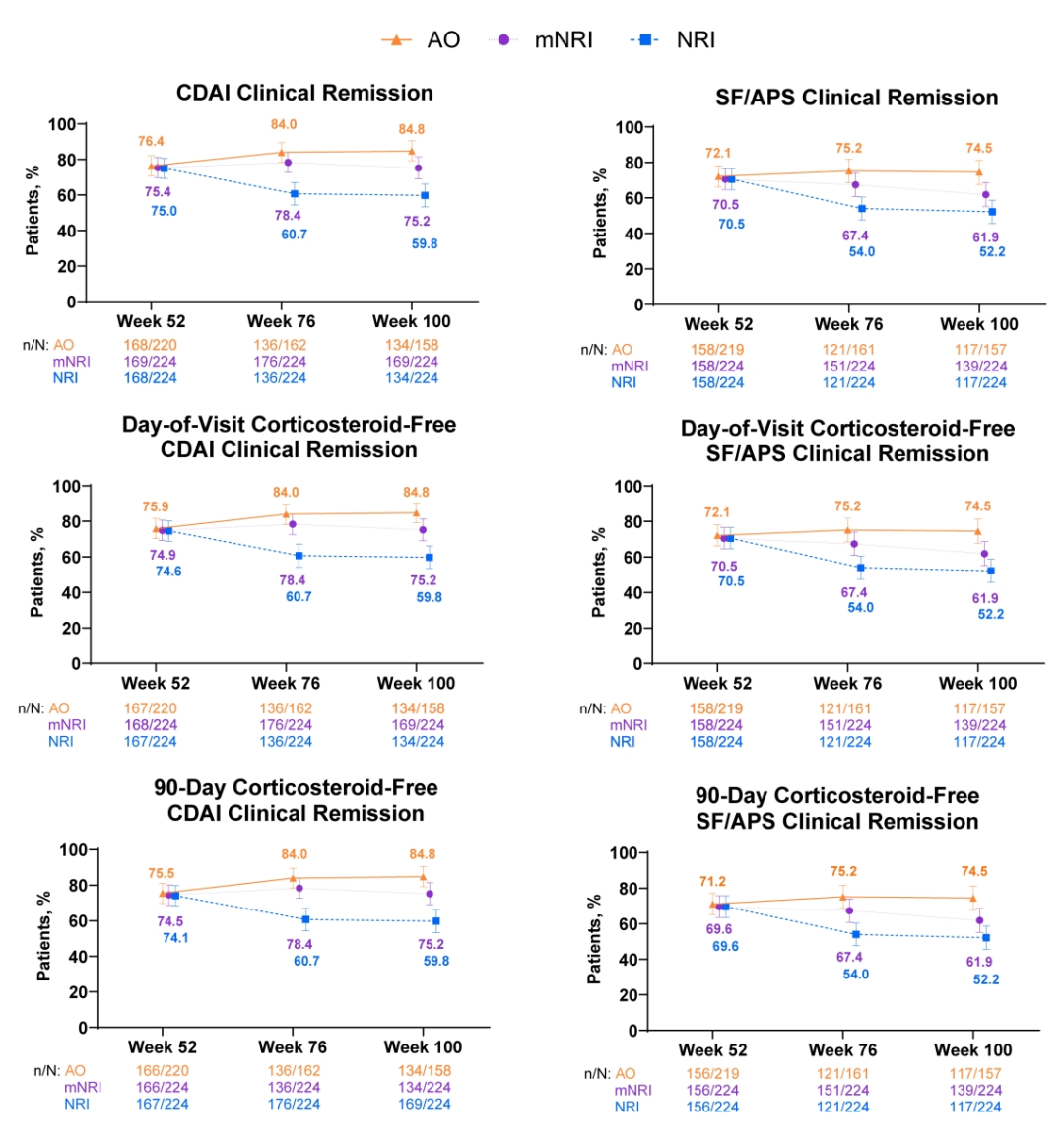
图1. 临床缓解与无皮质类固醇临床缓解情况。
OLE起始 (第52周) 即已达临床缓解的患者多能维持临床缓解至第100周 (CDAI 92.1%,SF/APS 86.3%)。基线炎症指标升高者多数在第100周恢复正常 (hs-CRP 63.1%,FCP 63.5%)。至数据截止,经暴露时间校正的CD相关住院发生率为0.03 (95% CI: 0.01,0.05) 例/患者年 (n/PY)。至数据截止,经暴露时间校正的CD相关手术发生率为0.01 (95% CI: -0.001,0.02) n/PY。患者在
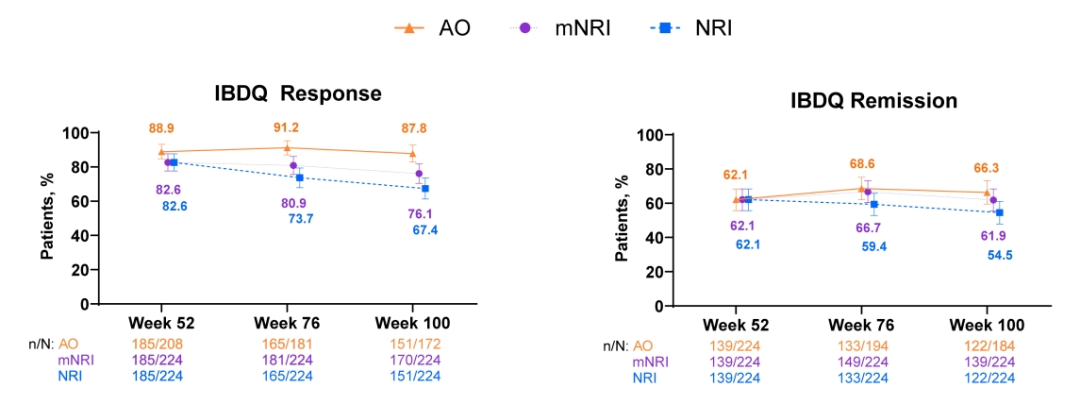
图2. IBDQ应答和缓解。
同样,患者在SF-36量表中身体成分评分 (PCS) 和精神成分评分 (MCS) 方面在100周内分别有 ≥80%与 ≥69%的患者达到临床意义改善 (图3)。在所有疗效终点上,mNRI与NRI分析结果呈现出与AO分析类似的趋势。
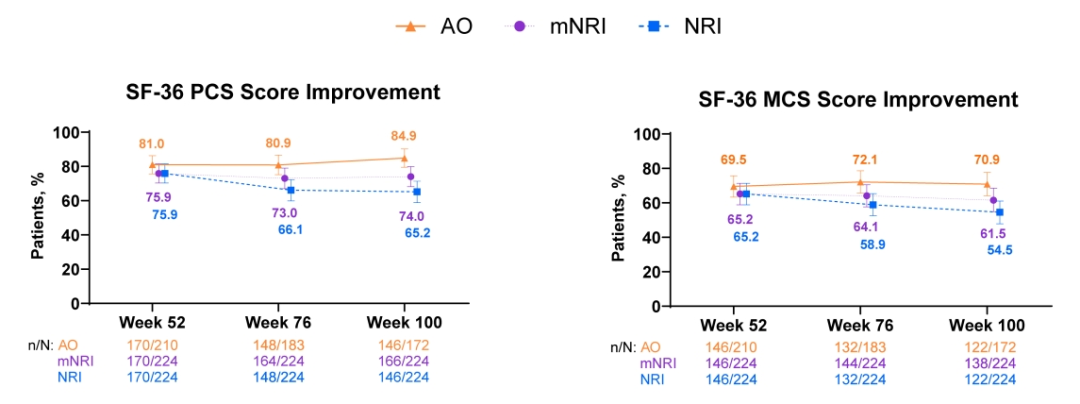
图3. SF-36量表中身体成分评分 (PCS) 和精神成分评分 (MCS) 改善情况。
研究显示利生奇珠单抗的整体安全性良好,最常见不良事件为COVID-19、鼻
本次对持续开放标签利生奇珠单抗治疗的中期分析表明,在中重度活动性CD患者中,该疗法显示出持续长期的临床疗效,且未出现新的安全性信号。未来的分析将进一步评估其更长期的临床、内镜结局及安全性。
致谢
中南大学湘雅三医院 温小燕
浙江大学医学院附属第二医院 孙誉郝
中南大学湘雅三医院
中南大学湘雅三医院
对本篇文章解读做出的贡献
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)