20世纪80年代,观察到伴有狼疮抗凝物(LA)阳性反应的年轻女性在
抗磷脂抗体(aPL)在自身免疫性风湿病女性孕前咨询中的临床意义何在?
与普通产科人群相比,ARD患者更容易出现妊娠丢失或产科并发症。孕前咨询与产前风险分层是降低ARD患者不良妊娠结局(APO)的最有效策略。除需重点讨论疾病活动度、器官受累情况及治疗方案外,明确患者的自身抗体谱特征也是有效孕前咨询的关键环节。
在可能影响妊娠的自身抗体中,aPL与不良妊娠结局的相关性最为显著。当aPL与血栓形成及妊娠并发症同时出现且无其他自身免疫疾病时,即诊断为原发性抗磷脂综合征(PAPS);而aPL也可能伴随其他自身免疫性疾病、感染性疾病、药物相关疾病及恶性肿瘤出现(继发性APS)。
APS最早在
对于计划怀孕的女性,即便无症状携带者若检测出抗磷脂抗体阳性,也可能彻底改变孕前、孕期及产后护理方案。因此,建议对所有未接受过抗磷脂抗体三项标准检测的抗磷脂相关疾病患者,在孕前检查时提供抗体检测服务。
aPL对胎盘的致病性影响是什么?
研究表明,在obAPS动物模型中,aPL具有致病性,且已发现多种作用机制。由于组织分布特征和这些发现支持了血栓形成、炎症反应和补体激活在产科疾病发病机制中的协同作用。首先,β2GPI(aPL识别的主要抗原)的高表达水平,胎盘成为aPL的易感靶点。在obAPS中,胎盘母体和胎儿两侧均可观察到血栓性和非血栓性机制(图1A)。正常妊娠期间会发生母体免疫反应,但急性炎症并非生理现象;而在obAPS中,炎症事件频繁且在妊娠早期即出现,这表明其在胎盘功能不全的发展中起着主导作用(图1B)。
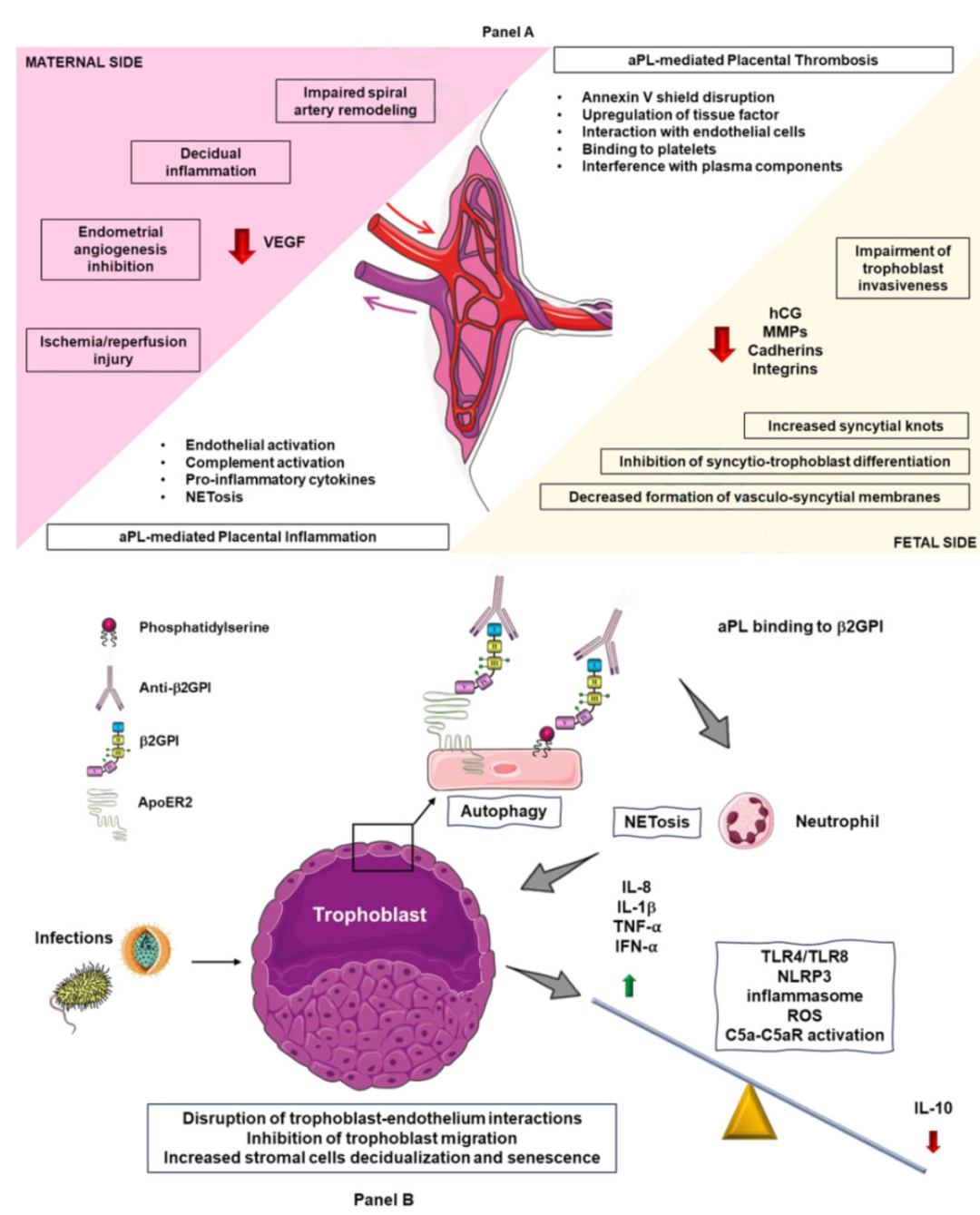
图1.产科抗磷脂综合征的发病机制。(A)血栓性和非血栓性抗磷脂(aPL)介导机制在母体与胎儿两侧的总体概述。(B)聚焦于滋养层/胎盘水平的aPL介导炎症反应。a滋养层炎症可通过aPL与靶抗原β2GPI结合引发,β2GPI是滋养层和胎盘水平高度丰富的蛋白质。载脂蛋白E受体2(ApoER2)可与β2GPI相互作用,作为抗β2GPI-β2GPI复合物的受体,进而激活内皮细胞。先天免疫在早期阶段似乎发挥着作用,包括补体激活和中性粒细胞募集形成中性粒细胞胞外陷阱(NETs)。由内皮线粒体功能障碍诱导的自噬被提出作为额外机制。通过激活TLR-4/TLR-8和NLRP3炎性体,炎症滋养层分泌TNFα、IL-1β、IFN-α和IL-8,同时绕过负调控因子。活性氧(ROS)有助于炎症的持续。研究表明,适应性免疫的多种细胞类型参与其中,包括产生抗体的B细胞和β2GPI特异性T细胞。研究发现,源自细菌和病毒的分子成分会促进滋养层炎症的发生和加剧,这表明感染可能在胎儿-母体界面引发异常且过度的炎症反应。a为图示清晰起见,仅展示了滋养层在早期发育阶段的示意图。aPL:抗磷脂抗体;ApoER2:载脂蛋白E受体2;β2GPI:β2糖蛋白I;C5a/C5aR:补体因子5a/补体因子5a受体;hCG:人绒毛膜促性腺激素;IL:白细胞介素;MMPs:基质金属蛋白酶;NET:中性粒细胞胞外陷阱;NLRP3:含吡啶结构域的NLR家族蛋白3;TLR:Toll样受体;TNF:肿瘤坏死因子;IFN:干扰素;ROS:活性氧;VEGF:血管内皮生长因子
对aPL阳性孕妇胎盘组织的组织学分析显示,存在梗死灶、螺旋动脉重塑受损、蜕膜炎症、合胞体结节增多、血管合胞体膜减少以及补体裂解产物沉积,这些发现支持了血栓形成、炎症反应和补体激活在产科疾病发病机制中的协同作用。首先,β2GPI通过与细胞表面结合与内皮细胞相互作用,诱导促凝血和促炎性内皮表型。内皮细胞和血单核细胞上组织因子表达上调,促进内皮白细胞黏附、细胞因子分泌及前列腺素E2合成。此外,抗磷脂抗体(aPL)识别血小板表面表达的磷脂结合蛋白,引发血小板聚集,并干扰凝血级联反应的血浆成分,抑制抗凝活性并影响纤溶过程。它们还会破坏滋养层和内皮细胞单层上的抗凝血蛋白膜—膜联蛋白A5。补体激活的关键作用得到以下发现的支持:补体缺陷型妊娠动物可免受被动输注aPL的致病效应,而补体正常动物通过阻断补体激活同样获得保护。
胎盘细胞的分化与侵袭性增强,以及促炎表型的诱导,导致细胞凋亡和胎盘发育缺陷;这一过程使得母体螺旋动脉无法被血管内滋养层细胞充分堵塞,从而引发早期妊娠丢失。若妊娠继续发展,低灌注胎盘可能引发子痫前期(PE)和宫内生长受限(IUGR)。有观点认为,血栓性妊娠相关性子痫(obAPS)与产科相关性子痫(vAPS)应被视为不同病理实体--由于产科相关性子痫中血栓事件罕见,而胎盘层面的炎症反应远超血管性子痫中的水平。该假说得到多项研究支持:仅妊娠并发症患者体内的IgG可抑制人滋养层细胞系的侵袭,且纯产科相关性子痫与纯血栓性子痫患者在基因表达层面存在显著差异。
结论
对抗磷脂抗体阳性女性的咨询是风湿科门诊日常诊疗的重要组成部分:除明确的抗磷脂抗体阳性患者外,还有抗磷脂抗体阳性且患有抗磷脂相关疾病(ARD)的患者,以及无症状的抗磷脂抗体携带者。个体化风险分层对于制定孕期管理方案至关重要。
参考文献
1.Miyakis S, Lockshin MD, Atsumi T et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost 2006;4:295–306.
2. Barbhaiya M, Zuily S, Naden R et al. 2023 American College of Rheumatology (ACR)/EULAR antiphospholipid syndrome classification criteria. Arthritis Rheum 2023;75:1687–1702.
3. Andreoli L, Bertsias GK, Agmon-Levin N et al. EULAR recommendations for women’s health and the management of family planning, assisted reproduction, pregnancy and menopause in patients with systemic lupus erythematosus and/or antiphospholipid syndrome. Ann Rheum Dis 2017;76:476–485.
4. El Hasbani G, Viola M, Sciascia S, Taher AT, Uthman I. Antiphospholipid antibodies in inflammatory and autoimmune rheumatic and musculoskeletal diseases beyond lupus: a systematic review of the available evidence. Rheumatol Ther 2021;8:81–94.
5.Walter IJ, Klein Haneveld MJ, Lely AT et al. Pregnancy outcome predictors in antiphospholipid syndrome: a systematic review and meta-analysis. Autoimmun Rev 2021;20:102901.
6.Del Barrio-Longarela S, Martınez-Taboada VM, Blanco-Olavarri P et al. Does adjusted Global Antiphospholipid Syndrome Score (aGAPSS) predict the obstetric outcome in antiphospholipid antibody carriers? A single-center study. Clin Rev Allergy Immunol. 2022;63:297–310.
医脉通是专业的在线医生平台,“感知世界医学

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)