来源:IBD Daily
最后通讯:
杜峻峰,现任解放军总医院第七医学中心普通外科副主任,主任医师、副教授,医学博士,硕士研究生导师。兼任国家及北京市自然科学基金委员会评审专家,中国自动化学会医学机器人专业委员会委员,北京市医学会外科学分会胃肠外科学组委员,中国研究型医院协会
炎症性肠病(IBD)包括溃疡性结肠炎与克罗恩病,其病理特征为慢性复发性肠道炎症和组织损伤。尽管抗TNF-α、生物制剂和靶向性免疫治疗已显著改善患者管理,但仍有30–40%患者对抗TNF或整合素治疗反应不佳或效应衰减(1)。干细胞治疗被视为潜在突破方向,但现有干细胞疗法存在归巢率低、制造过程复杂及致瘤风险等不足(2)。人脱落乳牙干细胞(SHEDs)增殖活跃,但其在肠炎微环境中的分化命运及是否能同时修复上皮与免疫失衡此前仍未明确。
2025年11月20日,解放军总医院普通外科医学部杜峻峰主任医师课题组、上交瑞金医院刘海洋副研究员课题组与中科院生物物理所阎锡蕴院士团队等多家单位合作,在eBiomedicine上发表题为Harnessing dental stem cell-derived synovial cells for IBD therapy: dual modulation of gut immunity and crypt repair的研究论文。该研究首次发现SHEDs在模拟肠道炎症的环境下可分化为一种特殊细胞——静息态滑膜样成纤维细胞(QFLSs),通过促进肠道隐窝潘氏细胞或化生潘氏细胞增殖和促进Tregs在肠道积累的双重机制来缓解炎症性肠病。

论文首页
研究首先在DSS(UC模型)和TNBS(CD模型)小鼠中验证SHEDs的治疗潜力。尾静脉输注SHEDs或炎症条件培养基诱导的CM-SHEDs后,小鼠体重下降明显缓解,疾病活动指数(DAI)降低,肠管缩短、小肠
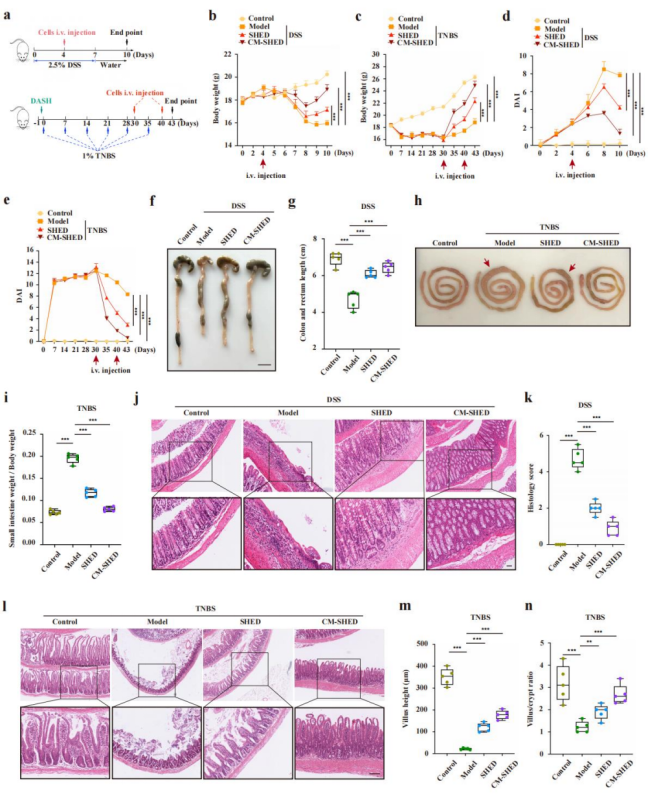
图1.SHEDs和CM-SHEDs能够明显缓解IBD症状
为了进一步理解SHEDs的效应机制,研究者对SHEDs与CM-SHEDs进行了单细胞RNA测序。分析显示,SHEDs可分为三个基本亚群,而CM-SHEDs在炎症模拟条件下形成三个新的亚群(C4–C6)。其中C5亚群表达一系列特征基因,包括TGM2、TFPI2、MMP1、IL-6、HES1等,表明其具有类滑膜成纤维细胞样特征。多重免疫荧光(mIHC)进一步证实,TGM2与TFPI2、MMP1、IL-6、HES1等关键分子共表达,验证了C5细胞的独特谱系。此亚群被定义为TGM2⁺TFPI2⁺静息态滑膜样成纤维细胞(QFLSs),构成SHEDs参与肠黏膜修复的主要细胞类别。
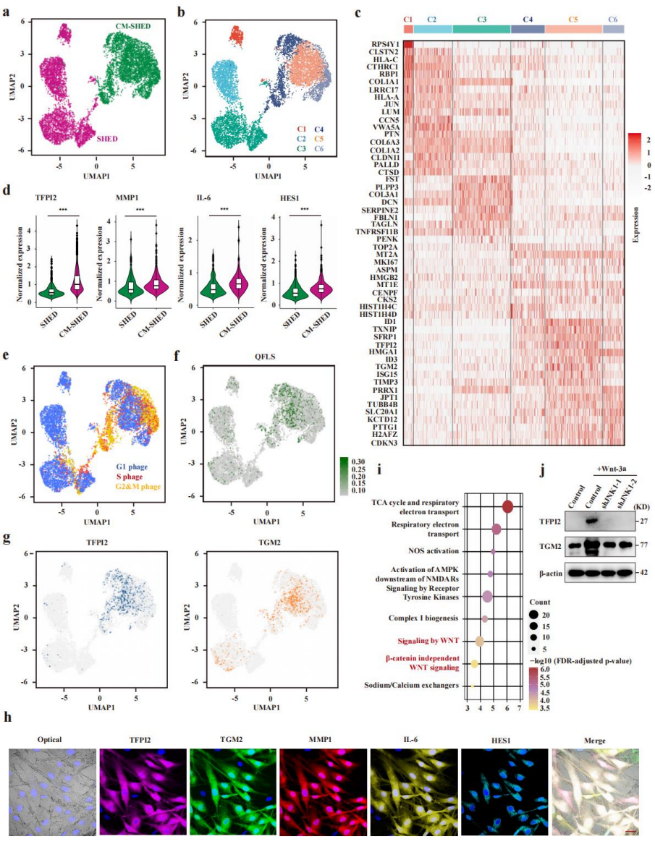
图2.SHEDs通过非经典Wnt通路分化为QFLSs
为明确不同细胞亚群的功能差异,研究者将CM-SHEDs中的TGM2⁺与TGM2⁻细胞分别进行回输实验。结果显示,只有TGM2⁺细胞能够显著改善DSS和TNBS小鼠的体重、DAI以及组织病理特征,TGM2⁻细胞未表现出显著治疗效果。组织定位分析显示,TGM2⁺ QFLSs主要停留在肠黏膜固有层,这种定位与肠上皮修复和免疫调控密切相关,表明该细胞群是SHED整体治疗效应的核心来源。
在探索QFLSs如何促进肠上皮再生时,研究将重点聚焦于潘氏细胞在隐窝稳态中的作用。在类器官实验中,外源性添加IL-6可显著增大隐窝类器官直径,而IL-6中和后,QFLSs对类器官的促进作用完全丧失。人源IBD类器官实验亦显示相同趋势。潘氏细胞特异性标记(Lys)证实IL-6促进的类器官增大伴随潘氏细胞增加。动物组织分析显示,TGM2⁺ QFLSs治疗可显著增加潘氏细胞数量,进一步表明其通过IL-6—潘氏细胞轴促进隐窝修复。
免疫恢复是IBD改善的重要环节。研究显示,C5/QFLSs高表达与Treg分化、增殖相关的基因,尤其是
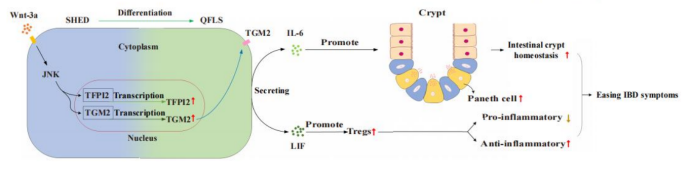
图示:SHEDs调控肠道免疫微环境的机制
更具临床意义的是,研究团队在43对UC/CD患者标本中证实:体内固有QFLSs数量与
该研究系统阐述了SHEDs在炎症性肠病治疗的潜在可能性,通过阐明IL-6/LIF双重调控机制,实现了再生医学与免疫学范式的融合,为IBD传统疗法提供了靶向性强、安全性高且疗效持久的替代方案。研究团队表示,尽管临床前结果令人振奋,并且SHEDs来源细胞免疫原性低、制备周期短、成本低廉,但要将该疗法真正应用于患者仍需经过严格的临床试验验证。
该研究由解放军总医院牵头,联合上海交通大学瑞金医院、中国科学院生物物理研究所和南京大学鼓楼医院等多家单位共同完成。解放军总医院普通外科医学部杜峻峰主任医师,上海交通大学瑞金医院刘海洋副研究员,中国科学院生物物理研究所阎锡蕴院士,中国科学院生物物理研究所段红霞教授,南京大学医学院附属鼓楼医院沈晓菲副主任医师为共同通讯作者;刘海洋副研究员,张佳玉、钟文涛、李森、景林博士,崔晓晖教授为共同第一作者。
致谢
解放军总医院杜峻峰主任医师
上海交通大学瑞金医院刘海洋副研究员
中国科学院生物物理研究所阎锡蕴院士
中国科学院生物物理研究所段红霞教授
南京大学鼓楼医院沈晓菲副主任医师
团队供稿
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)