近日,美国心脏协会(AHA)在Circulation发表了一项重要科学声明指出,要实现经皮冠脉介入治疗(PCI)的最佳临床实践,精准评估有创冠脉生理学指标至关重要。
声明重点围绕血流储备分数(FFR)与非充血压比(NHPR)的诊断一致性、阈值应用、给药途径、特殊病变评估策略等核心问题,通过系统梳理现有研究证据,提出了明确的临床建议。
来源:中国循环杂志
声明明确,FFR作为有创生理评估的金标准,在约80%的病例中与NHPR存在一致性(FFR阈值0.80,NHPR阈值0.89)。NHPR 虽便捷但准确性有限,尤其在灰区应谨慎。
两者的不一致性受病变类型影响显著,局灶性狭窄、高冠脉血流储备(CFR)或左前降支近段供应大面积心肌时,易出现FFR异常而NHPR正常;弥漫性疾病、低CFR则可能导致FFR正常而NHPR异常。
DEFINE-FLAIR和iFR-SWEDEHEART研究显示NHPR指导组的5年全因死亡率显著高于FFR组(8.3% vs. 6.3%),差异主要来自接受血运重建的NHPR患者,提示可能存在过度治疗或错误决策。
声明强调,当NHPR结果处于临界范围(0.86~0.93)或与临床场景不符时,应先进行对比剂诱导的血流储备分数(cFFR)评估,必要时使用
当FFR与NHPR结果不一致时,应依据FFR结果进行临床决策。
临床常规以分类阈值(FFR≤0.80、NHPR≤0.89)为决策依据,但声明指出这种方式存在局限性。
研究表明,FFR与临床结局呈连续相关关系,较低的FFR越低,血运重建的获益越大;而在灰色区域(如FFR0.75~0.80),检测的重复性受临床因素和测量变异性影响较大,VERIFY研究发现FFR重复测量的变异范围可达±0.02。
声明强调,临床决策应结合连续测量值与患者具体情况,而非单纯依赖分类阈值。
腺苷诱导最大血管舒张是生理评估的关键步骤。声明推荐静脉内腺苷给药[140μg/(kg·min)]作为金标准,该方式能提供稳定的充血状态,适用于所有病变类型。
冠脉内腺苷给药虽能避免全身反应、缩短手术时间,但可能无法达到最大充血效果,常规剂量为左冠脉200μg、右冠脉100μg,必要时可增加剂量或转换为静脉给药。
此外,cFFR诊断准确性(85%~90%)优于NHPR,且无需额外使用腺苷,对NHPR临界病例可作为补充评估手段,推荐使用6~10ml对比剂注射后即刻测量,阈值设定在0.83~0.85之间。
声明强调操作细节影响结果准确性,并制定了有创冠脉生理学评估的操作规范。

1.
对于急性心梗患者的非罪犯血管,完全可以在急性期(处理罪犯血管的同一次手术中)做生理性评估,其FFR/NHPR结果与心梗恢复后测量的一致性很高,不会因为急性期的特殊状态出现明显误差。
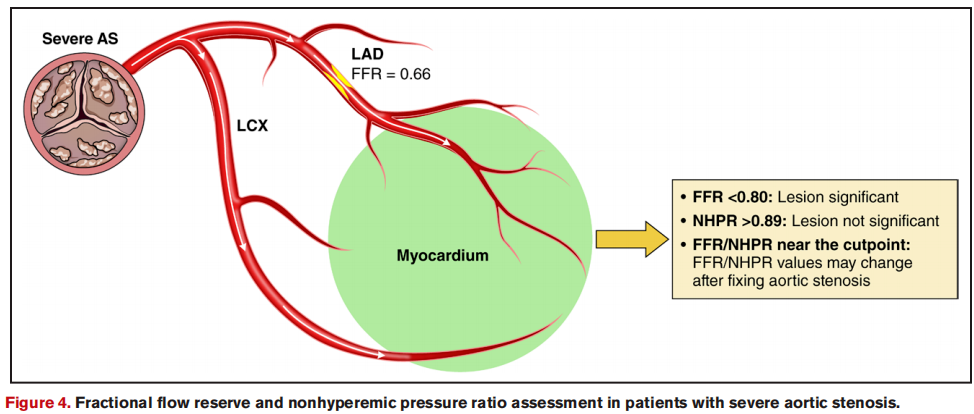
2.重度
在临床实践中,医生会对重度主动脉瓣狭窄患者的冠脉病变进行有创生理评估。然而,目前缺乏充足证据证明该评估方法在重度主动脉瓣狭窄场景下的准确性。
总体而言,FFR可能低估病变严重程度,NHPR可能高估。在重度主动脉瓣狭窄患者中,若FFR较低(≤0.80),通常提示病变具有临床意义;若NHPR数值较高(>0.89),则通常提示病变无显著临床意义。若FFR或NHPR处于灰色区间,应在TAVR后复查。
近期有研究表明,将FFR≤0.83或NHPR≤0.85作为判断阈值,在预测心肌缺血方面具有更高的准确性。
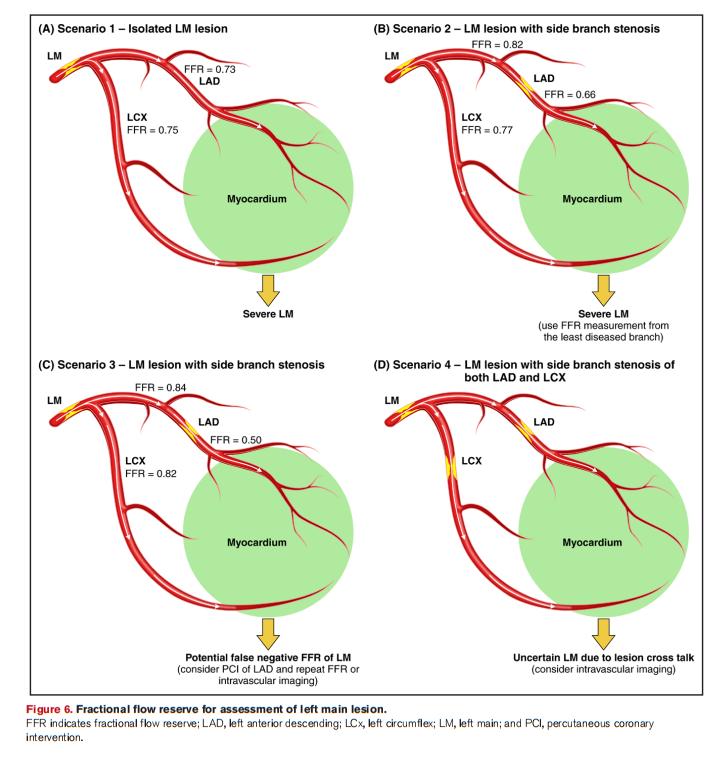
3.左主干病变
仅依靠冠脉造影识别有临床意义的左主干病变准确性差,通过测量FFR或NHPR,可获取病变的功能性信息,进而帮助优化临床决策。若检测结果为阴性(尤其对于FFR而言),则表明可安全暂缓对该病变进行血运重建治疗。
FFR/NHPR测量需结合左前降支和回旋支分支检测,必要时进一步血管内成像如IVUS或OCT。
由于左主干通常为大量心肌供血,这种解剖特点可能会导致FFR与NHPR的不一致性,因此若NHPR检测为阴性,需结合患者的临床表现,考虑进一步检查,包括FFR检测和血管内影像学检查。
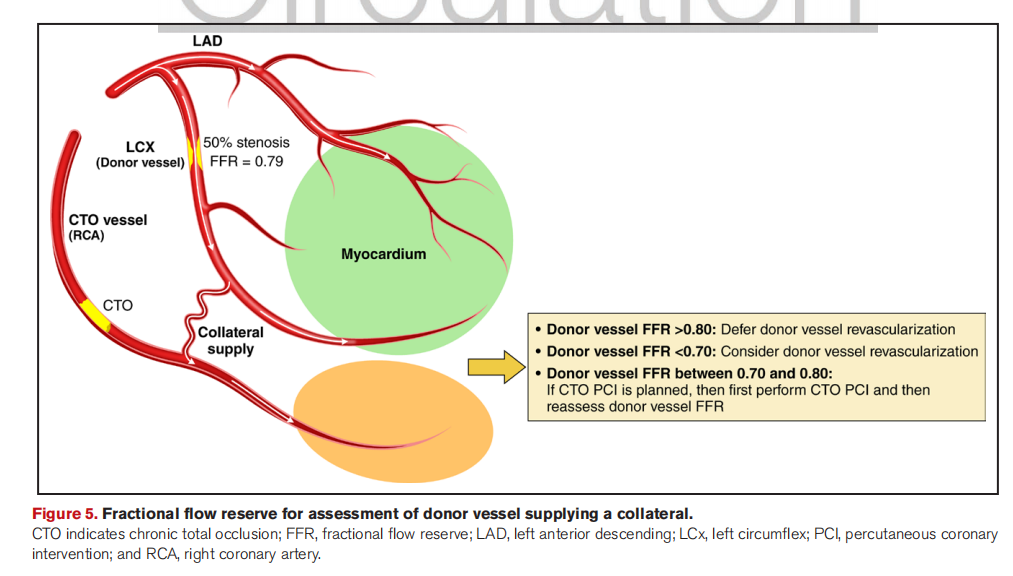
4.慢性完全闭塞血管的供血区域的供血血管
FFR或非NHPR可用于判断慢性完全闭塞(CTO)血管的供血区域的供血血管的狭窄程度,但在解读检测结果时必须谨慎 ,因为CTO病变开通后供血血管FFR/NHPR会显著升高。
如供体血管FFR>0.80或NHPR>0.90可暂缓供体血管血运重建,优先开通CTO血管,如供体血管FFR<0.70或NHPR<0.80,建议先处理供体血管,再开通CTO血管,若供体血管FFR0.70~0.80或NHPR0.80~0.90,则不急于处理供体血管,先开通CTO血管,术后再复查供体血管的FFR/NHPR。
5.心肌桥
推荐使用舒张期 FFR(阈值≤0.76)或在
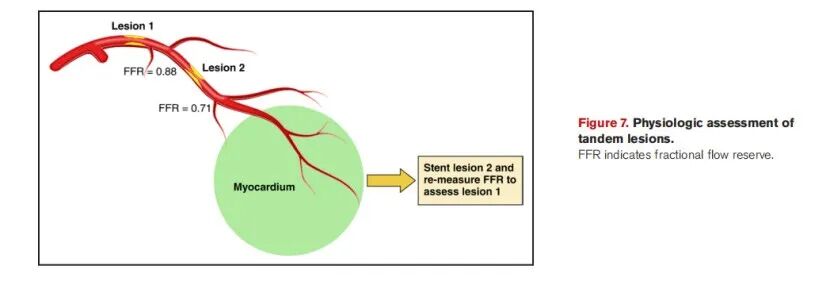
6.串联病变
串联病变的两处狭窄相互影响,单独测量可能低估近端病变。采用有创生理学技术评估冠脉串联病变的血流动力学意义,目前仍是一项挑战。通过缓慢回撤压力导丝以获取精准测量结果,必要时在对其中一处病变植入支架后再次进行测量。
7.开口病变(Ostial Lesions)
主动脉开口病变的有创生理学测量存在一定难度。在进行压力测量时,可采取以下措施改善准确性:使用无侧孔的导引导管,采用精细的导引导管操作技术。测量时导管必须脱离开口。优先使用静脉腺苷。
8.大隐静脉桥血管
支持在大隐静脉桥血管中使用FFR或NHPR的证据十分有限。现有证据表明,利用这两项指标指导该类患者的血运重建决策缺乏临床获益。
若FFR或NHPR检测结果为阳性,提示存在心肌缺血,在条件允许的情况下应进行血运重建治疗;阴性结果不能排除未来风险。
临床上,部分术者会通过测量FFR或NHPR,尝试区分梗死心肌与存活心肌。共识指出,FFR或NHPR无法可靠区分存活心肌与梗死心肌,因此不建议将这两项指标用于此类判断。
目前,临床中并未将 PCI 术后测量 FFR或 NHPR作为常规操作,该测量方式的实用性与价值目前尚不明确。
若PCI术后FFR<0.90或NHPR<0.95,应进一步检查(包括血管内影像学检查)病变血管段。通过压力回撤检查能够识别支架相关问题、被遗漏的病变以及弥漫性疾病。
针对中度冠脉病变,声明制定了有创冠脉生理评估的标准化操作流程,覆盖从器械选择、操作步骤到质量验证的全流程,确保FFR、NHPR或cFFR测量的准确性。
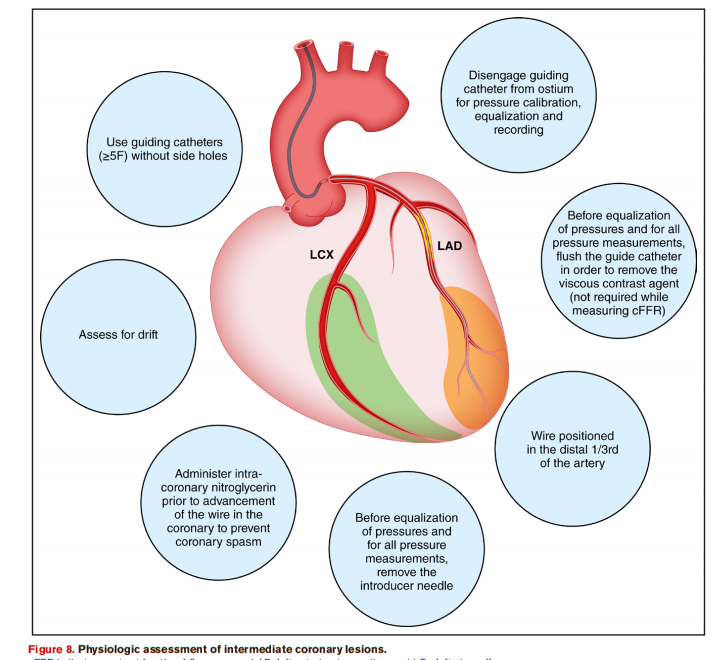
该声明填补了有创冠脉生理评估领域的循证实践空白,为临床医生提供了可操作的技术规范和决策框架。遵循这些建议,有望减少不必要的血运重建,降低患者死亡率和并发症风险。
声明强调,尽管现有证据已形成明确指导建议,仍需进一步开展随机试验,尤其是针对重度主动脉瓣狭窄、大隐静脉桥血管病变等特殊人群的长期预后研究,以不断完善评估体系。
来源:American Heart Association Interventional Care Committee of the Council on Clinical Cardiology; and Council on Cardiovascular and Stroke Nursing. Evidence-Based Practices in the Cardiac Catheterization Laboratory: Invasive Epicardial Coronary Physiologic Assessment: A Scientific Statement From the American Heart Association. Circulation. 2025 Nov 20.

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)