
“二次打击”指叠加除酒精外的另一个肝损伤因素,如特殊饮食、化学物质、基因工程等。相比传统方案,“二次打击”模型可在不显著增加动物死亡率的前提下诱导出不同严重程度的ALD,具有良好的应用前景与开发潜力。目前,仅有少数文献较详尽地分析总结啮齿动物ALD“二次打击”模型。为此,本文总结各类“二次打击”模型的病理生理机制、建模方法和应用效果,并列举代表性的建模示例,旨为ALD“二次打击”动物模型的临床应用提供理论基础。

1饮食类
HFD是目前应用较广泛的“二次打击”方案之一,可有效诱导肝脂肪变性。Gäbelee等的研究表明,酒精和HFD可直接激活促纤维化基因,加强Ⅰ型胶原、转化生长因子β等胶原相关蛋白的合成;或以活性氧(ROS)为媒介,激活肝星状细胞,诱导细胞外基质沉积。此外,HFD联合酒精暴露还可诱导内质网应激与肝脏炎症,其中内质网应激可广泛引发脂肪堆积、
HFD联合酒精的“二次打击”模型包括一系列建模方法,通常选择雄性Sprague-Dawley大鼠或C57BL/6J小鼠用于造模,其中C57BL/6J小鼠具有高度的酒精依赖性与HFD敏感性。酒精饲喂以灌胃或自由饮用为主,脂肪通常来源于玉米油、猪油和胆固醇。需注意,饱和脂肪与不饱和脂肪可能诱导不同的病理生理特征。饱和脂肪可通过抑制肝脂肪积累、增强肝细胞膜抗氧化应激能力及维持肠道菌群正常生态,降低大鼠的酒精性肝毒性。与之相反,不饱和脂肪饮食可能会增加肠道通透性,加剧酒精诱导的内毒素血症、肝脂肪变性和肝损伤。
此类模型尚缺乏明确统一的建模方法,以下介绍文献中提及的2种较为有效的建模方式。Sengupta等设计一种“WASH(西方-酒精性脂肪肝)”饮食,动物饲粮由麦芽糖、胆固醇、
HFD联合酒精“二次打击”模型可诱导显著的肝损伤,表现为ALT、AST等血清标志物升高,以及以炎症、脂肪变性和细胞周围纤维化为代表的肝组织病理学改变。然而,在不同研究中,脂肪肝与肝纤维化的形成时间存在显著差异,前者为5~16周,后者为7~16周。
HFD联合酒精模型的优势在于可建立更符合人类复杂饮酒模式的动物模型。通过将HFD与Ad libitum、单次豪饮、慢性加单次暴饮(NIAAA)等不同饮酒方式结合,研究者可模拟各类饮酒情景。“二次打击”模型发展至今,其应用已不限于加重ALD动物的肝损伤程度。大量饮酒可导致肥胖个体发生急性肝损伤,同时存在酗酒和肥胖可显著增加肝脏相关疾病的发病风险,甚至死亡风险。因此,需通过该类模型将饮酒与人类社会生活中的其他肝损伤因素相结合,以满足临床及科研的进一步需求。
铁过载一直被视为强有力的肝损伤因素。遗传性病变(如遗传性
高铁合并酒精暴露“二次打击”模型应用范围有限,尤其近年来缺乏新的发展与改良。该模型通常将羰基铁以0.04~0.87 mg/mL的浓度混入Lieber-Decarli液体饮食,持续饲喂8~26周。以下列举2种成功诱导肝纤维化的模型。Olynyk等设计“三阶段”方案,首先在母鼠
然而,高铁合并酒精暴露“二次打击”模型在ALD研究中并不常用。该模型的建模方法较为复杂,高铁摄入与人类常见的饮酒模式存在差异,只有特定遗传病患者或长期大量输血人群才会产生严重的铁过载,因此其造模思路与致病途径并不符合常规人类ALD的病理生理机制。

2化学物质类
CCl4作为一种有效的肝毒性物质,已被广泛用于诱导肝脂肪变、肝纤维化、肝硬化甚至肝癌。以CYP2E1为核心的细胞色素P450同工酶可将CCl4转化为CCl3·,或在氧气存在下进一步转化为CCl3OO·,干扰细胞正常生命活动。其损伤机制主要包括脂质过氧化(CCl3OO·比CCl3·更易启动该过程)与卤烷基化,其中脂质过氧化通过损害膜功能和产生有害代谢中间产物来损伤细胞;卤烷基化则以共价结合方式改变细胞组分的结构及正常功能,尤其通过诱导细胞低甲基化状态来抑制极低密度脂蛋白的合成分泌,引起肝脂肪变。酒精与CCl4的协同作用主要体现在乙醇可以诱导CYP2E1高活性,从而促进CCl4的自由基转化。
将CCl4作为“二次打击”因素与酒精结合,可构建更符合人类中重度酒精性肝损伤病理特征的啮齿动物模型。CCl4既可作为饮酒前的预处理持续暴露6~8周,也可直接与酒精混合暴露1~10周,前者常用于研究模型动物肝脏的组织学与细胞分子学,后者则多用于比较不同打击因素的效果差异。CCl4的给药方式包括腹腔注射、口服、灌胃和吸入等。腹腔注射时,药物会以一定比例溶解于橄榄油或玉米油,频率为每周1~2次,剂量为每次0.1~3 mL/kg体质量。吸入暴露前,动物应连续饮用
不同的给药方式各具特点。小鼠主要采用腹腔注射,但该方法易引发局部皮肤刺激、腹腔粘连以及膀胱、膈肌或肠道损伤;而大鼠多通过吸入给药,此方式可造成更高浓度的CCl4潴留,且在近期文献中表现出更优的可重复性,但吸入更易引发肝硬化和
CCl4联合酒精“二次打击”模型造成的主要病理生理变化为肝纤维化。研究发现,CCl4可在2周内诱导出肝纤维化相关表现,尤其是在门静脉周围和间隔区,同时还可引起轻度细胞坏死、脂肪积累、炎症反应,并最终损害肝功能。多项研究证实,慢性酒精摄入与CCl4的结合可显著增强共同的肝毒性。Bosma等发现,CCl4预处理可增强酒精摄入后的胶原沉积。
CCl4联合酒精“二次打击”模型兼具优势与劣势。其优势在于可诱导与人类重症酒精性肝炎类似的转录变化,尤其在免疫系统、细胞周期和有丝分裂、信号传导级联的上调方面,且是少数能诱导出显著肝纤维化的方法,同时具有建模效率高的特点,因此在“二次打击”模型中占据重要地位。但其劣势在于不适合模拟人类复杂饮酒情景,且存在动物死亡率高的问题。
LPS联合酒精“二次打击”模型具有独特性。与CCl4等化学药剂或高铁等特殊饮食不同,LPS在人类ALD的自然病程中占有重要的地位。长期饮酒可改变肠道微生物组的组成和功能,提高肠壁的通透性,促使细菌产物更易从肠道入血,形成内毒素血症。血液中的LPS可通过脂多糖结合蛋白与Kupffer细胞表面的白细胞分化抗原14结合,进而并被转移至Toll样受体-4-髓样分化蛋白2复合物,激活髓分化因子88依赖性的级联反应,最终导致丝裂原活化蛋白激酶(如ERK1、ERK2、JNK、p38)与核因子-κB(NF-κB)等分子的激活。随后,Kupffer细胞释放ROS、黏附分子(如ICAM-1、VCAM-1)、趋化因子(如IL-8、CCL2)和促炎细胞因子(如TNF-α、IL-1、IL-6),诱导肝脏炎症反应。
目前,研究人员已探索出一套常见的建模方法。模型动物通常选用雄性Wistar大鼠、雄性Sprague-Dawley大鼠和雌性C57BL/6小鼠,雌性比雄性更易受到酒精诱导的肝损伤影响。Lieber-Decarli液体饮食或NIAAA模型常用于搭配LPS暴露,其中NIAAA模型更常见,可能是因为其具有更强的致炎能力。建模流程如下:先建立NIAAA模型,即饲喂含5 mg/mL乙醇的饮食4周,随后经口摄入3.2 g/kg体质量的乙醇1次[32 mg/mL乙醇溶于盐水
LPS联合酒精“二次打击”模型引起的肝损伤偏向于肝脏炎症反应。组织病理学上的变化主要包括局灶性凝固性坏死、多形性中性粒细胞浸润和脂肪变性,也可见肝小叶结构紊乱、细胞增殖活跃以及局灶性胶原沉积。
该模型在损伤机制上更贴合人类ALD的致病机制。LPS透过受损肠壁进入血液,刺激促炎细胞因子、趋化因子等释放,促进肝脏炎症反应,因此适用于酒精性肝炎的研究。由于仅需单次注射LPS,该模型操作简便,周期短,不易造成实验动物死亡,但也难以诱导出显著的肝纤维化和肝硬化,仅适合于酒精性肝炎早期阶段的研究。

3基因工程类
通过敲除或转入ALD致病通路上的关键基因,可直接、明确地诱导目标疾病。Xu等发现敲低调节肝脏甘油酸酯代谢的羧酸酯酶1基因,可加重酒精性脂肪肝炎;脂肪特异性蛋白27过表达也可诱导肝损伤,且在机制上与酒精存在协同作用。
人源化CYP2E1敲入的小鼠模型值得关注。人源化指在实验动物体内植入功能性人体细胞或组织,使得所建立的模型更贴合人类的病理生理特点。CYP2E1作为肝脏氧化应激中的关键蛋白,其敲入可使实验动物在饮酒后出现应激相关基因的表达及明显的肝损伤,但研究人员需注意动物自身免疫系统及人源细胞在异种生物体内的分化成熟障碍问题。

4小结与展望
本文总结用于构建ALD啮齿动物模型的“二次打击”方案(表1),主要分为饮食类、化学物质类和基因工程类。开发“二次打击”模型的根本原因在于,啮齿动物与人类在酒精偏好、代谢能力、肝脏炎症模式及肠源性LPS的耐受性等方面均存在差异,需依靠额外因素诱导肝损伤。表1中的5种建模方案已较全面地覆盖脂肪肝、肝炎、肝纤维化、肝硬化等ALD疾病谱。
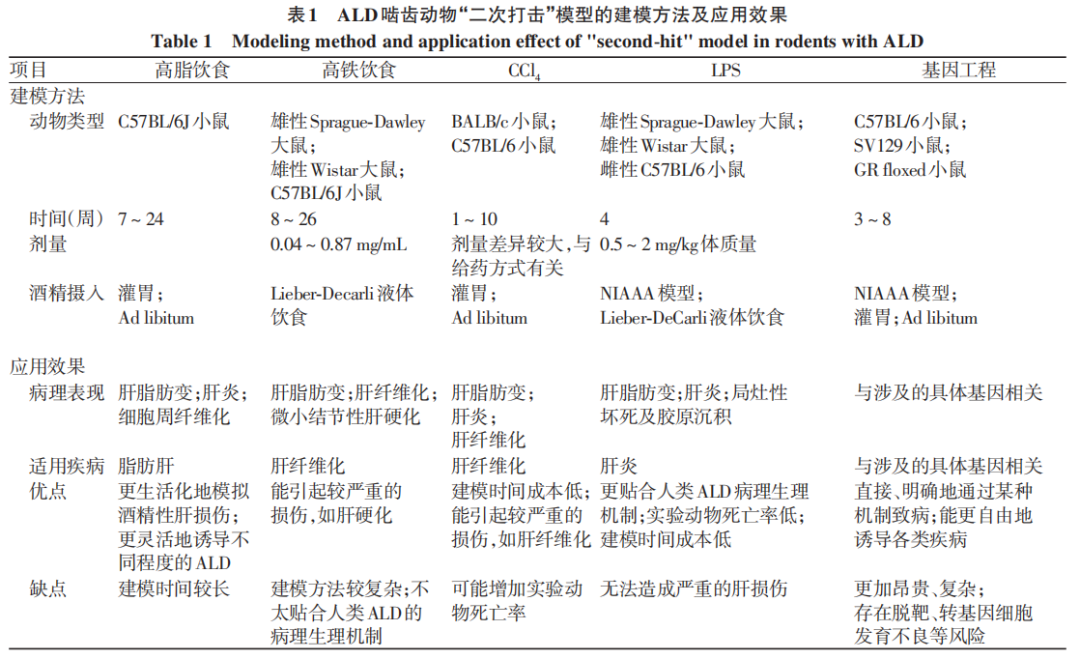
然而,该领域长期存在一个难题,即难以明确区分“二次打击”因素单独作用与联合酒精作用造成的肝损伤,由此引发模型能否反映ALD真实病理特点的质疑。笔者认为,“二次打击”不仅可用于单纯ALD的建模,还适用于构建符合人类复杂饮酒模式的ALD的动物模型。例如,以往研究通常会严格区分ALD与代谢相关脂肪性肝病,而我国及欧洲肝病学会最新指南中均已更新代谢相关脂肪性肝病合并ALD的内容。这表明,将饮酒与“二次打击”因素相结合,即便无法完全模拟ALD真实病理特点,仍符合科研与临床需求,具有良好的发展潜力。

https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH250932

刘萌思, 谢艳迪. “二次打击”在酒精性肝病动物模型中的应用[J]. 临床肝胆病杂志, 2025, 41(9): 1925-1930
来源:临床肝胆病杂志
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)