靶向特异性激酶底物可缓解由
Targeting specific kinase substrates rescues increased colitis severity induced by the Crohn's disease-linked LRRK2-N2081D variant
The Journal of Clinical Investigation
PMID:41031878 [IF=13.6]
来源:IBD Daily
LRRK2 (富含亮氨酸重复激酶2) 基因突变是
研究者采用CRISPR/Cas9技术在C57BL/6小鼠中构建携带N2081D突变的敲入模型,并通过葡聚糖硫酸钠 (DSS) 诱导性结肠炎模型评估其肠道炎症反应。研究结合组织学分析、免疫印迹、ELISA及蛋白组学检测,对结肠及脑组织中的RAB蛋白磷酸化水平和免疫反应进行了定量分析。在机制验证方面,研究者在HEK293细胞及骨髓来源树突状细胞 (BMDCs) 中表达不同LRRK2突变体,检测其自磷酸化与底物磷酸化活性,并利用共聚焦显微镜观察LRRK2在炎症刺激 (zymosan) 下的定位与信号变化。此外,通过敲除Rab12基因或应用LRRK2激酶抑制剂MLi-2,比较不同干预策略对结肠炎表型的影响,从而探讨潜在的治疗靶点。
➤CD和PD相关LRRK2变异的关联分析揭示其遗传多效性
在BioMe、UK Biobank和美国退伍军人百万计划 (MVP) 三大生物样本库中,研究者分析了LRRK2基因G2019S和N2081D变异与CD及PD的关联。纳入逾 100万名个体的多种族荟萃分析显示,N2081D变异同时增加CD和PD的发病风险,而G2019S主要与PD风险升高相关,并在部分欧洲人群中也与CD有关。由于不同族群的等位基因频率差异,UK Biobank未观察到相同结果。总体而言,这些发现进一步证实了LRRK2在CD与PD中的遗传多效性。
➤LRRK2N2081D小鼠对化学诱导性结肠炎的敏感性增强
研究者利用CRISPR/Cas9技术建立携带LRRK2-N2081D变异的小鼠模型,并使用2% DSS诱导结肠炎。结果显示,无论雄性或雌性,Lrrk2N2081D小鼠均出现更明显的体重下降、结肠缩短和炎症加重,雄性表现尤为显著,其粪便中促炎标志物lipocalin-2升高,脾脏重量增加,提示免疫反应增强。组织学分析进一步证实Lrrk2N2081D小鼠的炎症和组织损伤程度均高于野生型和Lrrk2G2019S小鼠,说明N2081D变异可显著加重DSS诱导的结肠炎。综上所述,Lrrk2N2081D突变显著加剧了诱导性结肠炎的严重程度,并验证了该模型作为研究LRRK2相关克罗恩病致病致病机制的有效工具。
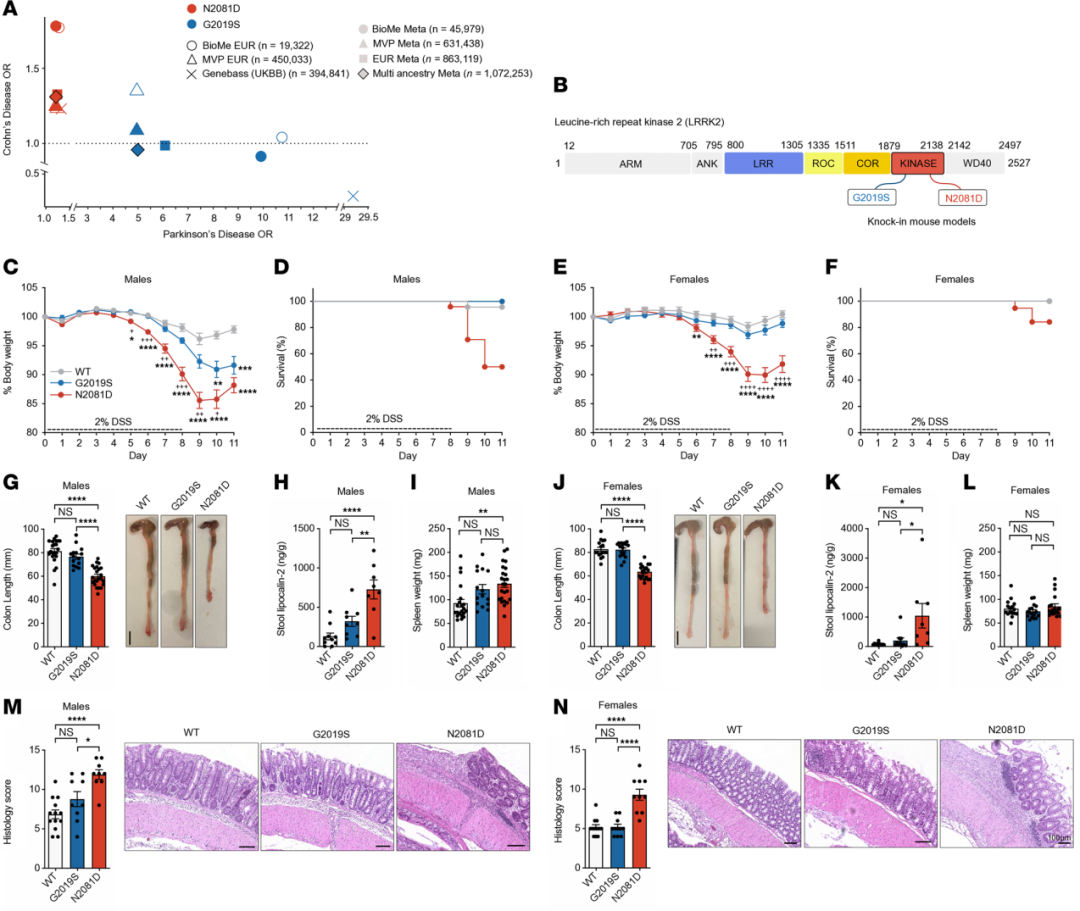
图1 验证LRRK2-N2081D基因敲入(KI)小鼠作为克罗恩病模型的可靠性
➤CD与PD相关LRRK2突变的功能效应存在显著差异
为比较N2081D与G2019S突变对LRRK2激酶活性的影响,研究者检测了两种敲入小鼠脑和结肠组织中LRRK2及其底物RAB蛋白的磷酸化水平。结果显示,G2019S突变显著增强了LRRK2-S1292的自磷酸化及RAB12的磷酸化,而N2081D突变则主要升高了RAB10的磷酸化水平,且在结肠组织中更为明显。并且研究者进一步分析表明,更加严重的炎症表型可能会放大N2081D的突变效应。深入探究其分子机制发现,N2081D与G2019S均可促进RAB10磷酸化,但具体机制不同:结构分析提示N2081D通过破坏LRR与激酶结构域间的相互作用而激活LRRK2。恢复该结构域间相互作用可降低RAB10磷酸化水平。
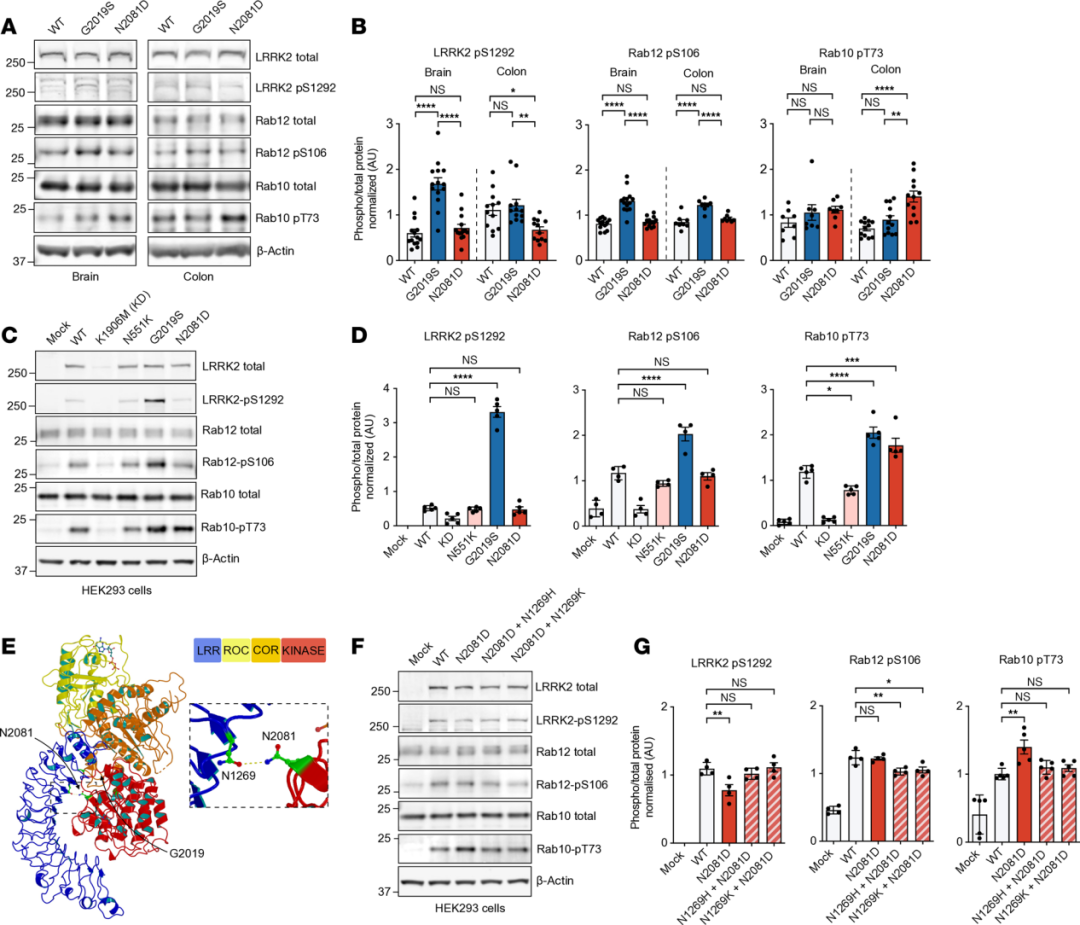
图2 PD与CD相关LRRK2变体的激酶活性特征分析
➤DC刺激诱导的LRRK2磷酸化及炎症反应具有突变依赖性差异
为探讨LRRK2突变在免疫细胞中的功能,研究者分离野生型、Lrrk2G2019S和 Lrrk2N2081D小鼠的BMDCs。在未刺激状态下,G2019S突变细胞中LRRK2-S1292自磷酸化及RAB12、RAB10的磷酸化水平均升高,而N2081D突变主要增强RAB10的磷酸化。这些结果表明,在HEK293细胞中揭示的LRRK2分子调控机制同样适用于敲入小鼠的BMDCs。为了验证炎症刺激是否能够激活LRRK2激酶活性,研究者使用促炎因子zymosan刺激三种不同基因型 (WT、G2019S、N2081D) 树突状细胞。结果显示,在zymosan作用下,三种基因型的细胞均出现NF-κB通路激活及RAB蛋白磷酸化增加,但后者效应存在差异:G2019S细胞中RAB12磷酸化显著升高,而N2081D细胞中RAB10磷酸化增强最为明显。上述结果表明,炎症刺激可激活LRRK2激酶活性,并导致底物磷酸化出现突变依赖性差异。研究者通过磷酸化蛋白质组学分析进一步发现,N2081D细胞中炎症相关蛋白 (如CCL22、CCR7、STAT4、TNFSF18) 水平较高,提示该突变可放大树突状细胞的促炎反应。共聚焦成像显示,zymosan被吞噬后,LRRK2定位于吞噬体膜表面,且N2081D细胞中磷酸化RAB10聚集更明显。总体而言,这些结果表明,炎症刺激可激活LRRK2激酶活性,而不同突变导致的底物选择性差异会引发不同的炎症信号响应。
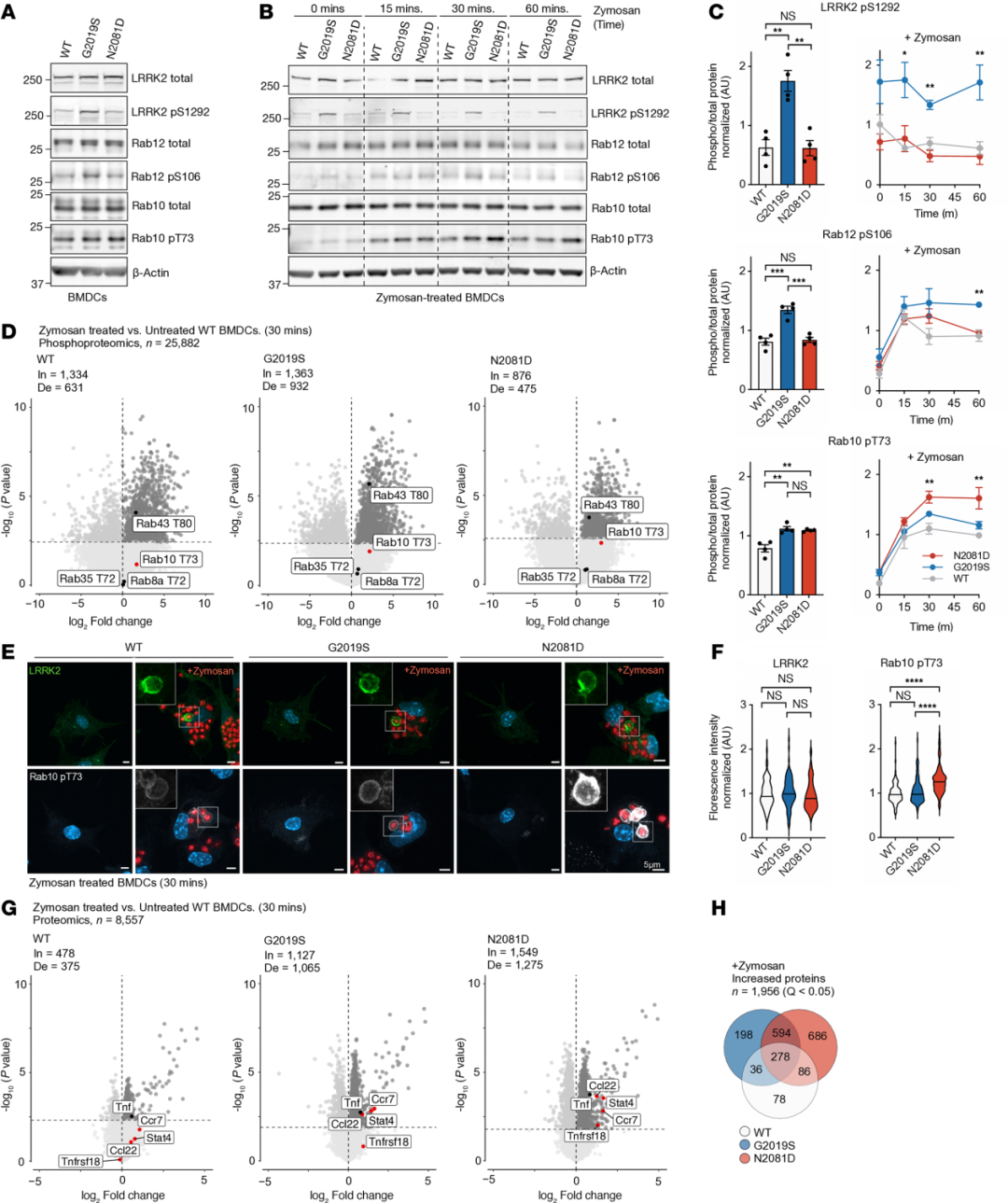
图3 树突状细胞的激活会引发LRRK2突变依赖性的RAB磷酸化差异及炎症信号传导变化
➤LRRK2激酶抑制剂未改善结肠炎,而Rab12敲除可减轻炎症表型
为探索潜在的治疗策略,研究者首先在Lrrk2N2081D小鼠中评估LRRK2激酶抑制剂MLi-2的作用。连续口服MLi-2能有效降低结肠组织中RAB10与RAB12的磷酸化水平,但对DSS诱导的体重下降、结肠缩短、组织损伤及脾重变化均无明显改善,提示单纯的激酶抑制并不能缓解N2081D相关结肠炎。
随后,研究者利用基因杂交获得Lrrk2N2081D;Rab12–/–双突变小鼠,以评估RAB12对LRRK2功能的调节作用。结果显示,Rab12敲除可显著降低结肠组织中RAB10的磷酸化水平,且BMDCs中也出现RAB10磷酸化水平降低,同时此措施可并明显减轻DSS诱导的体重下降、结肠炎症与组织损伤。综合结果表明,Rab12敲除能有效缓解N2081D突变相关结肠炎的严重程度,而LRRK2激酶抑制剂未能产生相同效果,提示靶向特定底物可能比直接抑制激酶活性更具治疗潜力。此外,野生型小鼠组中RAB12敲除未表现出明显的缓解效果,这表明此种干预策略可能对LRRK2突变携带者具有更好的治疗效果。
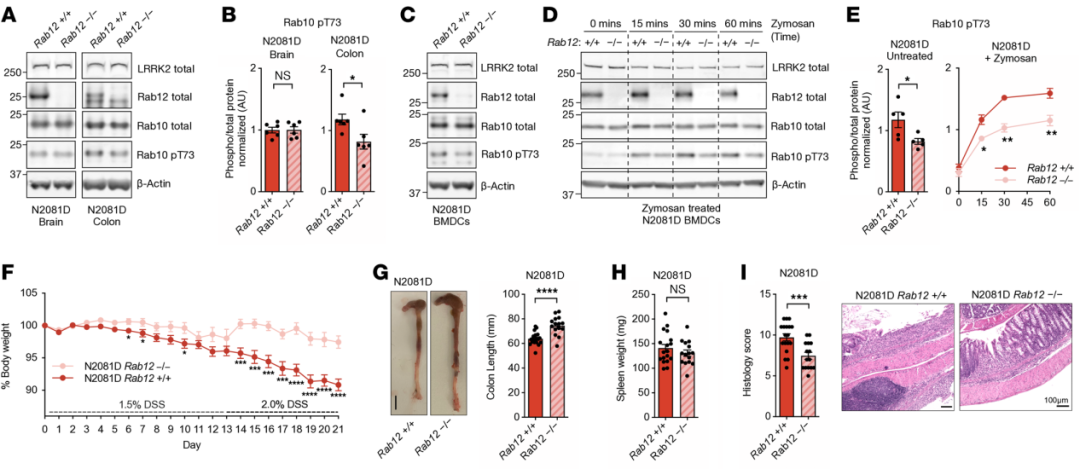
图4 RAB12基因敲除可挽救LRRK2-N2081D突变表型
本研究揭示,LRRK2-N2081D突变通过特异性增强RAB10的磷酸化活性,从而加剧了DSS诱导的结肠炎炎症反应。与G2019S突变不同,N2081D通过破坏LRR区与激酶结构域之间的相互作用激活LRRK2,表现出独特的分子机制。进一步研究发现,RAB12在调控N2081D相关炎症表型中发挥关键作用,其基因敲除可显著减轻结肠炎严重程度,提示其为潜在的治疗靶点。而LRRK2激酶抑制剂虽能降低底物磷酸化,但未明显改善炎症结局。
总体而言,本研究阐明了LRRK2在克罗恩病发病中的新型分子机制,并为针对LRRK2相关疾病的精准治疗提供了重要思路。
致谢
中南大学湘雅三医院 李文
中南大学湘雅三医院 项鑫 王思丹
中南大学湘雅三医院 陈杰
中南大学湘雅三医院 王晓艳
对本篇文章解读做出的贡献
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)