强直性脊柱炎(Ankylosing Spondylitis,AS)是一种以中轴关节慢性炎症为核心特征的自身炎症性疾病,属于脊柱关节炎(Spondyloarthritis,SpA)的原型疾病。其病理进程不仅累及骶髂关节、脊柱骨突,还可波及外周关节及多个器官系统,晚期易导致脊柱强直、畸形,严重损害患者运动功能与生活质量。
强直性脊柱炎的流行病学特征
AS 的流行病学分布具有显著的遗传关联性与地域异质性,其发病率、患病率及疾病负担受种族、年龄、性别及环境因素共同影响。近年来,全球多中心流调数据的积累,进一步揭示了 AS 的人群分布规律与危险因素,为疾病预防和早期干预提供了依据。
(一)全球与区域患病率差异
AS 的全球总体患病率约为 0.1%~1.4%,但不同地区因种族遗传背景差异,患病率呈现明显分层,核心影响因素是HLA-B27 基因的人群携带率。
10.1007/s10067-021-05679-7.
- 欧洲地区作为 AS 高发区域,北欧国家(挪威、瑞典)患病率最高,达 0.5%~1.0%,HLA-B27 携带率约 8%~14%;西欧国家(英国、德国)患病率约 0.3%~0.8%,南欧国家(意大利、西班牙)因种族混杂,患病率略低(0.2%~0.5%)。
- 亚洲地区患病率低于欧洲,中国基于 2023 年全国流调数据显示,AS 患病率约 0.2%~0.5%,HLA-B27 携带率约 2%~7%;日本、韩国患病率约 0.1%~0.3%,印度北部因与中亚人群基因交流频繁,患病率可达 0.4%~0.6%,接近欧洲水平。
- 非洲地区总体为低发区域,撒哈拉以南非洲黑人患病率普遍低于 0.1%,HLA-B27 携带率不足 1%;仅北非阿拉伯人群(如埃及、阿尔及利亚)因含欧洲高加索人基因成分,患病率略高(0.2%~0.3%)。
- 美洲地区呈现 “种族分层” 特征,美国白人患病率 0.5%~0.9%(与欧洲接近),非洲裔美国人 0.1%~0.2%,印第安人群 0.3%~0.4%;拉丁美洲国家因混血人群占比高,患病率多在 0.2%~0.4% 之间。
(二)年龄与性别分布规律
AS 的发病具有明确的年龄与性别倾向性,是青壮年人群致残的主要风湿病之一。
- 发病年龄AS 的高发年龄段为 15~40 岁,其中 20~30 岁为发病高峰,占所有患者的 70%~80%;儿童期(<16 岁)发病的 AS 称为幼年型强直性脊柱炎(Juvenile Ankylosing Spondylitis,JAS),占比约 5%~10%,多以外周关节(膝关节、踝关节)受累为首发症状,易被误诊为幼年特发性关节炎;40 岁后发病的 AS(晚发型 AS)占比不足 10%,症状多较轻微,中轴关节受累进展缓慢,但髋关节受累风险更高(约 30%,青壮年患者约 15%)。
- 性别差异全球范围内 AS 患者男女性别比约为 2~3:1,男性患者病情更重 —— 男性出现脊柱强直的比例是女性的 2 倍,髋关节置换率是女性的 1.5~2 倍,疾病活动度(如 BASDAI 评分)显著高于女性;女性患者多表现为 “外周型 AS”,以外周关节、附着点炎及关节外症状(如贫血、疲劳)为主,中轴关节症状较轻,且诊断延迟时间更长(平均 4~6 年,男性约 1~2 年),主要因临床医生对女性 AS 的认知不足,易将下腰背痛归因于妇科疾病或腰肌劳损。
(三)遗传与环境危险因素
AS 是典型的 “遗传 - 环境交互作用” 疾病,遗传因素决定发病易感性,环境因素触发疾病发作,两者共同推动炎症进展。
1. 遗传因素:以 HLA-B27 为核心的多基因遗传
遗传因素在 AS 发病中的贡献度约 70%~90%,其中 HLA-B27 是最关键的易感基因。
- HLA-B27 的作用约 90% 的 AS 患者 HLA-B27 阳性,其阳性人群的 AS 发病风险是阴性人群的 20~50 倍;但 HLA-B27 阳性人群中仅 5%~10% 发展为 AS,提示 “单一基因不足以致病”。目前已发现 HLA-B27 的 20 余种亚型,其中 B2704、B2705 与 AS 关联性最强(主要分布于欧洲、亚洲),B2702、B2709 关联性较弱,B2706、B2709 甚至可能具有保护作用(多见于东南亚人群)。
- 非 HLA 基因随着全基因组关联研究(GWAS)的开展,已发现超过 100 个与 AS 相关的非 HLA 基因,核心包括:
- 免疫细胞活化相关基因:IL-23R(调控 Th17 细胞分化)、IL-17A(促炎细胞因子编码基因)、STAT3(细胞因子信号传导分子);
- 抗原提呈相关基因:ERAP1(内质网氨肽酶,调控 HLA-B27 抗原肽加工)、Tapasin(参与 HLA 分子组装);
- 炎症通路相关基因:TNFR1(肿瘤坏死因子受体 1)、IL-6R(白细胞介素 - 6 受体)。这些基因通过协同作用,放大免疫炎症反应,降低疾病发病阈值。
2. 环境因素:肠道菌群与感染的核心作用
环境因素是 AS 发病的 “触发开关”,其中肠道菌群失调与感染最为关键。
- 肠道菌群失调AS 患者肠道菌群组成与健康人存在显著差异 —— 克雷伯菌属、大肠埃希菌属丰度升高 2~3 倍,乳杆菌属、双歧杆菌属丰度降低 50% 以上;克雷伯菌的脂多糖(LPS)可与关节软骨蛋白发生 “分子模拟”,被 HLA-B27 提呈给 T 细胞,触发自身免疫反应;同时,AS 患者肠道黏膜屏障完整性受损(紧密连接蛋白 Occludin 表达降低),导致菌群移位,进一步加重全身炎症。2022 年《Nature Reviews Rheumatology》研究证实,移植 AS 患者肠道菌群可使小鼠出现 AS 样病理改变(骶髂关节炎、脊柱骨赘形成),佐证了菌群的致病作用。
- 感染因素革兰氏阴性菌感染是 AS 的重要诱因,肺炎克雷伯菌(呼吸道、肠道感染)、沙门氏菌(食物中毒)、志贺氏菌(细菌性痢疾)感染后,AS 发病风险升高 2~4 倍;这些细菌的抗原(如沙门氏菌鞭毛蛋白)与人体关节组织抗原存在同源序列,通过 “交叉反应” 激活免疫细胞,启动炎症级联反应。
- 其他环境因素吸烟是 AS 病情进展的独立危险因素,吸烟者脊柱强直风险是不吸烟者的 2.5 倍,髋关节置换率升高 3 倍,且吸烟量与疾病活动度呈正相关(每日吸烟≥10 支者 BASDAI 评分升高 1.2 分);长期久坐、缺乏运动可加重脊柱僵硬,但尚无证据表明其为发病诱因;寒冷潮湿环境可能诱发症状急性发作,但与发病无直接关联。
(四)疾病负担与诊断延迟现状
AS 的疾病负担体现在生理功能受损、心理健康问题及经济成本增加三个维度,而诊断延迟是加重负担的核心因素。
- 生理与心理负担AS 患者发病后 10 年内致残率约 15%~20%,20 年内达 30%~40%;患者脊柱活动度(如 Schober 试验值)较健康人降低 40%~60%,步行能力受损(50% 患者无法完成 1000 米快走);焦虑、抑郁发生率达 25%~35%,显著高于普通人群(约 5%);因疼痛与功能受限,患者工作缺勤率升高 3 倍,职业发展受限。
- 经济负担全球范围内,AS 患者年均直接医疗费用(药物、检查、手术)约 1.5 万~3 万美元,间接费用(误工、护理)约 2 万~4 万美元;中国数据显示,生物制剂治疗患者年均医疗费用约 8 万~15 万元,显著高于传统药物治疗(约 1 万~3 万元),但可降低远期手术(如髋关节置换)风险,减少总负担。
- 诊断延迟全球 AS 平均诊断延迟时间为 3~7 年,中国约为 4~6 年,主要原因包括:
- 早期症状不典型:约 60% 患者早期仅表现为非特异性下腰背痛,易与腰肌劳损、腰椎间盘突出混淆;
- 临床认知不足:基层医生对 AS 的 “炎性腰背痛” 特征(夜间痛、晨僵 > 30 分钟、活动后缓解)掌握不足,仅 20%~30% 医生会主动排查 HLA-B27 或骶髂关节 MRI;
- 影像学限制:早期骶髂关节炎(0~Ⅱ 级)在 X 线片上难以识别,需依赖 MRI(敏感度 90%),但基层医院 MRI 普及率不足 50%,且检查费用较高。
强直性脊柱炎的免疫病理机制
10.4078/jrd.2023.004
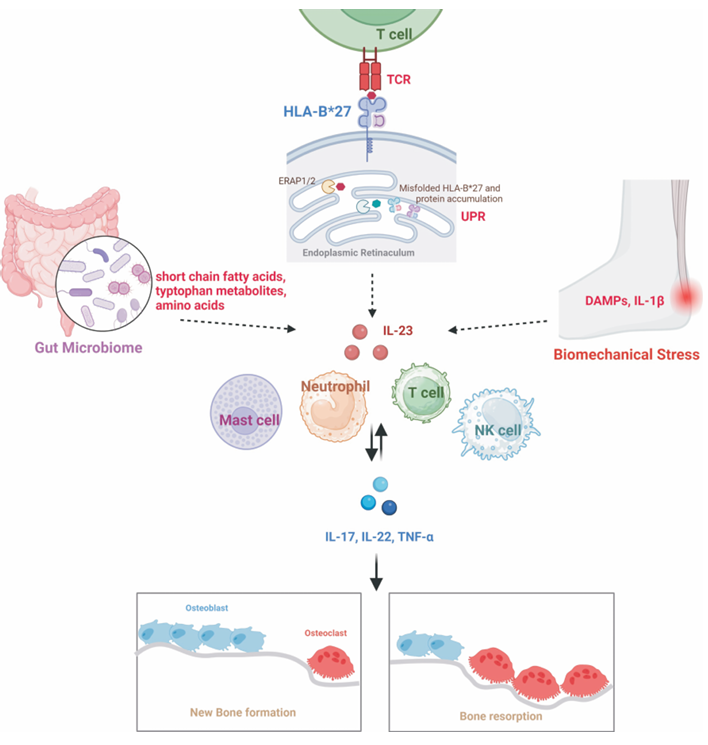
AS 的免疫病理机制是 “多细胞、多通路协同作用” 的复杂网络,核心是遗传易感个体在环境因素触发下,出现固有免疫与适应性免疫失衡,通过抗原提呈异常、免疫细胞活化、细胞因子风暴及组织修复异常,最终导致关节炎症与骨强直。近年研究进一步揭示了各环节的分子细节,为靶向治疗提供了精准靶点。
(一)抗原提呈异常:HLA-B27 的 “双重致病作用”
HLA-B27 是 AS 免疫病理的 “核心启动因子”,其致病机制主要通过以下两种途径实现:
1. 分子模拟与交叉反应
HLA-B27 作为 Ⅰ 类 MHC 分子,主要功能是提呈内源性抗原肽给 CD8+T 细胞。当机体感染肺炎克雷伯菌、沙门氏菌等细菌后,细菌的某些抗原肽(如克雷伯菌的 Hsp60 蛋白片段)与人体关节软骨蛋白(如 Ⅱ 型胶原蛋白)的氨基酸序列同源性达 60%~70%,可被 HLA-B27 提呈给 CD8+T 细胞,导致 T 细胞无法区分 “自身抗原” 与 “外来抗原”,进而攻击关节组织,引发自身免疫反应。2021 年《Cell》研究证实,AS 患者关节滑膜中存在针对 “细菌 - HLA-B27 - 自身抗原复合物” 的特异性 CD8+T 细胞,其数量与疾病活动度呈正相关。
2. 错误折叠与同源二聚体形成
HLA-B27 的重链(α 链)存在特殊的结构特征 —— 其胞外域的半胱氨酸残基易形成二硫键,导致蛋白错误折叠;错误折叠的 HLA-B27 重链无法与 β2 微球蛋白结合形成正常异二聚体,转而形成HLA-B27 同源二聚体(HLA-B27 homodimers)。这些同源二聚体可与 NK 细胞、γδT 细胞表面的杀伤细胞免疫球蛋白样受体(KIR,如 KIR3DL2)结合,激活固有免疫细胞,使其释放大量促炎细胞因子(TNF-α、IL-17);同时,同源二聚体还可通过 “非经典抗原提呈途径” 激活 CD4+T 细胞,放大适应性免疫炎症。研究显示,AS 患者外周血中 HLA-B27 同源二聚体水平是健康人的 3~5 倍,且与骶髂关节炎严重程度正相关。
(二)免疫细胞活化:固有与适应性免疫的协同失衡
AS 的炎症反应是固有免疫细胞(NK 细胞、γδT 细胞、巨噬细胞)与适应性免疫细胞(Th17 细胞、Treg 细胞)共同活化的结果,两者通过细胞间相互作用,形成 “炎症放大循环”。
1. 固有免疫细胞异常活化
- γδT 细胞是 AS 关节炎症中的 “核心效应细胞”,占炎症部位 T 细胞总数的 10%~20%(健康人仅 1%~2%)。γδT 细胞可通过两种方式活化:一是识别 HLA-B27 同源二聚体,二是识别细菌磷酸抗原(如异戊烯焦磷酸);活化后释放大量 TNF-α、IL-17,直接刺激滑膜细胞分泌炎症介质,同时促进破骨细胞分化,导致骨侵蚀。2023 年《Arthritis & Rheumatology》研究发现,AS 患者 γδT 细胞表面 IL-23 受体表达升高,对 IL-23 的敏感性增强,进一步维持其活化状态。
- 巨噬细胞是关节滑膜中的主要吞噬细胞,AS 患者滑膜中巨噬细胞数量增加 2~3 倍,且以 M1 型(促炎型)为主。M1 型巨噬细胞分泌 IL-1β、TNF-α、IL-6 等促炎细胞因子,同时释放基质金属蛋白酶(MMP-1、MMP-3),降解关节软骨与骨基质;此外,巨噬细胞还可通过 “抗原提呈” 激活 CD4+T 细胞,连接固有免疫与适应性免疫。
- NK 细胞AS 患者外周血及关节液中 NK 细胞活性升高 50%~80%,可通过与 HLA-B27 同源二聚体结合活化,释放穿孔素、颗粒酶等细胞毒性物质,杀伤关节软骨细胞;同时分泌 IFN-γ,促进 Th1 细胞分化,加重炎症。
2. 适应性免疫细胞失衡
- Th17 细胞与 Treg 细胞失衡Th17 细胞是分泌 IL-17 的 CD4+T 细胞亚群,在 AS 患者外周血及关节液中比例升高 2~3 倍;Treg 细胞是抑制免疫反应的 CD4+T 细胞亚群,比例降低 30%~50%,导致 “促炎 - 抑炎平衡” 打破。Th17 细胞分泌的 IL-17 可促进滑膜细胞分泌 IL-6、IL-8,吸引中性粒细胞浸润,同时刺激成骨细胞活化,导致骨赘形成;Treg 细胞数量减少则使免疫抑制功能减弱,无法控制炎症扩散。研究证实,AS 患者 Th17/Treg 比值与疾病活动度(ASDAS 评分)呈正相关,是评估病情的重要指标。
- Th1 细胞活化Th1 细胞分泌 IFN-γ,可激活巨噬细胞,促进 HLA-B27 表达,形成 “炎症 - 抗原提呈增强” 的正反馈循环;同时,IFN-γ 可抑制软骨细胞合成蛋白多糖,破坏软骨结构,加重关节损伤。
(三)细胞因子风暴:炎症反应的 “信号网络”
细胞因子是 AS 免疫病理中的 “核心信号分子”,促炎细胞因子与抗炎细胞因子的失衡是炎症持续的关键,其中TNF-α、IL-17、IL-23构成 “核心炎症轴”,主导疾病进展。
1. TNF-α:炎症的 “启动者与放大器”
TNF-α 是 AS 炎症的核心驱动因子,主要由活化的巨噬细胞、γδT 细胞、Th17 细胞分泌,其作用贯穿疾病全程:
- 促进滑膜细胞、成纤维细胞分泌 IL-6、IL-8,放大炎症反应;
- 激活破骨细胞(通过 RANKL/RANK 通路),促进骨吸收与骨侵蚀;
- 诱导血管内皮细胞表达黏附分子(ICAM-1、VCAM-1),吸引中性粒细胞、T 细胞浸润关节;
- 抑制软骨细胞合成 Ⅱ 型胶原蛋白与蛋白多糖,加速软骨降解。临床研究证实,阻断 TNF-α 可使 70%~80% AS 患者症状缓解,显著降低疾病活动度,是首个被证实有效的靶向治疗靶点。
2. IL-17:中轴炎症与骨形成的 “关键介质”
IL-17 主要由 Th17 细胞、γδT 细胞分泌,是 AS 中轴关节炎症(骶髂关节炎、脊柱炎)的关键调控因子:
- 促进滑膜细胞分泌 MMP-1、MMP-3,加重滑膜炎症与软骨损伤;
- 刺激成骨细胞分泌骨钙素、碱性磷酸酶,促进骨赘形成(AS 后期脊柱强直的核心机制);
- 与 TNF-α 协同作用,增强促炎效应 —— 两者同时阻断可使炎症缓解率提升 20%~30%,优于单一靶点阻断。研究显示,IL-17 水平与 AS 患者脊柱活动度(BASMI 评分)呈负相关,是预测脊柱强直的重要指标。
3. IL-23:Th17 细胞的 “存活信号”
IL-23 由树突状细胞、巨噬细胞分泌,是 Th17 细胞分化、存活与功能维持的关键细胞因子,构成 “IL-23/IL-17 轴”
- 促进 Th17 细胞增殖,增加 IL-17 分泌;
- 维持 γδT 细胞的活化状态,促进其分泌 TNF-α;
- 调控肠道黏膜免疫,加重肠道炎症(AS 合并肠病的重要机制)。阻断 IL-23 可间接抑制 IL-17 活性,同时改善肠道黏膜屏障功能,适合 AS 合并肠病的患者。
4. 其他关键细胞因子
- IL-6主要由滑膜细胞、巨噬细胞分泌,可促进 B 细胞活化、肝细胞合成急性期蛋白(CRP、ESR),是 AS 疾病活动度的重要标志物(CRP 水平与 BASDAI 评分正相关);
- IL-1β在 AS 急性炎症期发挥作用,可促进滑膜炎症与骨吸收,但其作用弱于 TNF-α,目前靶向 IL-1β 的药物(如阿那白滞素)对 AS 疗效有限;
- TGF-β在疾病后期发挥作用,可促进成纤维细胞增殖与胶原沉积,加速关节纤维化与脊柱强直。
(四)组织损伤与修复异常:从炎症到强直的 “病理进程”
AS 的病理改变并非单纯的炎症损伤,而是 “炎症 - 修复失衡” 的结果,最终导致关节结构破坏与脊柱强直,其过程可分为三个阶段:
1. 炎症期(早期)
- 滑膜炎症:滑膜充血、水肿,大量炎细胞(中性粒细胞、巨噬细胞、T 细胞)浸润,形成 “滑膜增生层”;
- 软骨损伤:巨噬细胞、滑膜细胞释放的 MMPs 降解软骨基质,软骨表面出现糜烂、缺损;
- 骨侵蚀:活化的破骨细胞在关节边缘(如骶髂关节、脊柱椎体边缘)形成骨侵蚀灶,X 线片表现为 “关节面模糊、骨质破坏”。
2. 纤维化期(中期)
- 炎症持续刺激滑膜成纤维细胞增殖,分泌大量 Ⅰ 型、Ⅲ 型胶原蛋白,形成纤维组织,填充关节间隙;
- 纤维组织向软骨表面侵袭,与软骨降解产物混合,形成 “纤维性关节强直”;
- 脊柱椎体边缘的纤维组织增生,逐渐取代受损的椎间盘组织,X 线片表现为 “椎间隙狭窄、椎体边缘骨赘形成早期”。
3. 骨强直期(晚期)
- 成骨细胞在纤维组织基础上异常活化(受 IL-17、TGF-β 调控),分泌骨基质,形成新骨(骨赘);
- 相邻椎体的骨赘相互融合,形成 “竹节样脊柱”(X 线片典型表现),脊柱丧失活动功能;
- 骶髂关节完全融合,关节间隙消失,表现为 “骨性强直”,患者出现永久性髋关节活动受限。
需注意,AS 的骨损伤具有 “双向性”—— 既存在骨侵蚀(破骨细胞活性增强),也存在骨形成(成骨细胞活性增强),且骨形成最终占主导,这与类风湿关节炎(以骨侵蚀为主)有显著区别,也是 AS 治疗中需同时关注 “抗炎” 与 “抑制骨强直” 的原因。
强直性脊柱炎的临床表现
AS 的临床表现具有 “多样性与进展性” 特征,以中轴关节症状为核心,可累及外周关节及多个器官系统,不同患者的症状严重程度与进展速度差异较大,且存在特殊人群(女性、老年、幼年型)的临床表现差异,临床需重点识别以避免误诊。
(一)核心表现:中轴关节症状
中轴关节(骶髂关节、脊柱)是 AS 的主要受累部位,症状具有 “炎性特征”,即夜间痛、晨僵、活动后缓解,与退行性骨关节病(活动后加重)有显著区别。
1. 骶髂关节炎:疾病的 “首发与核心病灶”
骶髂关节炎是 AS 的标志性病变,约 90% 患者以骶髂关节痛为首发症状,表现为:
- 疼痛部位:下腰部、臀部深处、腹股沟区,可放射至大腿后侧(但不超过膝关节);
- 疼痛性质:隐痛、胀痛或刺痛,夜间加重(患者常因疼痛醒来,需起床活动后缓解);
- 体征:“4” 字试验阳性(患者仰卧,一侧下肢屈膝屈髋,将踝部放在对侧膝关节上,按压膝关节时出现骶髂关节疼痛),骶髂关节压痛(按压骶髂关节处出现疼痛)。早期骶髂关节炎(0~Ⅱ 级)需通过 MRI 诊断(显示骨髓水肿、滑膜增厚),X 线片仅能识别 Ⅲ 级以上病变(关节间隙狭窄、骨质破坏)。
2. 脊柱炎:从腰椎到颈椎的 “渐进性受累”
脊柱炎多在骶髂关节炎后 1~5 年内出现,呈 “自下而上” 进展(先腰椎、再胸椎、最后颈椎),表现为:
- 腰椎受累下腰背痛加重,伴腰部活动受限,Schober 试验阳性(患者直立,在双侧髂后上棘连线中点上方 10cm、下方 5cm 处做标记,弯腰时两点距离增加 < 4cm,提示腰椎活动受限);
- 胸椎受累胸背部疼痛,胸廓活动度降低(吸气与呼气时胸廓周径差 <5cm,正常> 7cm),严重时出现 “胸廓固定”,影响呼吸功能;
- 颈椎受累颈部疼痛、僵硬,转头、低头受限,晚期可出现 “颈椎强直”(头部固定于前屈位,无法抬头或转头),严重影响日常生活(如无法开车、阅读)。
3. 脊柱强直与畸形:晚期特征性表现
脊柱强直是 AS 晚期(发病 10~20 年后)的典型表现,由椎体骨赘融合所致:
- 竹节样脊柱X 线片显示椎体边缘骨赘相互融合,形成 “竹节样” 改变,常见于腰椎与胸椎;
- 驼背畸形因脊柱前屈肌挛缩、后伸肌松弛,患者出现 “驼背”(脊柱后凸畸形),严重时下颌可抵至胸部,无法平视;
- 髋关节强直约 30% 患者晚期出现髋关节受累,表现为髋关节疼痛、活动受限,最终发展为骨性强直,需行髋关节置换术改善功能。
(二)外周关节与附着点炎表现
约 30%~50% AS 患者可出现外周关节受累,以 “非对称性、下肢大关节” 为主,附着点炎是 AS 的特征性表现之一。
1. 外周关节炎
- 受累关节:以膝关节、踝关节、髋关节为主,少数累及肩关节、肘关节,多为非对称性(如单侧膝关节受累),极少累及手、足小关节(与类风湿关节炎鉴别要点);
- 症状:关节肿胀、疼痛、活动受限,可伴关节积液,但关节畸形少见(除非长期未控制);
- 特殊人群:女性患者外周关节受累比例更高(约 60%,男性约 30%),幼年型 AS 几乎均以外周关节炎为首发症状。
2. 附着点炎
附着点炎是指肌腱、韧带、筋膜与骨的附着部位发生炎症,是 AS 的特征性表现,约 70% 患者可出现:
- 常见部位:足跟(跟腱附着点)、足底(跖筋膜附着点)、髌骨边缘(髌腱附着点)、脊柱棘突(韧带附着点);
- 症状:附着点处疼痛、压痛,如足跟痛(患者行走时加重,休息后缓解),严重时影响行走;
- 体征:跟腱压痛、髌骨边缘压痛,X 线片可显示附着点处骨质增生(如跟骨骨刺)。
(三)关节外表现
AS 可累及多个器官系统,关节外表现的发生率约 30%~50%,部分表现(如葡萄膜炎)可能早于关节症状出现,需警惕。
1. 眼部表现:前葡萄膜炎最常见
前葡萄膜炎(虹膜睫状体炎)是 AS 最常见的关节外表现,发生率约 20%~30%:
- 症状:突发眼痛、眼红、畏光、流泪、视力下降,多为单侧发作,每次发作持续 2~4 周;
- 特点:易复发(每年发作 1~3 次),若未及时治疗(如使用糖皮质激素滴眼液),可导致虹膜粘连、白内障、青光眼,甚至失明;
- 关联:前葡萄膜炎发作与 AS 疾病活动度相关,约 50% 患者在葡萄膜炎发作时伴关节症状加重。
2. 肠道表现:炎症性肠病关联
约 10%~20% AS 患者合并炎症性肠病(溃疡性结肠炎、克罗恩病),另有 20%~30% 患者虽无肠道症状,但肠镜检查显示肠道黏膜炎症(亚临床肠病):
- 症状:腹痛、腹泻(黏液脓血便)、腹胀,克罗恩病患者可出现肛瘘、肠穿孔;
- 特点:肠道症状与关节症状相互影响,肠道炎症加重时关节症状多同步加重,反之亦然;
- 诊断:需通过肠镜 + 病理检查确诊,AS 合并肠病患者对 IL-23 抑制剂反应更佳。
3. 心血管表现:远期风险升高
AS 患者心血管疾病风险升高,主要因长期慢性炎症导致血管内皮功能受损:
- 常见病变:主动脉瓣关闭不全(发生率约 3%~5%)、主动脉根部扩张、心包炎,晚期可出现冠心病、心力衰竭;
- 特点:多发生于病程 > 10 年的患者,症状隐匿(如主动脉瓣关闭不全早期无明显症状),需通过心脏超声定期筛查;
- 风险因素:吸烟、高血压、高血糖可进一步升高心血管风险,需积极控制。
4. 其他关节外表现
- 肺部表现约 1%~3% 患者晚期出现肺间质纤维化、肺大泡,表现为干咳、呼吸困难,多发生于脊柱强直、胸廓固定的患者;
- 神经系统表现因脊柱畸形或椎间盘突出,可压迫脊髓或神经根,表现为下肢麻木、无力、大小便失禁(罕见但严重);
- 贫血与疲劳约 50% 患者出现慢性贫血(正细胞正色素性贫血),与慢性炎症相关;疲劳是 AS 常见症状,严重时影响日常生活,与疾病活动度正相关。
(四)特殊人群的临床表现
1. 女性 AS 患者
- 中轴关节症状较轻,外周关节(膝关节、踝关节)受累比例更高;
- 诊断延迟时间更长(平均 4~6 年),易被误诊为纤维肌痛综合征或妇科疾病。
2. 老年 AS 患者(>40 岁发病)
- 起病隐匿,中轴关节症状进展缓慢,但髋关节受累风险更高;
- 合并症多(如高血压、糖尿病、骨质疏松),治疗需兼顾药物安全性;
- 易与退行性骨关节病(如腰椎骨关节炎)混淆,需通过 MRI 鉴别骶髂关节炎。
3. 幼年型 AS(<16 岁发病)
- 几乎均以外周关节炎(膝关节、踝关节)为首发症状,中轴关节症状多在发病 5~10 年后出现;
- 全身症状(发热、体重下降)更明显,易被误诊为幼年特发性关节炎。
(五)疾病活动度与预后评估工具
临床常用以下工具评估 AS 疾病活动度与预后,指导治疗决策:
- ASDAS(强直性脊柱炎疾病活动度评分)结合患者自评症状(腰背痛、晨僵)、CRP 水平及功能状态,分为缓解(<1.3)、低活动度(1.3~2.0)、中活动度(2.1~3.5)、高活动度(>3.5),是目前最推荐的评估工具;
- BASDAI( Bath 强直性脊柱炎疾病活动度指数)基于患者对疲劳、脊柱痛、外周关节痛等 6 项症状的评分(0~10 分),>4 分提示疾病活动;
- BASMI(Bath 强直性脊柱炎功能指数)评估脊柱活动度(如前屈、侧屈、旋转),分数越高提示功能受限越严重;
- 影像学评估骶髂关节 MRI 用于早期诊断(显示骨髓水肿),X 线片用于评估晚期结构损伤(如骨侵蚀、骨融合)。
总结与展望
AS 作为一种慢性进展性自身炎症性疾病,其流行病学特征揭示了遗传与环境的交互作用,免疫病理机制的深入为靶向治疗提供了精准靶点,临床表现的多样性要求临床医生提高识别能力,而免疫治疗药物的不断创新(从 TNF-α 拮抗剂到 IL-23 抑制剂、JAK 抑制剂)显著改善了患者预后。未来,随着单细胞测序、代谢组学技术的发展,AS 的早期诊断标志物(如肠道菌群代谢产物、循环 microRNA)与新型靶点(如 TLR4、PI3K)将逐步涌现,有望实现 “早期诊断、精准治疗” 的目标,进一步降低疾病负担。
Agrawal P, Tote S, Sapkale B (January 19, 2024) Diagnosis and Treatment of Ankylosing Spondylitis. Cureus 16(1): e52559. DOI 10.7759/cureus.52559Se Hee Kim and Sang-Hoon Lee, Updates on ankylosing spondylitis: pathogenesis and therapeutic agents,J Rheum Dis 2023;30(4):220-233 https://doi.org/10.4078/jrd.2023.0041
Hwang et al. Ankylosing spondylitis risk factors: a systematic literature review, Clin Rheumatol. 2021 August ; 40(8): 3079–3093. doi:10.1007/s10067-021-05679-7.
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)