
急性
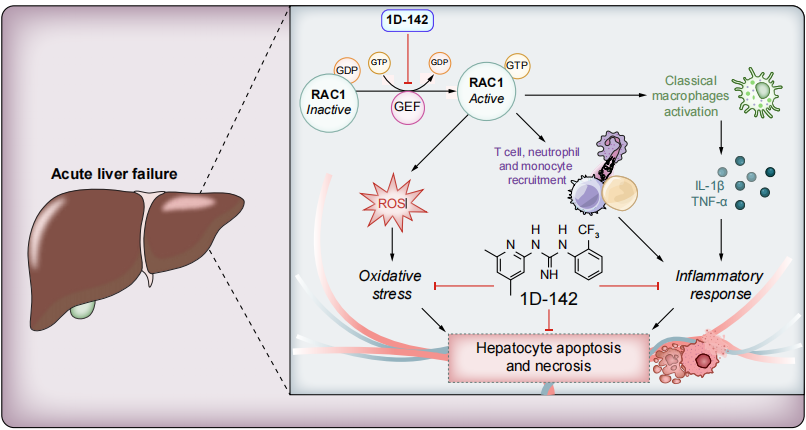
RAC1(Ras相关的C3肉毒杆菌毒素底物1)是RHO GTP酶家族成员。RAC1 可调控ALF中的关键过程,包括氧化应激与炎症反应。对此,近期发表于JHEP Reports的一项研究评估了RAC1抑制在ALF中的治疗潜力。
对来自ALF患者的转录组数据集(GSE38941和GSE80751)进行了Ingenuity 通路分析和基因本体分析。使用刀豆蛋白A、对乙酰氨基酚或D-半乳糖胺/脂多糖(n=10-21/组)在小鼠中诱导ALF。在体内和体外实验中均使用RAC1药理抑制剂1D-142。分析来自原代培养物和细胞系的肝细胞和巨噬细胞。将ALF小鼠模型肝脏的 RNA 测序数据(n = 3/组)与人类数据集进行整合分析。用1D-142体外处理人肝脏外植体(n=6)。
RAC1在人ALF样本中作为上游调节因子与免疫激活和氧化应激反应相关(p<0.05)。在小鼠ALF模型中,于损伤早期或晚期给予RAC1抑制剂1D-142,均能改善肝损伤(p<0.05)。1D-142处理可减少活性氧生成(p<0.01)、炎症细胞迁移(p<0.001)、细胞因子产生(p<0.05)及肝细胞死亡(p<0.05)。肝脏转录组学显示RAC1抑制可调控ALF中关键的失调通路。经1D-142处理的人ALF肝外植体显示坏死减少(p<0.05)和促炎基因表达降低(p<0.01)。
RAC1在ALF中驱动无菌性炎症和氧化应激。在临床前模型和人类肝脏外植体中,其药理抑制可保护肝脏免受损伤,支持RAC1作为ALF的潜在治疗靶点。

ALF是一种危及生命的疾病状态,以严重炎症反应和氧化应激为特征,目前治疗手段有限。本研究为靶向RAC1蛋白提供科学依据,在小鼠ALF模型和人肝外植体中,用1D-142对RAC1进行药理抑制可减轻肝损伤、免疫细胞浸润和氧化损伤。研究结果确定RAC1为ALF的新型治疗靶点,并为其潜在临床应用提供了转化医学支持。RAC1 靶向治疗值得在临床环境中开展进一步研究。
参考文献
Bueloni B, Fiore E, Cantero MJ,et al. RAC1 as a novel therapeutic target for acute liver failure. JHEP Rep. 2025 Aug 11;7(11):101547.
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)