医脉通编辑整理,未经授权请勿转载。
导语
大会上,上海交通大学医学院附属瑞金医院谢青教授就“基于长效干扰素为基础的慢乙肝临床治愈的贡献和挑战”这一主题进行了精彩演讲,医脉通对主要内容进行整理,以飨读者。
临床治愈已成为慢乙肝临床治疗过程中重要的追求目标,目前基于长效干扰素为基础的治疗策略在其中发挥重要作用。《慢性乙型肝炎防治指南(2022年版)》推荐核苷(酸)类似物(NAs)治疗后HBV DNA定量<检测下限、HBeAg阴转,且HBsAg<1500 IU/mL时,结合患者意愿可考虑加用
近期,华中科技大学附属同济医院宁琴教授牵头组织的《慢性乙型肝炎功能性治愈治疗导航:专家共识2.0》发布于Clinical and Molecular Hepatology,进一步为临床实践提供指导。共识指出对于可检测到HBV DNA的患者,PEG IFNα联合强效NAs治疗相较于NAs单药治疗,可提高HBsAg清除率。对于长期NAs治疗获病毒抑制的患者,加用PEG IFNα可能比直接换用PEG IFNα更可取。该方案不仅具有相当的HBsAg清除率,而且能降低NAs经治慢乙肝患者的复发风险,这一优势在HBeAg阳性患者中尤为显著。
而系统综述和荟萃分析显示PEG IFNα可提高不同慢性HBV感染人群的HBsAg清除率,尤其是NAs经治、非活动性HBsAg携带状态(IHCs)和儿童患者,治疗结束时的HBsAg清除率分别可达21%、57%、22%。
基于PEG IFNα-2b单药或联合治疗策略,我国开展包括丰富的临床研究项目覆盖慢乙肝全人群临床治愈:
• 珠峰项目: 核苷经治优势人群48周的HBsAg清除率达30%以上。
• 星光计划和容愈项目:IHCs人群48周的HBsAg清除率达50%以上。
• 萌芽项目: 慢乙肝儿童48周的HBsAg清除率近25%。
• 阳光工程: 慢乙肝孕妇产后48周的HBsAg清除率超40%。
• 破冰计划:ALT正常的HBeAg阴性慢乙肝患者48周的HBsAg清除率达35.8%。
“珠峰项目”历时七年,超1万例患者实现临床治愈的目标。阶段性成果多次获APASL/EASL/AASLD口头报告,核苷经治优势人群基于PEG IFNα治疗的临床治愈率超30%。
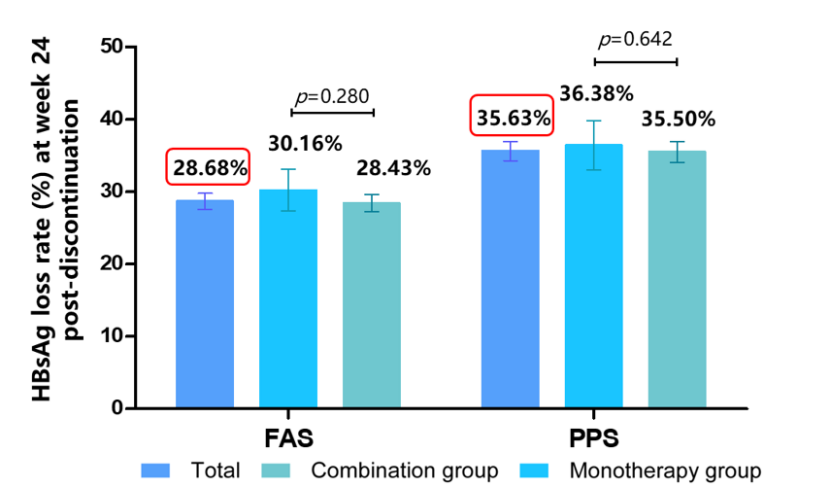
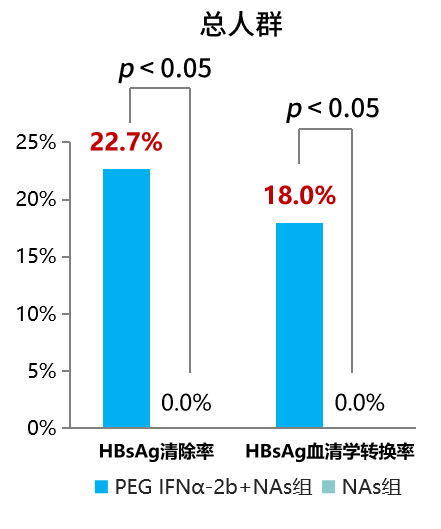
谢青教授团队进行的Paradise研究纳入196例NAs经治24周以上实现HBV DNA阴转且具有肝癌中高风险的慢乙肝患者,按1:2的比例随机分为NAs单药组和PEG IFNα-2b+NAs联合组,联合组治疗48周后转为NAs单药治疗,两组均随访240周。结果显示PEG IFNα-2b+NAs组第48周的HBsAg清除率和HBsAg血清学转换率均显著高于NAs组。
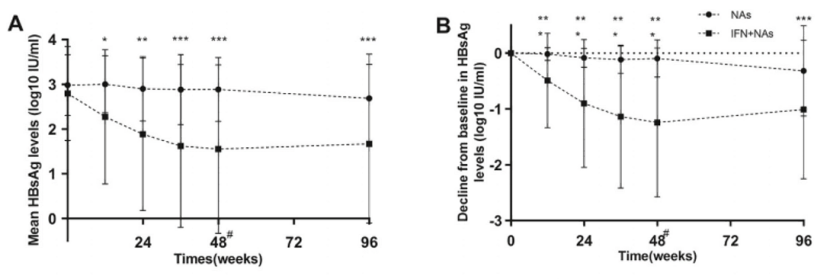
PEG IFNα-2b+NAs组第48周的HBsAg水平更低,HBsAg较基线降幅更大
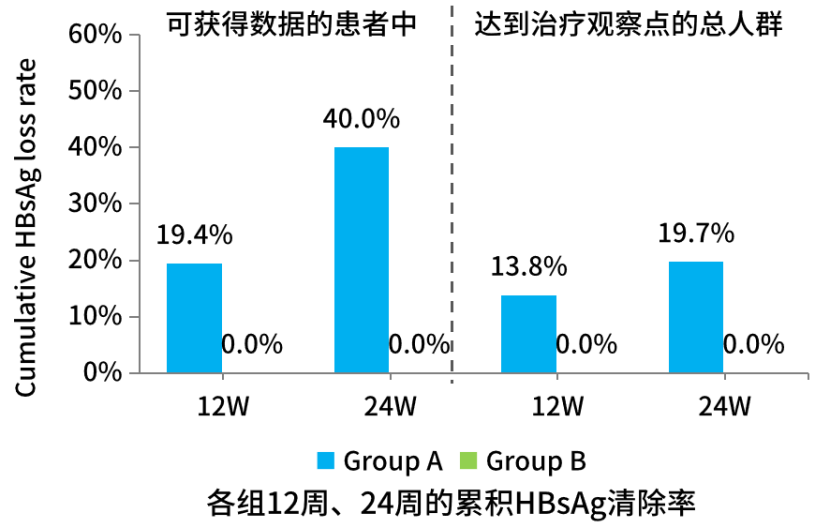
2023年12月启动的全国多中心“赢领项目”,纳入既往接受过干扰素治疗(停药间隔≥ 3个月)、上一轮干扰素治疗后HBsAg下降幅度≥ 80%、当前筛选时HBsAg≤500 IU/mL且HBsAg反弹幅度≤上一轮治疗基线值50%的患者,根据患者意愿分为PEG IFNα-2b±NAs治疗组(Group A)或NAs单药治疗组(Group B) ,治疗48周。结果显示,PEG IFNα-2b±NAs组在第12、24周的HBsAg清除率分别为19.4%和40.0%。
➤IHCs基于PEG IFNα治疗的HBsAg清除率达50%以上
IHCs仍有疾病进展风险,多项研究显示IHCs基于PEG IFNα单药或联合治疗的HBsAg清除率高,可达50%以上,若HBV DNA阴性或HBsAg低水平,疗效更佳。
基于循证证据,1-18岁慢乙肝儿童基于(PEG)IFNα治疗的HBsAg清除率超50%;年龄越低,HBsAg清除率越高。1-3岁达60%以上。其临床治愈的优势在于病毒载量低、感染时间短,感染肝细胞及整合DNA更低、具有免疫学优势包括胸腺和免疫系统持续发育、HBV特异性T细胞耗竭程度低。
在追求临床治愈的过程中,如何精准识别优势人群,制定合理治疗方案至关重要。荟萃分析基于PEG IFNα治疗获HBsAg清除的预测因素,可用基线特征指导治疗(BGT)和应答指导治疗(RGT)策略来辅助临床决策。前者包括HBsAg、HBV DNA、治疗策略等,后者包括HBsAg动态下降趋势、ALT变化等治疗中应答指标,以帮助评估患者治疗至 48 周的潜在获益。治疗超过48周时,第24周HBsAg水平可能是更好的预测因素。
而慢乙肝作为病毒免疫介导疾病,宿主免疫功能至关重要。固有免疫应答、体液免疫、细胞因子/趋化因子水平、T细胞应答及ALT反弹等指标,可帮助识别可获得临床治愈的优势人群。
近年来,新型预测模型的开发与应用取得显著进展。预测PEG IFNα治疗获HBsAg清除的列线图模型不断丰富。HBsAg清除预测公式纳入性别、
此外,更多HBsAg预测模型探索了预测PEG IFNα疗程或HBsAg下降速率。研究显示基线HBsAg水平与PEG IFNα-2b治疗获得HBsAg清除所需疗程呈显著正相关。而HBsAg下降速度可间接反映宿主免疫功能恢复及病毒清除能力,下降越快则获得HBsAg清除机会可能更多。
对于获得HBsAg清除的患者,如何维持治愈持久性、降低复发风险,成为改善患者长期结局的重要问题。目前HBsAg清除后中位随访1-5年的HBsAg清除率约维持在82%-95%。仍有部分患者可能复发,基于IFNα治疗的临床治愈持久性预测因素包括基线HBsAg、HBeAg、HBsAb水平、巩固治疗时间、停药时HBcAb水平、停药时HBcrAg水平。联合多个因素可更好地预测慢乙肝患者HBsAg清除的持久性。
针对HBsAg清除后复发患者,开展再治疗可有效提升持久性。研究显示,HBsAg清除后复发患者接受PEG IFNα再治疗的HBsAg清除率超85%。Ⅲ期随机对照试验(RCT)显示,NAs经治患者经PEG IFNα-2b联合TDF治疗的临床治愈率超30%,临床治愈患者延长随访52周的维持率较高近100%。
目前临床治愈定义为停药后24周持续HBsAg清除和HBV DNA检测不到,但荟萃分析显示目前新药实现真正临床治愈率为0%,且复发率较高。新药联合PEG IFNα治疗可能是提高HBsAg清除率,实现真正临床治愈且持久性佳的关键策略。
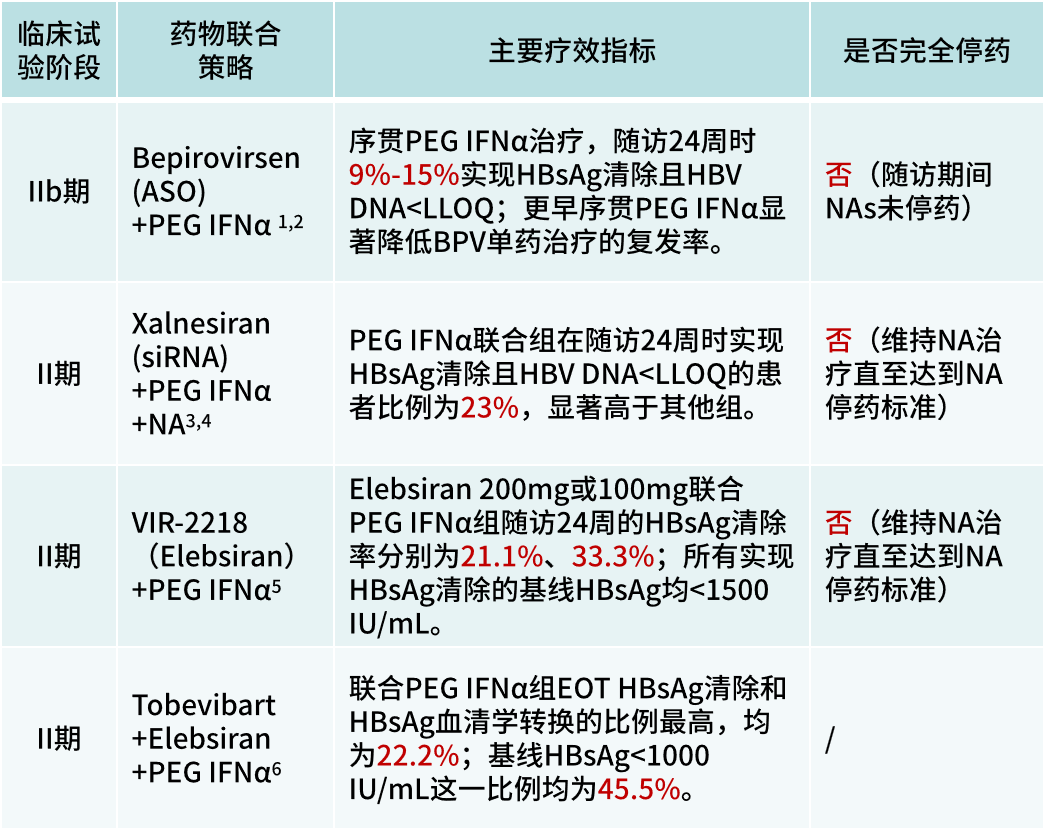
以长效干扰素为基础的联合治疗仍是现阶段慢乙肝临床治愈的重要策略。未来,需优化联合治疗方案提升慢乙肝患者临床治愈率并探索维持临床治愈后持久性,降低复发风险的策略,以实现慢乙肝更高水平的临床治愈。

谢青 教授
上海交通大学医学院附属瑞金医院感染科科主任、博士生导师、二级教授
第十、十一届中华医学会感染病分会副主任委员
中国医师协会感染科医师分会副会长
第二届上海医师协会感染科医师分会会长
上海市感染性疾病临床质量控制中心主任
上海医学会感染病分会前任主任委员
上海医学会肝病学分会候任主任委员、上海医学会内科学分会副主任委员
《中华传染病杂志》副主编、《肝脏》杂志主编
全国卫生系统先进工作者、全国卫生系统职业道德标兵
上海市领军人才、上海市优秀学科带头人、上海市十佳公共卫生工作者、五洲女子科技奖和第一届“医树奖”、享受国务院政府特殊津贴
在感染和肝病领域Top杂志“NEJM”、“BMJ”、“Hepatology”、“J Hepatology”、“CID”、“ J Infect Dis”等以及国内核心刊物发表论文300余篇。
荣获国家科技进步二等奖、上海市科技进步一等奖、上海市医学科技进步一等奖、上海市五一巾帼创新奖、华夏科技进步一等奖等。
参考文献
[1] 《慢性乙型肝炎防治指南》(2022年版)
[2] Wu D, et al. Clin Mol Hepatol. 2025.
[3] Song CR, et al. EASL 2025, Abstract (WED-028).
[4] Xie C, et al. APASL2025, Abstract (OP0368).
[5] Ren S, et al. APASL2025, Abstract (OP0036).
[6] Mo ZS, et al. APASL2025. Abstract (OP0395).
[7] Zhang HF, et al. APASL2025, Abstract (OP0396).
[8] Guo Y, et al. AASLD2023, Abstract (1413-C).
[9] Zhang C, et al. AASLD2024, Abstract (314).
[10] Jiang SW, et al. Antiviral Res, 2024: 105892.
[11] Xie Q, et al. APASL2025, Abstract (LB0008).
[12] Zhang M, et al. Hepatol Int, 2024.
[13] Li J, et al. J Clin Transl Hepatol, 2023, 11(5):1011-1022.
[14] Dong Y, et al. J Viral Hepat, 2020, 27(12): 1338-1343.
[15] Liu Y, et al. J Viral Hepat, 2019, 26 Suppl 1: 69-76.
[16] Fan H, et al. J Viral Hepat, 2019, 26 Suppl 1: 77-84.
[17] 潘静, 等. 国际病毒学杂志, 2020, 27(03): 214-218.
[18] Pan J, et al. J Clin Transl Hepatol, 2022, 10(3): 405-411.
[19] Wu XL, et al. Aliment Pharmacol Ther, 2023, 58(9):866-873.
[20] He Y, et al. BMC Pediatrics, 2022, 22(1): 426.
[21] Huang L, et al. Front Immunol. 2023, 14: 1282922.
[22] Wang FS, et al. Hepatol Int. 2024, 18(1):296-298.
[23] Jiang S, et al. Hepatol Int, 2024,18(3):892-903.
[24] Tan Z, et al. Hepatology International, 2024.
[25] Liao X, et al. Clin Gastroenterol Hepatol. 2025, S1542-3565(25)00524-5.
[26] Cortés-Ríos J, et al. Clin Pharmacol Ther. 2025.
[27] Yan F, et al. Frontiers in Immunology, 2025, 15: 1528758.
[28] Xin Y, et al. Infect Dis Model. 2025, 10(3):979-988.
[29] Lin X, et al. Front Immunol, 2022, 13: 879835.
[30] Wu FP, et al. J Clin Med, 2023, 12(1): 361.
[31] Wang GQ, et al. AASLD2024, Abstract (276).
[32] Hou FQ, et al. APASL2025, Abstract (OP0275).
[33] Chen J, et al. Hepatol Int. 2025.
[34] Buti M, et al. AASLD2023, Abstract (49).
[35] Buti M, et al. J Hepatol. 2024, S0168-8278(24)02488-7.
[36] Hou JL, et al. N Engl J Med 2024;391:2098-2109.
[37] Hou JL, et al. AASLD2024, Abstract (252).
[38] Jia J, et al. EASL2025, Late-breaker Poster (LBP-016).
[39] Gane E, et al. AASLD2024, Late Breaking Abstracts (5007).
注:图片引自讲者会议幻灯
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)