1994年,Lapidot团队发表了一篇开创性论文,首次为
通过将AML细胞移植到缺乏功能性T细胞和B细胞的重症联合免疫缺陷(SCID)小鼠体内,他们发现只有具有CD34+CD38-免疫表型的少量细胞亚群可在体内诱发白血病(图1)。这类罕见的AML细胞当时称为SCID白血病起始细胞,后来被命名为白血病干细胞(LSC),其数量远少于集落形成单位,在体外可大量增殖,并且能够重建临床样本中存在的细胞类型和特异性特征。该研究基于实验室前期将正常人骨髓细胞移植至SCID小鼠的开创性工作,成功将SCID小鼠模型确立为研究人类髓系白血病的有效工具。尽管后续研究发现NSG小鼠等其他品系是更适宜的移植宿主,但正如Lapidot等人的报告在文末前瞻性指出的那样,他们首次构建了一个功能性框架,旨在“理解LSC转化与进展的机制,并验证新型治疗策略”。

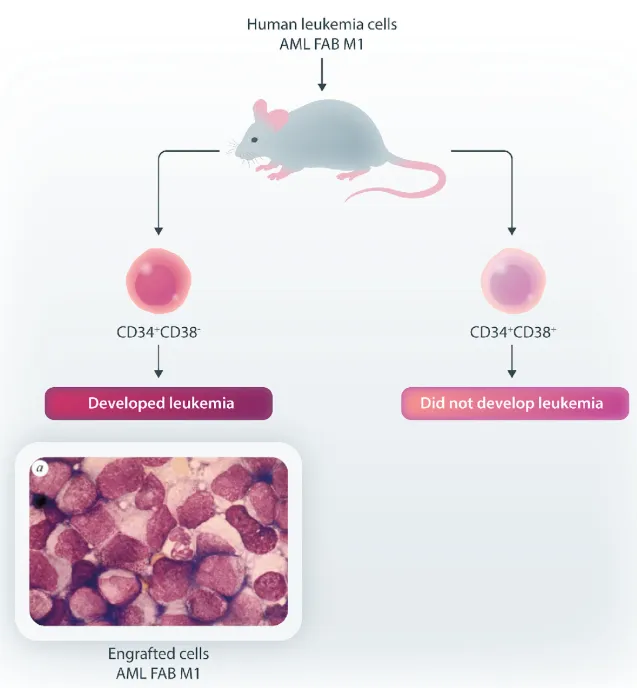
图1 人类AML的重现及其LSC层级结构的证据
这项研究最核心的发现在于提出了AML呈层级化组织的概念,这与正常造血过程具有相似性。这表明AML可能由一小群具有自我更新能力的LSC所维持,后续研究通过二次移植试验验证了这一假说。
LSC处于层级顶端的理念,激发了研究者对LSC生物学特性的深入探索,以发现其治疗脆弱性。
与许多开创性发现一样,随着时间推移与技术进步,该模型不断得到完善,其复杂性也呈现出新的维度。具有白血病起始潜能的遗传异质性AML克隆可以平行演化,且可能无法追溯至单一起源细胞。即使在基因相同的白血病起始细胞群中,表观遗传机制仍能实现功能多样性,这表明干性可能代表一种状态而非固定属性。尽管自1994年以来已取得重大进展,但AML治疗中“初始缓解后复发”仍是巨大的临床挑战,这反映了LSC的可塑性以及分化的白血病细胞在治疗压力下获得LSC特性的能力。令人不安的是,治疗本身似乎在"训练"AML系统,随着每一轮的治疗缓解与复发,白血病起始细胞会持续扩增。
Lapidot团队的这项奠基性研究是血液学研究领域的重要里程碑,它为该领域提供了一个能比基因修饰小鼠模型更全面捕捉人类AML复杂性的研究体系。其中"白血病起始细胞主要存在于CD34+CD38-细胞群"的观点经受住了时间考验,并首次提示区分LSC与造血干细胞存在挑战。三十年后,患者源性异种移植已成为治疗试验、机制与靶点体外验证的金标准。
文献来源:Cruz-Rodriguez N, Deininger MW. The birth of a paradigm: leukemia-initiating cells in acute myeloid leukemia. Haematologica 2025;110(5):1051-1052; https://doi.org/10.3324/haematol.2025.287394.
编辑:Annie
审校:Cherry
排版:Cole
执行:Cole


戳“阅读原文”,查看更多内容
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)