
胆道恶性肿瘤(BTC)是一种起源于胆管上皮、具有高度异质性的恶性肿瘤,由不同的病理类型组成,包括
手术切除是早期BTC的唯一根治手段,但超过半数患者确诊时已失去手术机会,晚期BTC患者的治疗选择十分有限。近年来,免疫治疗取得了突破性进展。Ⅲ期临床试验TOPAZ-1和KEYNOTE-966证实,在

1BTC的免疫微环境
绝大多数BTC在免疫学上被归类为“冷肿瘤”,其肿瘤微环境具有高度的免疫抑制性与复杂性,在促肿瘤炎症发生的同时介导免疫逃逸。免疫抑制性细胞群体在BTC的免疫微环境中占据主导地位,其富含髓系细胞,包括髓源性抑制细胞(MDSC)、肿瘤相关巨噬细胞(TAM)和肿瘤相关中性粒细胞(TAN)。此外,耗竭型CD8+T细胞在BTC微环境中显著扩增,其特征性表达多种免疫检查点基因如TIGIT,靶向TIGIT可阻断其介导的免疫抑制性细胞互作。肿瘤相关成纤维细胞是BTC微环境中主要的间质细胞类型,通过分泌细胞外基质蛋白构建典型的纤维化环境,为BTC提供免疫屏障。
机制研究进一步揭示了微环境中各组分的动态调控关系。研究表明,CCA中TAM是PD-L1的主要来源,单一靶向TAM会引发粒细胞样MDSC(G-MDSC)的代偿性聚集进而产生治疗抵抗;而同时靶向TAM和G-MDSC可显著增强PD-1抑制剂的疗效。靶向CTLA-4联合GC方案同样可提高PD-1抑制剂的治疗响应,机制在于三联疗法可募集并活化CXCR3+CD8+T细胞,同时减少单核样MDSC(M-MDSC)的免疫抑制功能。He等发现PD-1抑制后可代偿性激活TIM3通路,导致免疫逃逸;同时靶向PD-1和TIM3有望恢复CD8+T细胞的抗肿瘤活性。
综上所述,多种免疫细胞与间质细胞之间错综复杂的相互作用,共同构筑了BTC的免疫抑制微环境,靶向多种免疫抑制细胞与免疫检查点的多靶点联合方案有望逆转免疫抑制,实现BTC从“冷肿瘤”向“热肿瘤”的转化。

2BTC免疫治疗响应相关生物标志物
目前尚无单一可靠的生物标志物被纳入BTC的常规临床管理,但研究揭示了多个潜在的预测因子(表1)。

约5%的BTC存在dMMR,从而导致微卫星高度不稳定(MSI-H)表型。MSI/dMMR的BTC因DNA修复缺陷导致移码突变,产生大量新抗原,激活强效的抗肿瘤免疫反应,使得此类肿瘤对免疫检查点抑制剂(ICI)的响应率显著高于错配修复功能完整(pMMR)的肿瘤。多项临床试验证实MSI/dMMR的BTC患者可显著获益于ICI,基于这些卓越数据,dMMR/MSI-H已成为目前BTC中预测ICI疗效最明确的生物标志物。然而,由于其发生率较低,仅能使少数患者获益。
TMB是另一个潜在的预测指标。研究表明,高MSI肿瘤有82.1%同时表现为高TMB,但高TMB肿瘤仅有18.3%同时伴随高MSI,说明存在大量微卫星稳定但TMB高的肿瘤群体。Lin等对803例中国BTC患者进行的基因组分析揭示了中西方BTC人群的基因突变谱差异,不同于西方人群,中国队列中最常改变的BTC相关基因包括 TP53(53%)、KRAS(26%)、ARID1A(18%)、LRP1B(14%)和CDKN2A(14%)。另一项研究显示,TMB水平高低与PFS无关,但高TMB与更高的客观缓解率(ORR)相关。上述研究提示TMB可作为潜在生物标志物,以筛选免疫治疗获益的患者。
尽管PD-L1表达是其他癌症中常用的免疫治疗生物标志物,但在BTC中其预测价值仍未明确。在TOPAZ-1试验中,无论肿瘤细胞PD-L1表达水平如何,患者从伐利尤单抗联合化疗中的生存获益相似。KEYNOTE-966试验也报告了PD-L1表达水平的预测价值有限。然而,在KEYNOTE-028试验中,PD-L1的表达水平与BTC患者接受帕博利珠单抗治疗的临床效果呈正相关。这些矛盾的发现可能与其高度异质性、PD-L1检测抗体、判读标准的不同相关。因此,将PD-L1作为预测BTC免疫治疗响应的独立生物标志物具有局限性,仍需更多的研究验证。

3BTC当前的免疫治疗策略(表2)
ICI单药治疗是BTC免疫治疗的基础方案。Ⅱ期试验KEYNOTE-158和Ⅰb期试验KEYNOTE-028评估了PD-1抑制剂帕博利珠单抗治疗晚期BTC患者的安全性与有效性,并表明帕博利珠单抗的治疗相关不良事件发生率低于20%。另一项研究展示了晚期难治性BTC患者使用PD-L1抑制剂度伐利尤单抗后的生存获益。以上研究表明,PD-1/PD-L1抑制剂对BTC有一定的治疗效果,尽管效果未超过一线化疗方案,但其可控的安全性与耐受性为后续的联合治疗奠定了基础。
ICI联合GC方案已成为晚期BTC一线治疗的新标准,这一地位由两项大型Ⅲ期临床试验共同确立,两项试验表明ICI联合GC方案可以显著提高BTC患者的生存获益。TOPAZ-1研究的长期随访更显示,联合组的24个月总生存率是化疗组的2倍(23.6% vs 11.5%),且未显著增加3级及以上不良事件发生率,提示ICI联合化疗在改善患者长期预后方面具有显著优势。此外,多项Ⅱ期研究也报告了令人鼓舞的疗效和可控的安全性。这些证据共同确立了免疫联合化疗作为晚期BTC一线治疗的基石地位。
血管生成是肿瘤发生发展过程中关键的病理生理环节,靶向药物通过阻断血管内皮生长因子受体及成纤维细胞生长因子受体可以抑制血管形成。同时靶向药物可抑制促血管生成相关的酪氨酸激酶活性,并通过调节免疫微环境促进ICI的治疗效果。一项Ⅱ期临床研究仅评估ICI联合
ICI联合其他治疗方案仍在探索。双免疫检查点抑制疗法,如
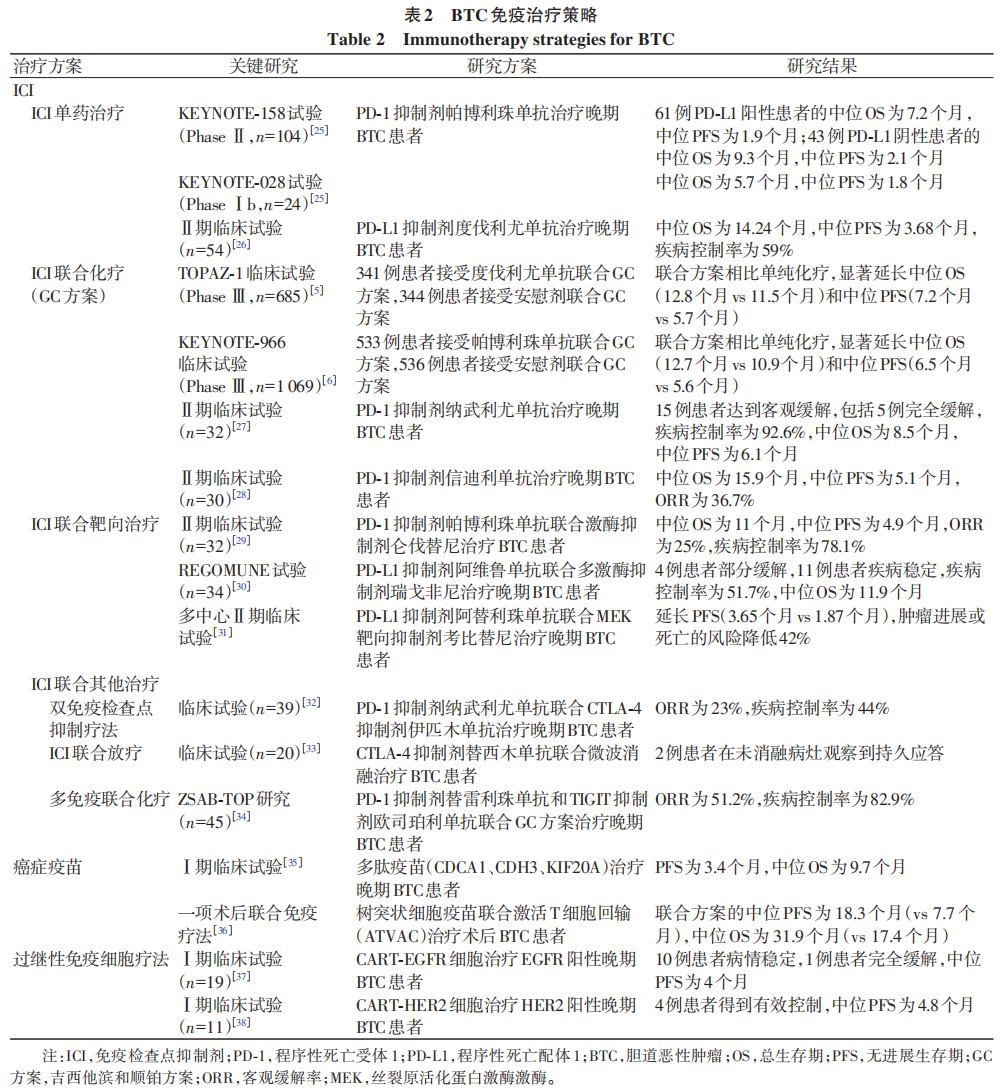
癌症疫苗接种是通过引入一种或多种肿瘤抗原,以诱导机体产生特异性免疫应答的治疗方法,旨在增强免疫系统对癌细胞的识别与清除能力。根据所使用的抗原种类,通常可分为3类:基于细胞的肿瘤抗原递送、肿瘤抗原蛋白以及编码肿瘤抗原的遗传物质。一项Ⅰ期临床试验表明,一种针对CDCA1、CDH3、KIF20A的多肽疫苗可以成功诱导晚期BTC患者的特异性T细胞免疫反应,可使55.6%的患者达到病情稳定。虽然单一疫苗的治疗效果有限,但一项术后联合免疫疗法的结果显示,联合方案可提高术后BTC患者的生存预期,展示肿瘤疫苗联合疗法的治疗潜力。在靶点发掘方面,Tang等筛选出3个mRNA疫苗的理想靶点,分别为TRRAP、FCGR1A、CD247,并预测“冷肿瘤”的免疫系统可被疫苗唤醒,使难以响应免疫治疗的患者获益。在GBC方面,整合基因组显示ELF3、TP53和ERBB2可作为潜在的疫苗靶点,预示着GBC的个性化疫苗具有发展前景。目前该领域仍处于早期探索阶段,个性化mRNA疫苗及联合策略是未来的重要方向。
ACT通过体外改造和扩增肿瘤特异性T细胞,将其回输至患者体内,以实现对肿瘤的靶向杀伤。尽管CAR-T疗法在血液肿瘤治疗中已取得显著成效,但在BTC等实体瘤治疗中仍面临肿瘤异质性、T细胞浸润不足和免疫抑制微环境复杂等多重挑战。
研究显示,对1例携带ERBB2突变的转移性CCA患者,回输体外扩增的突变特异性Th1细胞后,其肿瘤出现了显著消退并长期维持。一项Ⅰ期临床试验显示,CART-EGFR细胞回输后患者总体耐受性良好,且有一定的治疗效果。在HER2阳性实体瘤的Ⅰ期临床试验中,CART-HER2细胞的有效性同样得到证明。目前抗MUC-1和CD133的CAR-T疗法已在体外研究显示疗效,需进一步验证;针对不可切除胰腺或BTC中的CD19的CAR-T疗法(NCT06196658)和针对iCCA中的MUC-1的CAR-T疗法(NCT03633773)正在进行中。总而言之,ACT应用于晚期BTC的有效性和安全性仍需更多的基础研究和大规模临床试验来证实。

4小结与展望
BTC的免疫治疗已从早期的探索阶段迈入了临床实践,以TOPAZ-1和KEYNOTE-966研究为代表的化疗联合免疫治疗方案成功改写了晚期BTC的一线治疗标准,为患者带来了确切的生存获益。然而,BTC高度的异质性和复杂的免疫抑制微环境决定了其免疫治疗仍面临巨大挑战。未来BTC治疗的关键方向在于构建多组学驱动的精准生物标志物体系以优化患者分层,开发新型免疫联合策略以克服治疗抵抗,通过靶向免疫抑制微环境实现“冷热转化”,并推动个体化疫苗及下一代细胞疗法等前沿突破。

https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH251202

李鑫, 敖建阳, 王敬晗, 等. 胆道恶性肿瘤的免疫治疗现状及研究进展[J]. 临床肝胆病杂志, 2025, 41(12): 2447-2452
来源:临床肝胆病杂志
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)