JCC: 生物制剂治疗的达标治疗优化对真实世界队列中
Treat-to-target optimization of biologic therapy is effective on endoscopic and histologic outcomes in a real-life cohort of ulcerative colitis–the TACTIC-UC Study
Journal of Crohn's and Colitis
DOI: 10.1093/ecco-jcc/jjaf239 [IF=8.7]
来源:IBD Daily
溃疡性结肠炎 (UC) 是一种以进行性组织损伤和累积性残疾为特征的慢性结肠炎症性疾病。当前中重度UC的治疗主要依赖先进的生物制剂和小分子药物,治疗目标的设定也随之更为严格。STRIDE (Selecting Therapeutic Targets in Inflammatory Bowel Disease) II共识将症状缓解确定为首要目标,但由于临床症状与黏膜炎症程度常不一致,内镜缓解被确立为关键长期目标,这推动了"达标治疗"理念的应用,即通过定期评估和未达标时的治疗调整来指导临床决策。
治疗优化的核心策略包括剂量递增、给药间隔缩短和再诱导。目前,无论是注册试验还是真实世界实践,优化决策主要依据症状驱动。IBD领域关于达标治疗的证据多来自
在此背景下,TACTIC-UC (Treat-to-target Approach for endosCopic and hisTologIc ouTcomes in ulcerative colitis) 研究旨在探讨内镜引导的治疗优化在临床缓解或轻度但内镜下中重度活动的UC患者中的真实世界有效性,以期为临床实践提供循证依据。
➤研究设计:
研究纳入了2019年1月至2024年6月期间,在临床上表现为静止期或轻度活动 (部分Mayo评分≤4且直肠出血子评分≤1),但内镜下呈中重度活动 (内镜Mayo评分≥2) 的UC患者。这些患者正接受抗TNF-α药物 (
优化策略包括根据产品标签、临床判断和报销指南进行剂量递增 (例如,英夫利西单抗增加至7.5 mg/kg或10.0 mg/kg,每8周一次) 或缩短给药间隔 (例如,英夫利西单抗5-10 mg/kg改为每6或4周一次,阿达木单抗40 mg改为每周一次,维得利珠单抗300 mg改为每4周一次,乌司奴单抗90 mg改为每8周一次)。观察期从治疗优化开始,持续至12个月或停药 (以先发生者为准)。
➤终点指标:
主要终点是优化后12个月内实现黏膜愈合 (内镜Mayo评分≤1) 的累积概率。次要终点包括内镜缓解、组织-内镜黏膜联合缓解、生物标志物和激素使用趋势、不良事件、临床复发及治疗持续性等。
➤统计方法:
研究使用Kaplan-Meier曲线估计累积概率。多变量分析采用LASSO进行变量筛选,并使用考虑患者内聚类的Cox比例风险模型。为比较抗TNF-α与非抗TNF-α药物的疗效,采用了基于逆概率加权的加权分析。此外,研究通过仅纳入每位患者的首次优化事件或仅限于极轻度临床症状患者的敏感性分析来评估结果的稳健性。为探索三种药物之间的差异,研究还利用条件生成对抗网络生成了一个合成患者队列进行补充分析。
1. 基线特征
本项回顾性研究最终纳入了142名UC患者的164次治疗优化试验。患者基线特征分析显示,近半数存在重度内镜下活动,近三分之一在基线时使用皮质类固醇治疗,超过四成为首次接受生物制剂或小分子药物等先进疗法。在纳入的治疗方案中,抗肿瘤坏死因子-α药物占比最高,其次为乌司奴单抗和维得利珠单抗。所有患者在启动治疗优化前接受原方案治疗的中位时间为4.8个月。
2. 内镜和组织学结局
治疗后中位6.4个月进行的内镜随访显示,1年累积黏膜愈合率为54.2%,内镜缓解率为28.8%,组织-内镜黏膜联合缓解率仅为20.9%。多因素分析发现两个一致的负面预测因子:基线时使用皮质类固醇激素和接受非抗TNF-α药物治疗。此外,基线内镜下重度活动 (Mayo评分3分) 也预示着更低的黏膜愈合和内镜缓解概率。值得注意的是,Weibull回归分析提示未能实现缓解的风险可能随时间推移而增加,说明早期应答的重要性。研究通过多种敏感性分析验证了结果的稳健性,包括使用不同统计模型、仅分析首次优化事件、以及聚焦于临床症状完全静止的患者亚组,所有分析均得出与主要结论高度一致的结果。这些发现表明,尽管治疗优化能使部分患者获益,但基线激素使用、特定药物选择及内镜下疾病严重程度显著影响着深度缓解的实现概率。
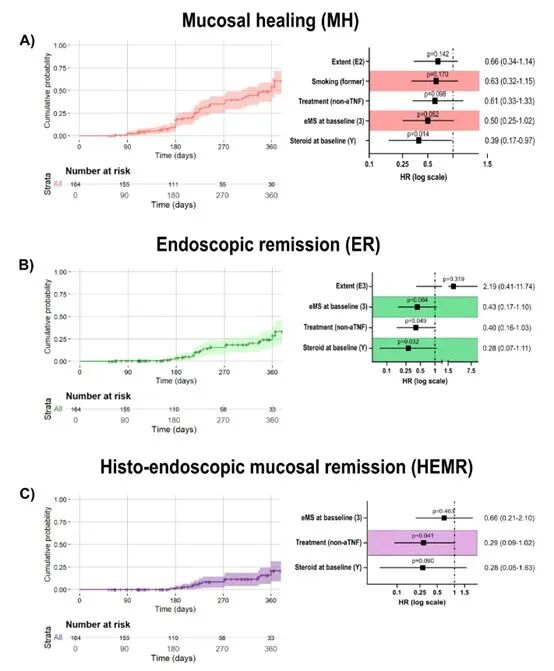
图1 内镜引导下治疗优化后的黏膜愈合累积概率(A)、内镜缓解累积概率(B)和组织内镜下黏膜缓解累积概率(C)
3. 生物标志物趋势、类固醇使用、安全性和长期持续性
基线时多数患者存在炎症活动,69.3%的
在为期一年的观察中,共记录67例需干预的不良事件 (以感染为主),但均未导致停药。长期随访显示治疗持续性随时间显著降低:1年持续率为56.3%,3年降至25.6%。临床复发率高达60.9%,至末次随访时仅39%患者维持原方案,8.5%最终需手术治疗,其中仅少数曾达到深度缓解。分层分析表明,达到任何程度的黏膜愈合均可降低治疗中断风险,且组织学缓解的保护作用可能更强;而基线使用激素和内镜评分高则与中断风险增加相关。
4.药物对内镜和组织学结果的影响
通过逆概率加权调整后的比较分析发现,接受抗肿瘤坏死因子-α药物治疗的UC患者,在内镜引导下治疗优化后达到深度缓解的可能性显著高于接受维得利珠单抗或乌司奴单抗治疗的患者。具体数据显示,抗TNF-α组在黏膜愈合、内镜缓解及组织-内镜黏膜联合缓解方面的一年累积概率分别为66.3%、39.3%和33.2%,均明显高于非抗TNF-α组的45.0%、19.8%和8.1%,且差异具有统计学意义。非抗TNF-α治疗为内镜缓解和组织-内镜黏膜联合缓解的独立负面预测因子。所有统计模型均显示,未能达到缓解的风险随时间推移而增加。研究通过多种敏感性分析验证了上述结论的稳健性。
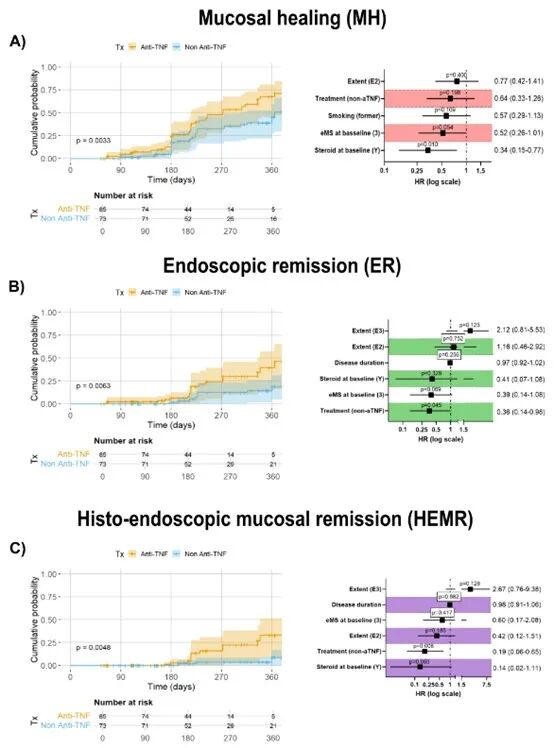
图2 在以内镜引导的治疗优化后,抗 TNF-α 组与非抗 TNF-α 组之间经 IPTW 调整的黏膜愈合(A)、内镜下缓解(B)和组织内镜下黏膜缓解(C)的累积概率比较
5.探索性三臂比较
通过结合真实世界数据与合成数据进行的探索性三臂比较分析,评估了三种不同类别生物制剂在内镜引导下治疗优化中的有效性差异。结果显示,在实现深度黏膜愈合方面,抗肿瘤坏死因子-α药物表现最佳,其中位1年累积黏膜愈合率为57.5%,内镜缓解率为30.7%,组织-内镜黏膜联合缓解率为25.9%。乌司奴单抗紧随其后,对应的缓解率分别为47.2%、27.0%和22.6%。而维得利珠单抗在所有终点上的疗效均显著偏低,三项指标分别仅为15.5%、6.2%和4.5%。
具体比较发现,抗TNF-α药物在所有终点上均显著优于维得利珠单抗。乌司奴单抗的疗效介于两者之间,虽不及抗TNF-α药物,但明显优于维得利珠单抗,不过其疗效估计值的变异范围较大。这一排序模式在黏膜愈合、内镜缓解和组织-内镜黏膜联合缓解三个层次上保持一致。
对于临床症状轻微但内镜下仍存在中重度炎症的UC患者,采用内镜引导下的生物制剂优化治疗策略具有临床可行性。研究显示抗TNF-α类药物在促进黏膜深层愈合方面优于其他生物制剂,而基线激素使用及内镜下重度炎症活动是影响疗效的主要负面因素。实现深度缓解与更持久的治疗维持相关,且该优化方案未显现新的安全性问题。这些发现为临床实践中面临"症状缓解-内镜未达标"困境时优先选择治疗优化而非更换药物机制提供了现实依据,凸显了以黏膜愈合为目标的达标治疗在UC管理中的重要价值。
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)