来源:ANeurology神经学
急性缺血性卒中的有效管理,关键在于及时开通闭塞的脑血管、恢复缺血性半暗带的灌注,并尽可能最小化梗死体积。目前,临床医生在诊疗过程中高度依赖多种影像学手段,以评估缺血性半暗带与核心梗死区的情况。然而,现有的影像技术常常难以精准地反映缺血所引发的细胞与组织病理学改变,并且缺乏标准化的评估准则。这种局限性极有可能导致诊疗决策出现不一致性,进而最终影响患者的预后。因此,改进现有的影像方法迫在眉睫,以便更精准地反映
2018年,DAWN试验与DEFUSE-3试验这两项重要的临床试验证实,基于影像学指导的筛选标准,不仅扩大了急性缺血性卒中患者接受血管内治疗(EVT)的适应症范围,还显著改善了患者的治疗结局。这一成果标志着卒中诊疗正式迈入“组织即大脑”时代,即通过直接影像学评估卒中发作后脑组织的活性,以此指导治疗决策。在急性缺血性卒中的治疗中,缺血性半暗带的挽救始终是EVT的核心目标。因此,在临床实践里,主要通过影像学检查来评估半暗带的范围,并将其作为诊断的重要金标准。
近期开展的六项试验结果显示,对于未经过半暗带筛选的大核心梗死患者,接受EVT后获得良好预后的比例,明显高于单纯接受药物治疗的患者组。SELECT-2试验的探索性分析进一步指出,影像学所显示的半暗带体积,并未对EVT的治疗效果产生影响。此外,大量文献资料表明,当前所采用的半暗带成像技术,可能无法精准捕捉到卒中后缺血性半暗带内广泛的病理生理变化,这些变化涵盖了能量代谢功能障碍、免疫炎症反应以及细胞毒性等多个方面。Goyal等人开展的关于“幽灵梗死核心”的研究(该研究指出,在短暂缺血后完全再灌注的情况下,基线CT 灌注(CT perfusion, CTP)可能会高估核心面积)进一步凸显了仅依赖传统成像技术来绘制具有生物学意义的半暗带的局限性。实际上,该区域更准确的定义应基于半暗带神经元内潜在的病理生理过程以及生物分子变化。这些研究共同表明,现有影像学技术与神经病理学之间的认知差距,可能远远超出了我们此前的预期,值得进行深入探究。
随着2018年两项关键EVT试验的完成,影像学定义的半暗带在科研与临床实践中的重要性日益凸显。在此背景下,我们简要概述影像学定义半暗带的相关概念与挑战,旨在为卒中防治策略提供新思路(图1)。
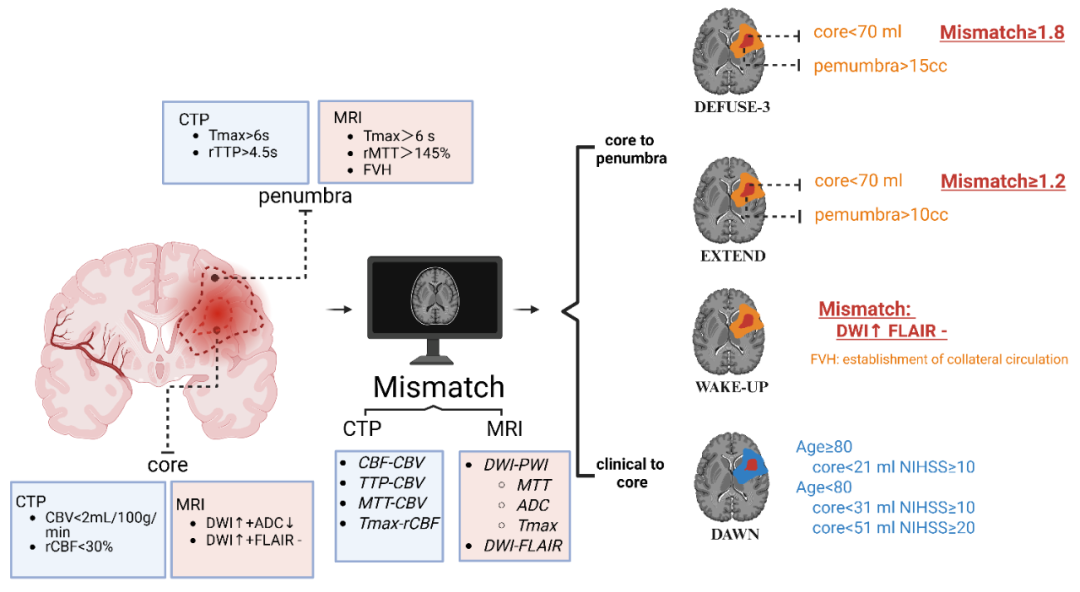
图1. 急性缺血性卒中“不匹配”(mismatch)选择标准的影像学定义
半影区是指围绕梗死核心的可逆性低灌注区域,其特征是电活动受损但细胞代谢和活力得以保留。然而,这种细胞活动并不一定意味着功能上的存活;如果没有及时的再灌注,半影区可能在1至2小时内进展为梗死。CTP 和 MRI 在定义急性缺血性卒中组织时间窗时所采用的“不匹配”(mismatch)及阈值法(threshold-based approach)已在临床上带来了显著益处,适用于静脉溶栓和EVT。然而,用于检测缺血半暗带的不同影像学技术各有优劣。
首先,在延迟时间窗(例如发病后6 - 24小时)内,由于扫描范围存在局限,CTP可能会低估梗死核心的体积;而在超早期时间窗中,对于快速实现再灌注的患者,CTP又可能高估基线梗死核心,这种现象被称为“幽灵梗死核心”。其次,尽管MRI的空间分辨率高于CT,但其临床应用受到仪器设备与操作条件的诸多限制,例如检查耗时较长、设备购置成本高昂以及图像处理过程复杂等。此外,DWI(弥散加权成像)/PWI(灌注加权成像)错配标准并不能全面反映缺血组织活性的异质性,因为其中可能包含可逆性的弥散受限病灶。第三,研究表明,缺血损伤的灌注阈值会因性别、年龄以及组织类型的不同而有所差异,这充分凸显了仅依赖单一影像特征,难以实现个体化、精准的半暗带评估。
自2022年以来,已有6项随机对照试验证实,即便存在大动脉前循环广泛梗死核心的患者,仍能从EVT中获得显著的临床获益。研究结果提示,EVT的治疗优势时间窗可能可延长至症状发作后的24小时,且适用于以下人群:仅由低ASPECTS评分(急性卒中
当脑部某一特定区域的血液流动受阻时,缺血核心指的是该区域中血流灌注受到最为严重限制的部分,此区域会迅速进展为不可逆的损伤区域。在发病后超过6小时的延迟时间窗内,当脑血流量相较于初始值下降幅度超过70%(而非30%)时,缺血组织便会发生梗死;另外,若与对侧半球相比,该区域的相对脑血流量低于30%,也可作为判定梗死发生的指标。
多项研究一致表明,在极为早期的时间窗内,通过CTP(计算机断层扫描灌注成像)预测得出的缺血核心体积,往往会高估实际不可逆性梗死的体积,这种现象被称作“幽灵梗死核心”。这里所说的缺血核心(ischemic core),是指在急性缺血性卒中的早期阶段,此时仅依据基线影像尚无法确定组织的最终命运。与之相对,“梗死”(infarction)指的是在随访影像(例如平扫CT,即NCCT,或弥散加权MRI,即DWI - MRI)中能够看到的、且经组织学证实的坏死组织。与此同时,基线时确定的缺血核心是否会进展为梗死,以及进展的程度如何,只能通过后续的事后追踪来进行判断。
在缺血性卒中的病理学范畴内,已经识别出两种不同类型的细胞死亡模式:全坏死(pan - necrosis)和不完全梗死(incomplete infarction)。全坏死是指所有类型的细胞,包括神经元、小胶质细胞、星形胶质细胞以及内皮细胞,均发生坏死;从形态学角度看,这种表现在临床上通常被称为基线影像中的“缺血核心”,而在随访影像上则表现为“梗死”。相比之下,“不完全梗死”用于描述坏死灶与存活组织相互交错分布的区域。尽管这种对影像学表现的解释已被广泛接受,但目前仍无法确定其是否能够完全反映潜在的病理变化。
明确界定组织状态(如缺血核心或半暗带)的目的,在于对缺血脑组织进行精准量化,进而实现更为精准的治疗决策。然而,这种“教条式”的界定方法由于过度简化,反而可能遗漏关键信息。例如,基线影像上所定义的缺血核心(即严重缺血区域)向实际梗死状态的转变,是一个非线性且极为复杂的过程。不同类型的细胞在进展为梗死时存在显著差异——举例来说,在某些区域,神经元可能已遭受严重损伤,而星形胶质细胞却仅出现轻微损害——并且这一过程在时间和空间维度上均具有高度可变性。当依据“100%或0%梗死概率”的二元阈值对组织状态进行分类时,其精确度实际上已超出了现有数据所能支撑的范围。这种做法不仅无法充分反映组织病理学的复杂性,还忽视了多因素在不同脑区和时间点对组织最终结局所产生的影响。此外,还有一些额外因素也会影响缺血核心的动态变化,具体包括:缺血预处理(如使用神经保护剂或进行低温治疗)、梗死部位(例如白质梗死常与白质疏松症的加重相关)、血管闭塞程度以及再灌注与再通情况等。这些因素共同构成了缺血性
随着对大面积梗死核心研究的不断深入,学界逐渐达成共识:宏观且静态的神经影像学方法已难以满足扩大治疗适用人群和提升治疗效果的需求。因此,对影像学所定义的缺血半暗带的评估,必须结合分子生物学方法。要深化对缺血半暗带的理解,就需要识别出能够反映神经损伤与修复过程的典型影像学及生物学标志物。将生物代谢分析与影像学指标相结合,有望构建一个统一的影像‑生物学框架,用于指导诊断和治疗决策。通过这种综合方法,可以显著改善急性缺血性卒中患者的功能预后。


总结与展望
目前,急性缺血性卒中的治疗理念正经历着从传统时间窗概念向更为精准的基于组织状态治疗模式的深刻转变。这一转变充分凸显了影像学在精准识别可挽救脑组织方面的核心地位与关键作用。然而,现有的影像学技术仍面临着诸多严峻挑战:它们常常难以全面、充分地反映脑细胞内部错综复杂的病理与生理变化,也难以深入揭示不同脑细胞在治疗过程中所呈现出的异质性反应。这直接导致在定义缺血半暗带和梗死核心时,出现了概念界定模糊、评估标准不统一等一系列问题。
本文针对上述问题展开了深入的批判性分析,并创新性地构建了一种多维度评估体系。该体系巧妙地将定量影像特征与分子及病理标志物有机融合,旨在显著提升卒中病灶诊断的精准度,进而有效克服现有影像学方法存在的局限性。未来的研究应着重聚焦于多模态影像技术的深入挖掘与探索,以及生物标志物数据的系统整合与严谨验证。通过构建一个融合影像学与生物标志物的统一框架,能够为急性缺血性卒中的精准化与个体化治疗筑牢坚实基础。这种综合策略不仅有望优化临床决策流程,改善患者的预后情况,还将为当前急性缺血性卒中管理中所面临的关键难题提供全新的解决思路与方向。


基金支持
本工作得到了重庆市“科技–卫生”联合重大医疗卫生科技创新四大专项(2023GGXM007)、国家科技部重大专项(2024ZD0527900)和国家自然科学基金(82090040)的支持。
引用本文:Wang L, Guo C, Yang Q. Unveiling the complexity of acute ischemic stroke through imaging and neuropathological insights. Adv Neurol.
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)