

前言
过去20年间,肺癌领域基础研究的持续突破与临床转化,彻底重塑了肺癌的诊疗格局。从疾病病因机制的深度解析,到筛查、诊断、治疗技术的全方位革新,基础科学的每一项突破都旨在为患者带来确切的生存获益,推动肺癌逐步实现从“难治绝症”到“精准可控”的转型。

肺癌治疗时间线(2000-2025年)

流行病学:疾病谱的结构性重塑

肺癌的整体发病率呈逐步下降趋势。这一变化与人群吸烟习惯的改善密切相关,同时也推动了肺癌疾病谱的结构性改变:女性患者及不吸烟人群的占比显著上升,病理类型以肺腺癌为主。低剂量螺旋CT(LDCT)筛查的广泛普及,有效实现了肺癌诊断阶段的前移,使更多患者在疾病早期得以确诊,大幅提升了临床治愈率。

病因溯源:环境暴露与遗传易感的双重奏

吸烟(首要元凶): 吸烟仍是肺癌发病的首要致癌因素。全球吸烟人群超10亿,基因组学分析证实,烟草烟雾可诱导肺癌发生独特的基因突变谱,且吸烟者肺癌组织的基因突变数量远高于不吸烟人群
空气污染(隐形杀手):2013年,国际癌症研究机构(IARC)已将室外空气污染及细颗粒物列为肺癌已知致癌物,这类环境暴露可在不吸烟人群中诱发特异性基因突变。氡气作为室内常见致癌物,其风险评估模型经国际矿工研究(PUMA)更新验证,为氡气暴露相关肺癌的防控工作提供了坚实的循证医学依据。
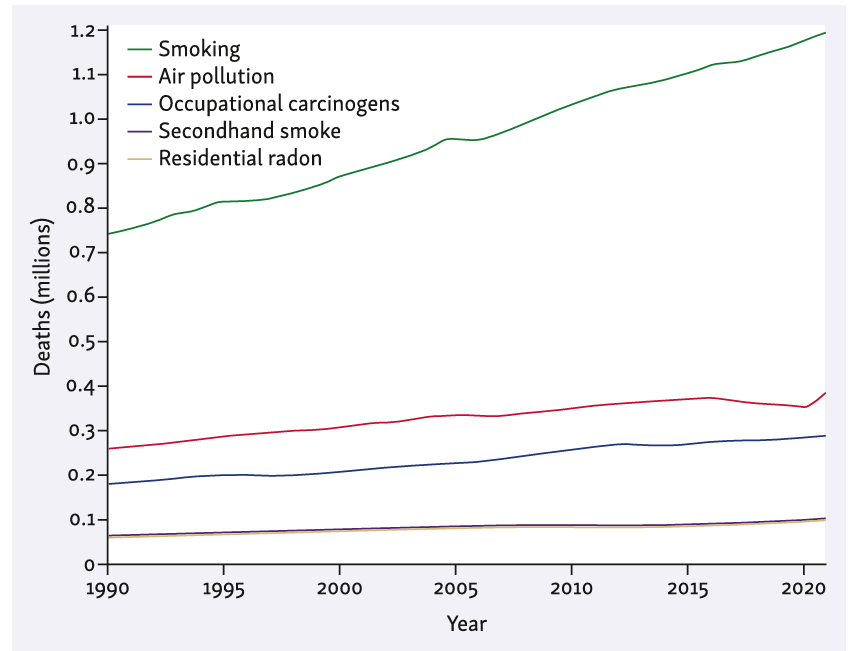
1990年至2021年,按风险因素
尽管烟草烟雾暴露或环境污染物接触是肺癌发生的主要诱因,但遗传因素在肺癌的发病进程中同样发挥着关键作用。
家族聚集性与高风险基因鉴定
系统综述研究证实,肺癌患者一级亲属的患病风险升高85%,这一数据明确了遗传因素在肺癌发病中的关键作用。目前已发现TP53、RB1等罕见胚系突变与肺癌高发病风险密切相关,其中EGFR T790M胚系突变在不吸烟人群中引发肺癌的风险尤为显著。此外,HER2、MET、PRKN、ATM等基因的罕见变异,也被证实可显著增加个体的肺癌患病风险。
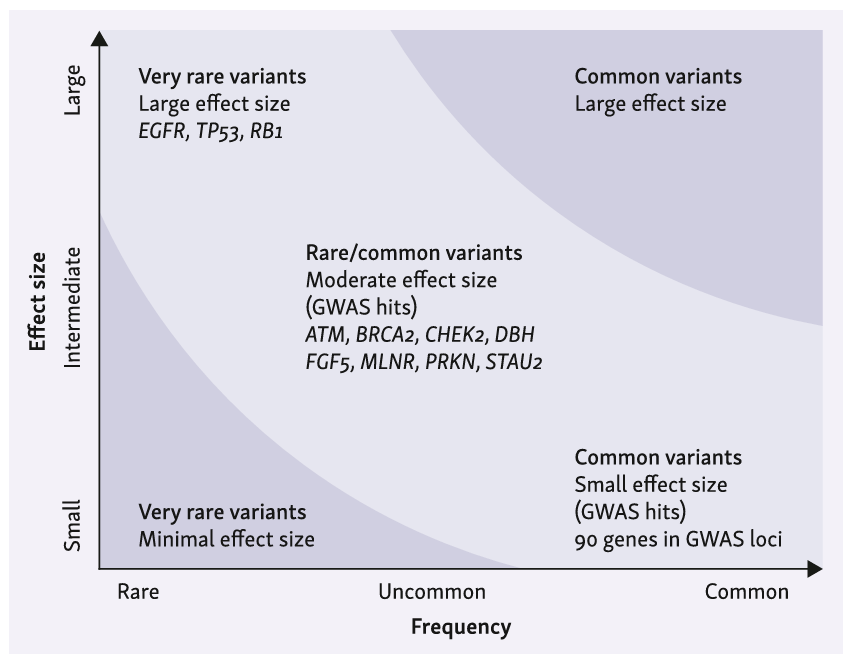
肺癌的遗传易感性和遗传结构
肺癌遗传风险因素的等位基因频率与效应大小之间呈负相关
全基因组关联研究
全基因组关联研究(GWAS)已识别出大量肺癌易感相关单核苷酸多态性(SNP)。其中CHRNA5、CYP2A6基因的SNP位点不仅与肺癌发病风险相关,还与人群吸烟行为及戒烟难度密切关联。同时,GWAS研究进一步揭示了端粒维持、DNA损伤修复、免疫监视等多条与肺癌发病相关的关键通路。基于多SNP位点构建的多基因风险评分模型,可精准筛选肺癌高风险人群,为优化肺癌筛查的准入标准提供了重要参考。
高风险人群筛查策略优化
携带TP53、RB1等高危胚系突变的人群是肺癌筛查的重点对象。其中TP53突变携带者因对电离辐射高度敏感,临床推荐采用

筛查与早诊:从争议走向共识

2005年至2010年间,受困于假阳性率、过度诊断及辐射暴露风险等问题的掣肘,低剂量CT(LDCT)的临床推广与应用一度陷入低潮。2011年,美国国家肺癌筛查试验(NLST)证实,LDCT筛查可使肺癌死亡率降低20%。欧洲NELSON试验进一步验证了该技术的筛查价值,尤其在女性人群中,肺癌死亡率降幅达33%,这两项里程碑式研究确立了LDCT在肺癌筛查中的核心地位。
筛查人群的准入标准也在持续优化,从最初限定的55-74岁、累计吸烟≥30包年人群,逐步扩展至50-80岁、累计吸烟≥20包年的群体。2023年,美国癌症协会(ACS)发布的指南进一步取消了15年的戒烟时限要求,让更多肺癌高风险人群纳入筛查范畴。
2005年至2025年间,LDCT筛查完成了从争议到共识的跨越。当前,其核心挑战已转向落地实施层面——即如何在确保循证筛查覆盖高危人群的同时,维持项目的高质量与低风险,并动态整合结节管理与风险评估的最新进展。此外,未来的另一大挑战在于如何结合影像筛查与生物标志物,精准识别高危非吸烟人群,特别是二手烟暴露者及特定亚群(如具有EGFR突变家族史的亚洲非吸烟女性)。

精准医疗:基因组学驱动的靶向革命

过去20年间,肺癌诊疗领域完成了从单纯病理分型向分子分型指导精准治疗的跨越式发展。目前已发现EGFR、ALK、ROS1、KRAS G12C等一系列具有临床价值的驱动基因,约64%的肺腺癌患者可检测到潜在可靶向的驱动靶点。肺癌突变联盟(LCMC)系列研究的开展,不仅标准化了多中心、多基因联合检测的操作流程,更明确了不同驱动基因亚型肺癌的临床特征及预后关联性,为靶向治疗的广泛普及奠定了坚实的循证医学基础。
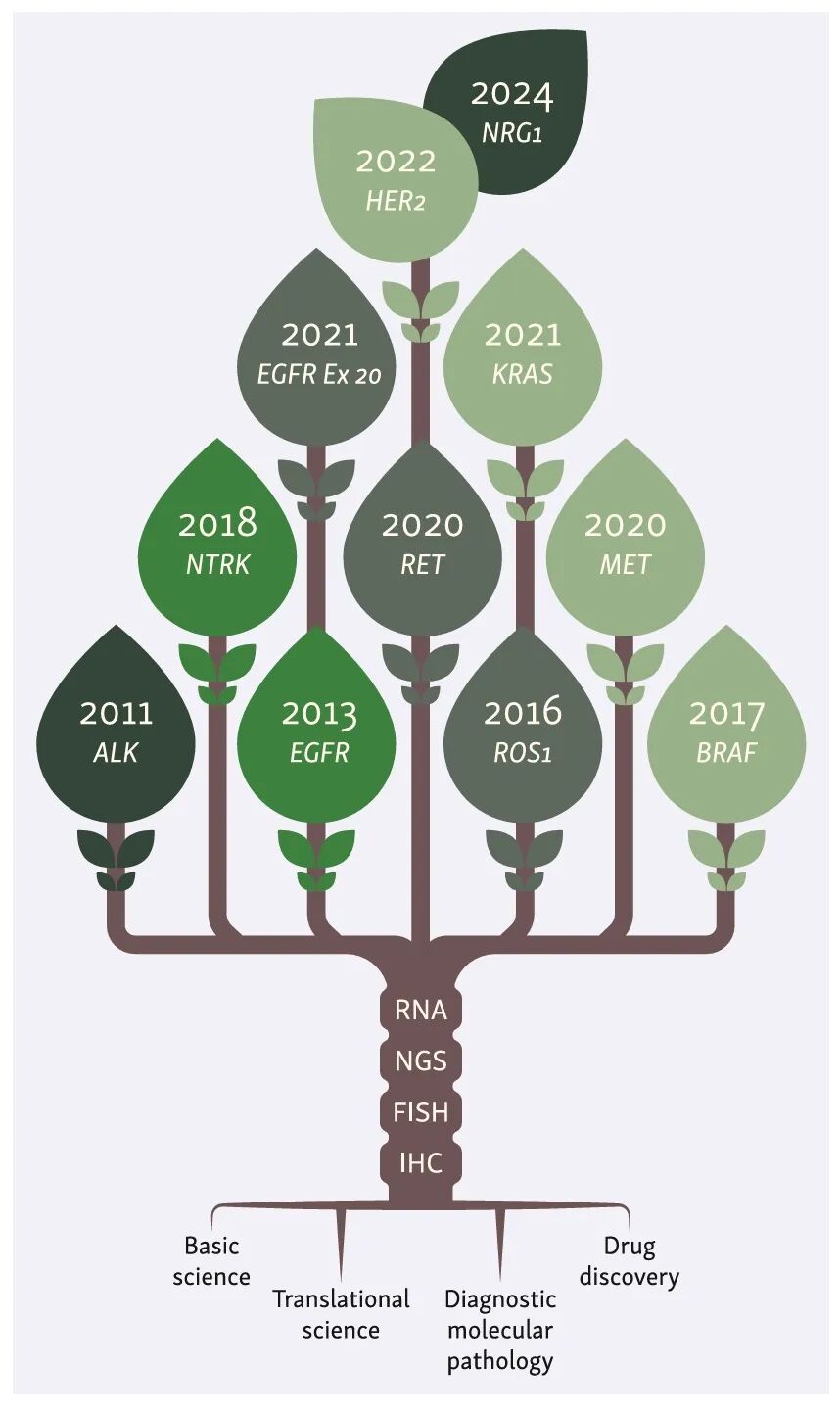
二十年肺腺癌靶向诊疗全景
分支示靶点,叶子示药物,年份标示该靶点首药获批时间
EGFR-TKI:不断进化的标杆
在靶向药物研发进程中,EGFR酪氨酸激酶抑制剂(EGFR-TKI)始终引领行业发展方向。从第一代药物
动态博弈:耐药与反制
在耐药机制应对层面,通过液体活检技术动态监测耐药突变(如EGFR C797S突变、ALK复合突变),已成为临床常规诊疗手段。基于耐药突变谱的解析,双特异性抗体、第四代TKIs等下一代靶向药物的研发持续推进,逐步构建起“检测-治疗-再检测-再治疗”的全周期精准诊疗闭环。

放射肿瘤学:更精准、更高效

立体定向体部放疗(SBRT)已从早期试验性技术,逐步发展为不可手术的I期
局部晚期NSCLC的放疗策略也在持续优化。在剂量与技术调整层面,RTOG 0617试验证实,60Gy标准剂量同步放化疗的疗效优于74Gy高剂量方案,有效规避了过度放疗带来的生存损害。调强放疗(IMRT)技术凭借对正常组织的精准保护,可显著降低心肺毒性,已成为同步放化疗的优选放疗技术。在靶区定位层面,PET-Plan试验验证了FDG-PET引导的靶区缩小策略的非劣效性。该策略不会增加治疗相关毒性,推动了选择性淋巴结照射技术的临床应用。此外,PACIFIC试验确立了放疗后序贯免疫巩固治疗的方案,可显著延长局部晚期NSCLC患者的无进展生存期(PFS)与总生存期(OS),且这一获益在真实世界临床队列中得到进一步验证。

小细胞肺癌:打破三十年沉寂

小细胞肺癌(SCLC)的治疗在过去十余年间进展相对有限,顺铂或卡铂联合依托泊苷方案长期作为广泛期患者的一线标准治疗方案。拓扑替康则是唯一获批用于复发患者的治疗药物。预防性脑照射是降低脑转移风险的重要手段。而免疫治疗的问世,彻底改变了SCLC的传统治疗格局,为该疾病的治疗带来了革命性突破。尽管免疫检查点抑制剂对中位生存期的延长幅度有限,但其首次实现了持久应答,甚至使少数转移性患者达到了临床治愈,这无疑是一个关键的里程碑。随后,免疫疗法重塑了临床标准治疗,通过根治性放化疗后的度伐利尤单抗维持治疗,改善了局限期患者的生存状况。
在复发性疾病治疗方面,烷化剂芦比替定因其毒性表现优于历史对照药物拓扑替康,获得了FDA加速批准;此外,近期数据显示,PD-L1抑制剂阿替利珠单抗联合芦比替定一线维持治疗广泛期SCLC,也能显著改善患者生存。此外,靶向DLL3的T细胞衔接器塔拉妥单抗也获加速批准用于复发性疾病,且已被证实较化疗能显著延长生存期。
目前,多种极具潜力的新药正处于积极研发阶段,旨在造福小细胞肺癌患者;其中,抗体偶联药物(ADC)及其他新型靶向疗法的临床试验已取得了令人振奋的初步成果。

免疫治疗:重塑治疗版图

2000年代中期,免疫检查点抑制剂能否治疗胸部肿瘤还仅仅是一个猜想。直到随机试验带来的首个突破,证实了在既往接受过治疗的非小细胞肺癌(NSCLC)患者中,PD-1/PD-L1阻断疗法表现优于化疗。
紧接着,PD-1/PD-L1抑制剂凭借强有力的证据,成为了PD-L1高表达患者一线治疗的新标准。随后,无论PD-L1状态如何,‘免疫+化疗’的组合拳都让患者获益,且这种获益跨越了不同的组织学类型。
在局部晚期NSCLC领域,放化疗后序贯免疫治疗树立了新标杆,也为早期肺癌的干预铺平了道路。在可切除肺癌中,无论是术前新辅助、术后辅助还是围手术期治疗,免疫疗法都持续刷新着病理缓解和生存期记录。虽然PD-L1阳性肿瘤效果更好,但在阴性肿瘤中同样有效,说明其适用范围非常广泛。
当然,挑战依然存在。 对于携带驱动基因突变的患者,免疫治疗效果有限;对于无吸烟史的患者,甚至可能面临更高的早期进展风险,因此筛选患者必须谨慎。好在,单细胞分析、空间技术以及ctDNA微小残留病灶(MRD)监测等先进技术,正在帮助医生更精准地分层患者、破解耐药难题。
到2026年,免疫疗法预计将全面融入NSCLC的治疗版图。未来的研究将聚焦于‘强强联合’——即免疫疗法与ADC药物、靶向疗法及新一代免疫调节剂的组合,力求为每一类分子亚群的患者找到最优解。

液体活检:捕捉血液中的蛛丝马迹

肿瘤基因分型应用
2006年,研究人员首次报道可从ctDNA中检测到EGFR基因突变,开启了ctDNA在肺癌基因分型中的应用篇章。2016年,美国食品药品监督管理局(FDA)批准首款血浆ctDNA伴随诊断试剂盒。2020年又有两款血浆二代测序(NGS)试剂盒相继获批,推动ctDNA检测逐步走向标准化与临床普及。该技术可快速、精准检测肺癌驱动基因突变及耐药突变(如EGFR T790M),为靶向治疗、免疫治疗的方案选择与动态调整提供关键决策依据。
微小残留病(MRD)监测
2017年,肿瘤特异性ctDNA检测技术实现对MRD的精准识别,其核心优势在于可提前4-6个月预测肿瘤复发,且这一预后评估价值已被多项临床研究证实。目前,MRD状态已成为指导术后治疗策略升级或降级的重要参考指标,相关前瞻性临床试验正持续推进,旨在进一步验证其临床效用。
此外,脑脊液、尿液、胸腔积液等体液中ctDNA的检测技术也处于探索阶段,需通过更大样本量的临床研究验证其稳定性与可靠性,方可逐步应用于临床实践。
除ctDNA外,循环肿瘤细胞(CTCs)、循环肿瘤RNA(ctRNA)、细胞外囊泡、肿瘤诱导的血小板(TEPs)等新型循环生物标志物的临床应用潜力正逐步被挖掘,但受检测技术成熟度、临床证据充分性等因素限制,尚未实现广泛临床普及。

外科治疗演进:微创与保肺并重

肺癌TNM分期系统的迭代升级,为外科治疗策略的制定提供了精准的预后分层依据。
第七版(2009版):细化肿瘤原发灶(T)分期的临界值界定,统一纵隔淋巴结分区图谱,优化临床分期的分组标准,提升分期与预后的关联性。
第八版(2017版):以1cm为增量对T1、T2期进行精细化分层,明确多发肺部结节的分类原则,同时将远处转移(M1)进一步划分为单器官转移(M1b)与多器官转移(M1c)亚型,增强分期的临床指导价值。
第九版(2025版):针对区域淋巴结(N)及远处转移(M)分类进行更深层次的细化,进一步提升预后分层的准确性。
胸腔镜肺叶切除术已逐步取代传统开胸手术,成为肺癌外科治疗的主流术式,其创伤更小、术后并发症更少、患者康复周期更短的优势显著。在此基础上,单孔胸腔镜技术与机器人辅助胸腔镜手术(RATS)持续发展,其中RATS凭借操作灵活度高、视野清晰、手术精度高等独特优势,临床应用范围正逐步扩大。
肺保留手术的应用也日益成熟,该术式可最大限度保留患者肺功能,显著降低术后并发症发生率,使合并基础疾病、高体重指数的早期肺癌患者也能获得根治性手术机会。JCOG0802、CALGB 140503等临床试验证实,对于≤2cm的外周型早期肺癌,行解剖性肺段切除术的疗效与肺叶切除术非劣效,且能保留更多肺功能,目前已成为该类患者的标准术式。ICG荧光成像、三维CT重建等技术的辅助应用,进一步提升了复杂肺段切除手术的精准性与安全性。
免疫治疗已全面重塑可切除NSCLC的治疗模式,多项里程碑研究确立了三大治疗路径:
新辅助治疗: CheckMate-816推动了可切除NSCLC围手术期治疗模式的现代化变革。该研究证实,术前纳武利尤单抗联合化疗显著提升了病理完全缓解率(pCR),并带来约10%的5年OS绝对获益。
围手术期治疗: KEYNOTE-671与 AEGEAN研究验证了“术前新辅助+术后辅助”的“三明治”模式,均证实能显著改善EFS及OS,强化了全程管理的价值。
辅助治疗: IMpower010 确立了阿替利珠单抗在PD-L1阳性人群中的DFS获益;KEYNOTE-091 则证实帕博利珠单抗可为全人群带来DFS改善,打破了PD-L1表达的限制,拓展了免疫治疗的应用范围。

小结

参考文献:Carbone M, Amos C, et al. Advances in the Basic Sciences in Thoracic Oncology in the Last 20 Years and Their Translational Impact. J Thorac Oncol. 2026 Jan;21(1):41-76.
撰写:Kenken
审校:Faline
排版:Kenken
执行:Faline
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)