综述与讲座
胰腺腺鳞癌研究进展
简美诚 边云
海军军医大学第一附属医院放射诊断科,上海 200433
通信作者:边云
来源:中华胰腺病杂志
提 要
胰腺腺鳞癌(PASC)是
全文阅读
根据世界卫生组织的分类,胰腺癌可细分为多种类型,包括占比约90%的胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)和占比仅为1%~4%的胰腺腺鳞癌(pancreatic adenosquamous carcinoma, PASC)。PASC是一种特殊的胰腺癌亚型,其特点在于肿瘤中至少包含30%的恶性
一、组织起源
胰腺肿瘤中鳞状成分的起源是当前研究的重要领域,原因在于正常胰腺组织中不存在鳞状上皮。针对这一现象,学界主要提出了两种主流理论:第一,鳞状上皮组织转化理论。该理论认为鳞癌成分是从腺癌成分演变而来。在
此外,还存在一种较少被接受的碰撞理论,认为鳞状成分和腺癌成分在胰腺中独立出现并连接融合。尽管目前对于鳞状细胞成分的起源尚缺乏明确的认识,但未来的研究有望揭示其起源及生物学机制,为这一领域提供新见解。
二、遗传特征
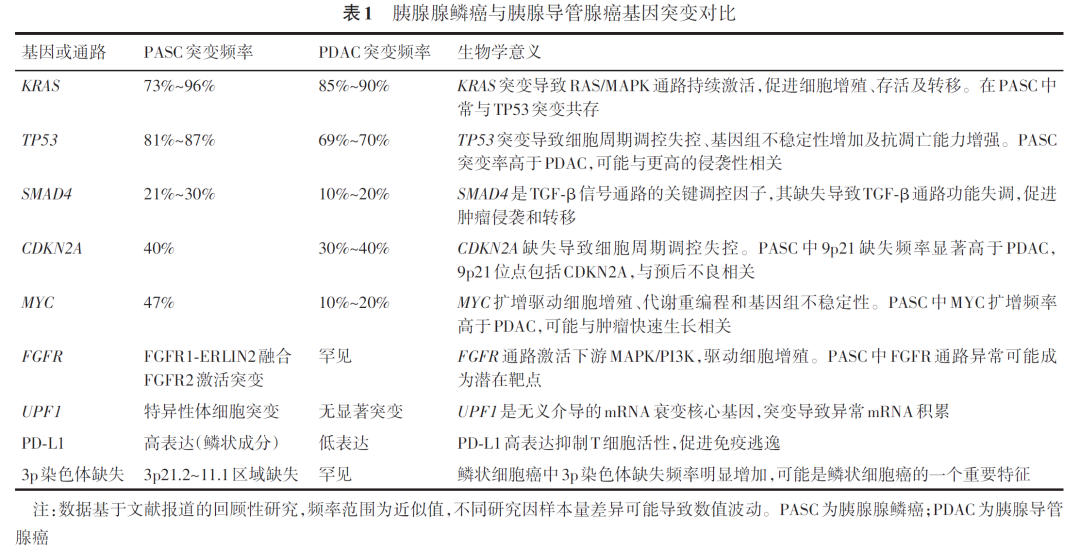
1.常见基因突变:研究揭示,PASC中存在一系列与PDAC相似的基因变异,包括CDKN2A、SMAD4缺失,KRAS、TP53突变,MYC扩增等。其中KRAS、TP53、SMAD4的变异最为常见。值得注意的是,PASC的TP53突变频率高于PDAC,且经常与KRAS突变并存,这表明突变的p53信号通路在PASC的发展过程中扮演着重要角色。通过构建基因工程小鼠模型,Yang等发现p53和SMAD4或p53和TGFBR2的缺失,即使在没有KRAS突变的情况下,也能诱发小鼠自发形成胰腺肿瘤,特别是Trp53/Smad4缺失且KRAS为野生型(KRAS⁃WT)的胰腺肿瘤,展现出了PASC特有的组织学特征,进一步证实了p53和SMAD4在PASC发展中的关键作用。
2.异质性基因突变:相较于PDAC,PASC展现出了独特的基因组图谱。Lenkiewicz等利用全外显子组测序技术发现了PASC特有的异质性基因变异,如SMARCA2、ARID2和ASXL2的纯合子缺失,以及TET1、MSL2和KANSL1等表观遗传调控因子的突变。此外,还观察到TLK2、ASH2L、MPL和FRS2基因的扩增,以及FGFR2(A322G)激活突变和FGFR1⁃ERLIN2融合突变。这些变异均能激活FGFR/FRS2信号通路,为靶向治疗提供了新的潜在靶点。Ma等对PASC患者的肿瘤组织和癌旁组织进行了全外显子组测序,发现了包括MAP3K1、PDE4DIP和BCR的种系突变,以及TP53、KRAS、HRNR和OBSCN的体细胞突变,并且发现KRAS、OBSCN、HRNR、USP6的突变与PASC的侵袭和转移紧密相关。Liu等对PASC患者进行了无义介导的mRNA衰变(nonsense⁃mediated mRNA decay, NMD)相关基因突变筛查,发现大多数患者都携带UPF1基因的体细胞获得性突变。UPF1编码一种RNA螺旋酶,对NMD这一高度保守的RNA降解途径至关重要。在PASC中,特异性UPF1突变改变了其RNA剪接,干扰了NMD,导致NMD底物的mRNA水平上调。值得注意的是,在非PASC胰腺肿瘤和肺鳞状细胞癌样本中均未检测到UPF1突变,表明UPF1突变可能是PASC的一个独特标志。此外,Zhang等的研究显示,PASC中程序性死亡配体1(programmed death⁃ligand 1, PD⁃L1)表达水平高于PDAC,且PD⁃L1的高表达与较短的总体生存期相关。Kania等的研究发现,与PDAC相比,PASC中PD⁃L1及免疫相关基因表达更高,包括CDKN1B、SF3B1、PTEN、BCL9、AXIN1、CASP8的突变率,以及AKT2、ZNF384、HMGA2的扩增率均高于PDAC;同时,PASC的高度微卫星不稳定性(microsatellite instability⁃high, MSI⁃H)和高肿瘤突变负荷(tumor mutation burden⁃high, TMB⁃H)的趋势也更加明显。
3.
4.细胞异质性与肿瘤微环境:肿瘤微环境以及细胞间的相互作用在PASC的发展和治疗反应中同样至关重要。Zhao等对PASC进行了单细胞RNA测序分析,发现PASC中的细胞主要包括癌细胞、髓系细胞、成纤维细胞和T细胞,其中,一个癌细胞亚群(C1)展现出了干细胞样的特征;与正常胰腺组织相比,PASC中LGALS1、NPM1、RACK1、PERP等基因表达上调,同时髓系细胞中EREG、FCGR2A、CCL4L2、CTSC基因表达增加,可能共同参与了肿瘤免疫微环境中的炎症反应、免疫细胞调节和免疫逃逸机制。此外,癌症相关成纤维细胞在免疫抑制途径中的基因表达模式富集,进一步暗示了它们在肿瘤免疫逃逸中的作用。该研究还发现,表皮生长因子受体(epidermal growth factor receptor, EGFR)相关的配体⁃受体对(例如EGFR/TGFB1)在癌细胞与基质细胞的通讯中被激活,通过诸如双调节蛋白(amphiregulin, AREG)等激活成纤维细胞和髓系细胞,进而形成促进正常导管细胞向癌细胞恶性转化的EGFR相关正反馈循环,加剧了PASC的恶性程度。因此,针对肿瘤微环境的治疗策略有望提高PASC的治疗效果。Kania等的研究进一步证实,与PDAC相比,PASC的肿瘤微环境表现出更高的PD⁃L1表达、更高的MSI⁃H和TMB⁃H发生率、更多的CD4+ T细胞浸润以及更高的免疫相关基因表达。这些特征表明PASC可能具有更活跃的免疫反应,与其免疫逃逸机制密切相关。Yang等在小鼠模型中也观察到了PASC中PD⁃L1的表达水平高于PDAC,且PASC肿瘤组织中有较高比例的效应T细胞和CD8+ T细胞,以及具有免疫刺激性功能的髓系细胞亚群,这些可能与肿瘤对免疫检查点抑制剂治疗的敏感性有关。
总体而言,PASC与PDAC在基因突变谱上既有重叠也有显著差异(表1)。共同突变提示两者可能共享部分致癌通路,而PASC的独特变异则可能解释其更具侵袭性的生物学行为。但由于PASC的罕见性,目前对其遗传学特征的深入了解仍然有限。
三、诊断方法
由于临床表现相似,PASC在术前常被误诊为PDAC。目前,对PASC的确诊主要依赖于临床表现、实验室检查、放射学检查以及
1.临床表现与实验室检查:PASC患者的平均确诊年龄约为66岁,男性患者略多于女性,且胰头部位的发病率显著高于其他部位。PASC典型症状包括腹痛、阻塞性
2.影像学特征与诊断技术:影像学上,PASC的CT和MRI通常表现为边界不清、缺乏血供的肿块,常伴有周围环状增强和一个广泛坏死的中心低度强化区域。与PDAC相比,PASC的肿瘤中心坏死范围更广。环状增强是PASC的一个显著特征,其在MRI上的表现尤为明显,当CT和MRI同时出现这一特征时,应高度怀疑为PASC。此外,18F⁃氟脱氧
3.病理表现与确诊依据:PASC的病理学特征通常表现为圆形分叶状肿块,伴有囊性成分和纤维组织包裹,与PDAC相比,其肿瘤体积往往更大,且位于体尾部比例更多。镜下观察可见腺癌组织和鳞癌组织混合存在,其中鳞状成分至少占30%,这有助于将其与PDAC中偶尔出现的小鳞状分化灶区分开来。腺癌部分形成腺体或腺体结构,而鳞状细胞癌部分则具有明显的细胞间桥和(或)局部角质剥脱等特征。免疫组织化学分析显示,PASC常表现为p63和细胞角蛋白5/6阳性表达,部分病例还可能出现TP53染色阳性和Dpc4蛋白缺失。在分子标志物方面,腺癌部分表达典型的PDAC标记,而鳞状细胞癌部分则表达与其他器官鳞状细胞癌相同的免疫表型。此外,部分PASC患者可能伴有分化较差的
四、治疗策略
相较于PDAC,PASC患者的肿瘤分化程度更低,血管淋巴和神经周围浸润更为频繁,因此其恶性程度更高,预后相对较差。
1.手术治疗的核心地位:目前,PASC的治疗方法与PDAC相似,首选方法依然是局部控制和积极切除[。针对PASC,常见的手术切除方式包括胰十二指肠切除术、胰腺远端切除术以及全胰腺切除术,其中胰十二指肠切除术应用最为广泛。多项研究表明,手术切除能显著提高PASC患者的生存率,尤其是对于能够实现R0切除的患者而言,手术是最佳选择。梅奥诊所的数据进一步显示,即使接受R1切除术,PASC患者的生存率也高于未接受手术的患者。部分研究指出,PASC患者的术后中位生存期可达到12个月。尽管PDAC和PASC患者均能从手术切除中获益,但PASC患者的术后中位生存时间仍短于PDAC患者。
淋巴结转移是胰腺癌常见的进展途径,而PASC淋巴结转移率显著高于PDAC。Ren等的研究发现,接受淋巴结清扫数目>15枚的患者,其中位总生存期显著延长,约为21个月,而清扫数目≤15枚的患者中位总生存期约为10个月。
2.辅助治疗的多样化选择:除手术治疗外,PASC患者还可能从多种辅助治疗中获益,包括化疗、放化疗、靶向治疗、免疫治疗以及综合疗法。
在转移性胰腺癌的治疗中,FOLFIRINOX方案(含
此外,辅助放化疗在PASC的治疗中也展现出了显著的优势。一项基于SEER数据库的回顾性分析显示,同时应用放疗和化疗的辅助放化疗能够显著提高患者的总生存期,其中位总生存期达到23个月,明显优于只接受化疗或只接受放疗的患者。在Lv等的研究中,区域性PASC患者接受综合治疗(包括手术、辅助化疗和辅助放疗)的中位总生存期可以达到31个月,这一结果明显优于仅接受辅助化疗的术后患者。
近年来,新辅助化疗在非转移性胰腺癌患者中的应用越来越多,主要方案包括吉西他滨为主的多药联合、FOLFIRINOX等。对于局部晚期或交界性可切除的PASC患者,新辅助化疗通过缩小原发肿瘤体积、降低局部侵犯程度,可将部分初始不可切除肿瘤转化为可切除。研究显示,非转移性PASC患者接受新辅助治疗效果明显优于仅进行化疗或仅接受手术的患者,新辅助化疗组的中位生存期为19.6个月,而仅手术组为7.2个月,仅化疗组为9.2个月。对于许多因术后并发症而未能接受辅助治疗的患者而言,新辅助治疗有助于确保患者能够接受完整的治疗计划。此外,转化治疗通过多模式干预(如化疗联合放疗),可进一步改善肿瘤生物学行为,为手术创造更有利的条件。有研究报道1例66岁交界性可切除PASC患者,在接受术前2个疗程的吉西他滨化疗和随后的S⁃1、吉西他滨联合治疗,持续13个月后,达到病理完全缓解,术后未进行辅助化疗,其无复发生存期超过66个月。
靶向及免疫疗法作为前景广阔的治疗选择,正逐渐受到关注。EGFR在PASC患者中高表达,可能使EGFR抑制剂在PASC中有效,但多数胰腺癌患者中存在KRAS突变,抑制KRAS上游的EGFR治疗效果可能欠佳。成纤维细胞生长因子受体1(fibroblast growth factor receptor, FGFR1)和FGFR2在胰腺癌中的表达升高与肿瘤的晚期和较短的生存期相关。在PASC的临床前模型中,发现FGFR1⁃ERLIN2融合的患者对FGFR抑制剂infigratinib显示出治疗敏感性。受限于胰腺癌免疫抑制性肿瘤微环境,细胞毒性T淋巴细胞相关蛋白4(cytotoxic T lymphocytes associated antigen 4, CTLA4)和PD⁃1/PD⁃L1作为经典的免疫检查点,在胰腺癌中治疗效果欠佳。虽然PASC中的鳞状细胞癌高表达PD⁃L1,可能对免疫检查点抑制剂特别敏感,然而整个肿瘤的PD⁃L1表达普遍较低,疗效可能受限于肿瘤中PD⁃L1高表达的细胞比例。
综上所述,PASC是一种罕见且恶性程度高的胰腺癌亚型,以腺癌与鳞癌混合(鳞状成分≥30%)、高频TP53突变、FGFR通路异常及鳞癌PD⁃L1高表达等为特征,影像学表现常为环状强化伴广泛中心坏死,相较于PDAC具有更强的侵袭性,然其对含铂化疗方案及免疫检查点抑制剂展现出更高的潜在敏感性。近年来的研究对PASC中鳞状组织起源、关键分子标志物及复杂基因组特征进行了深入探索,取得了显著进展,进一步促进了对这一罕见癌症的认知,并为开发针对性的创新治疗方法奠定了基础。然而,由于PASC的低发病率,研究中仍存在诊断准确性不足、治疗策略有限等问题。未来研究需聚焦于早期诊断技术的开发、分子分型研究的深入、多学科综合治疗策略的探索等,以突破当前局限,加速PASC研究的进展,改善PASC患者的预后和生活质量。
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)