现行治疗指南推荐非甾体抗炎药(NSAIDs)作为 AS 的一线治疗药物,对于 NSAIDs 反应不足的患者,推荐使用生物改善病情抗风湿药(bDMARDs),包括肿瘤坏死因子抑制剂(TNFi)和白细胞介素-17(IL-17)抑制剂等。然而,现有疗法对部分患者仍未能实现持续的疾病控制,急需能提供更大便利性和依从性优势的口服疗法作为替代治疗方案。
Janus 激酶(JAK)抑制剂通过靶向炎症通路,已作为一种极具前景的 AS 口服疗法出现。


本研究为一项在中国 51 个中心进行的随机、双盲、安慰剂对照、适应性无缝 II/III 期试验。共分为两个阶段: II 期(第 1 阶段)和 III 期(第 2 阶段)。整个实验流程均包括 4 周筛选期、12 周核心治疗期、12 周扩展期和 4 周安全随访期。
第 1 阶段:评估艾玛昔替尼三种剂量(2、4 和 8 mg)疗效与安全性以确立最佳剂量。
第 2 阶段:进一步评估艾玛昔替尼推荐剂量的疗效和安全性。
中期分析:独立数据监察委员会(IDMC)基于第 1 阶段数据选定优化给药方案。
本研究纳入患者年龄范围为 18–75 岁,参照标准为 AS 的修订版纽约标准,并经骶髂关节放射学评估确认。活动性疾病定义为 BASDAI 评分 ≥4 且背痛 VAS 评分 ≥40 mm。患者需对 ≥2 种 NSAIDs 反应不足或不耐受。允许在稳定剂量下合并使用 NSAIDs、csDMARDs 或低剂量口服
在两个研究阶段中,随机化均通过集中交互式应答系统(IVRS)实施,随机化的分层因素为:既往是否使用过生物制剂和/或JAK抑制剂治疗 AS(是/否)。
第 1 阶段:患者按 1:1:1:1 随机分配至艾玛昔替尼 2 mg、4 mg、8 mg 或安慰剂组,每日给药一次,持续至 12 周。第 12 周后,安慰剂组患者重新随机分配至三种剂量艾玛昔替尼组接受给药,艾玛昔替尼组患者维持原剂量直至第 24 周。
第 2 阶段:患者按 1:1 随机分配至艾玛昔替尼推荐剂量组(4 mg)或安慰剂组,每日给药一次,持续至 12 周。第 12 周后,所有患者均接受艾玛昔替尼治疗直至第 24 周。
主要终点:第 12 周达到国际脊柱关节炎协会 20(ASAS20)应答的患者比例。
次要终点:包括第 24 周 ASAS20,第 12 和 24 周的 ASAS40、ASAS5/6,以及 BASDAI、Bath强直性脊柱炎功能指数(BASFI)、Bath强直性脊柱炎计量指数(BASMI)、简明健康调查表-36(SF-36)身体健康总评(PCS)和心理健康总评(MCS)以及强直性脊柱炎生活质量(ASQoL)评分的变化。
其他疗效终点:包括第 12 周和第 24 周时与基线相比的变化:C反应蛋白(CRP)、红细胞沉降率(ESR)和基于CRP的强直性脊柱炎疾病活动评分(ASDAS);总体背痛、夜间疼痛、患者疾病活动总体评估(PtGA)和医生疾病活动总体评估(PGA);44个关节中肿胀和压痛关节数(SJC 44和TJC 44);马斯特里赫特强直性脊柱炎附着点炎评分(MASES);以及加拿大脊柱关节炎研究联盟(SPARCC)MRI骶髂关节评分。安全性结局包括治疗中出现的不良事件(TEAEs)、实验室检查、生命体征和 12 导联
1.主要终点与假设
样本量计算基于第 12 周时达到 ASAS20 缓解率的比例。具体假设为安慰剂组:40%;艾玛昔替尼 2 mg 组:50%;艾玛昔替尼 4 mg 组:60%;艾玛昔替尼 8 mg 组:62%。
2.中期分析与剂量选择(第 1 阶段)分析时机
在最后一名患者完成第 12 周疗效评估后进行预先指定的中期分析。
决策规则:疗效不足终止标准:如果第 1 阶段所有艾玛昔替尼组的 ASAS20 缓解率与安慰剂组的差异均 <10%,则研究将因疗效不足而终止。
剂量选择与进入第 2 阶段:在 IDMC 确认安全性的前提下,进入第 2 阶段以及艾玛昔替尼的推荐剂量均基于疗效结果。
实际结果:中期分析于 2021 年 10 月 19 日 进行。基于其良好的疗效和安全性,推荐在第 2 阶段使用 4 mg 剂量的艾玛昔替尼。
3.主要终点分析方法
各阶段内分析:采用 Z 检验(基于正态近似法)比较艾玛昔替尼与安慰剂,并使用正态近似法计算组间差异及其 95% 置信区间(CI)。
整体研究分析(跨第 1、2 阶段合并):采用逆正态法合并两个阶段中推荐剂量艾玛昔替尼与安慰剂比较的 P 值,得出最终的单侧 P 值。
多重性校正:第 1 阶段的结果在与第 2 阶段数据合并前,使用了 Simes 方法进行校正。
统计学显著性:单侧 P 值 ≤ 0.025 被认为具有统计学意义。缺失数据处理:对于因非 COVID-19 原因提前终止治疗或在第 12 周前增加背景药物的患者,主要使用非响应者插值(NRI)法进行分析。
4.次要终点与其他终点分析方法
数据合并:所有次要及其他疗效终点的分析均使用第 1 阶段和第 2 阶段的汇总数据,未对合并数据进行进一步的多重性调整。
二元终点(如 ASAS40, ASAS5/6):在第 12 周时,使用 Z 检验进行分析,并使用 NRI 处理缺失数据。
连续终点(如BASDAI, BASFI, BASMI, ASQoL评分变化):采用重复测量混合效应模型(MMRM)结合限制最大似然法(REML)进行分析。模型包括基线(协变量)、治疗组、访视、随机化分层及治疗-访视交互作用(固定效应),患者作为随机效应。
其他量表(SF-36 PCS/MCS):采用协方差分析(ANCOVA),以治疗组和分层为自变量,基线值为协变量。
缺失数据采用末次观测值结转(LOCF)法填补。P 值说明:所有次要终点分析未进行多重性调整,所呈现的 P 值均为名义 P 值。所有分析均使用 SAS 9.4 或更高版本进行。


本研究为一项在中国 51 个中心进行的随机、双盲、安慰剂对照、适应性无缝 II/III 期试验。共分为两个阶段: II 期(第 1 阶段)和 III 期(第 2 阶段)。整个实验流程均包括 4 周筛选期、12 周核心治疗期、12 周扩展期和 4 周安全随访期。
研究共筛选 717 名患者,纳入 504 名患者并随机分组。其中 373 名患者共分为两组:安慰剂组(n = 186)或推荐剂量艾玛昔替尼 4 mg 组(n = 187),核心治疗期(12 周):350 名(93.8%)患者完成了治疗。扩展治疗期(至 24 周):在进入扩展期的 311 名患者中,304 名(97.7%)完成了整个 24 周的治疗(包括从安慰剂转为艾玛昔替尼 4 mg 的患者),患者依从性良好(图 1)。
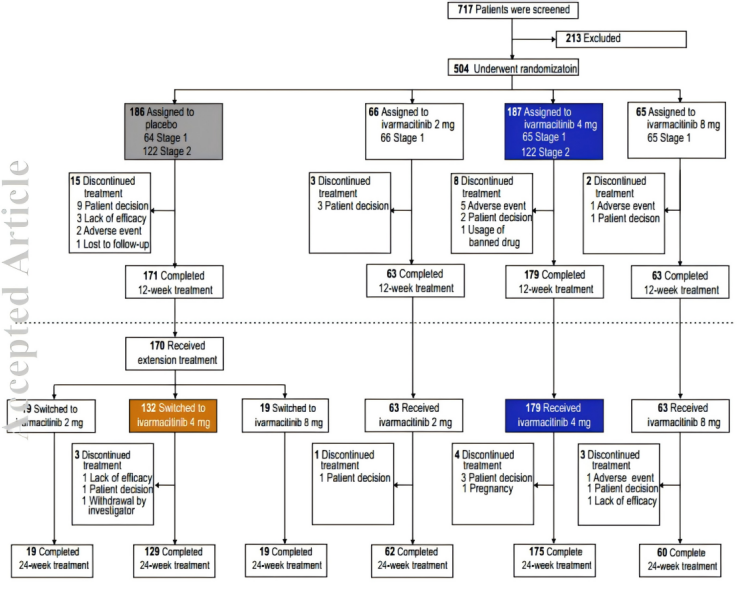
图1 总体研究的试验概况
基线特征在各组间总体平衡。平均年龄 33.8 岁,平均病程 9.3 年,79.6% 为男性,87.7% 为 HLA-B27 阳性。83.9% 的患者基线时使用 NSAIDs,32.2% 的患者既往接触过 bDMARDs。
艾玛昔替尼 4 mg 在治疗活动性 AS 患者中显示出显著疗效,第 12 周时 ASAS20 应答率显著优于安慰剂,并在多个关键次要终点(包括症状、功能、生活质量和影像学炎症)上表现出快速且一致的改善,安全性特征总体可接受。
1.主要终点
在第 12 周,艾玛昔替尼 4 mg 组达到 ASAS20 应答的患者比例显著高于安慰剂组(48.7% vs. 29.0%;单侧 P = 0.0001),治疗差异为 19.6%(单侧97.5% CI,8.3 - 100.0)(表1,图2A)。
此外,无论患者的年龄、性别、既往生物制剂暴露史或基线 CRP 水平如何,均观察到一致的 ASAS20 获益。特别是在既往接触过 bDMARD 的难治性患者中,艾玛昔替尼 4 mg 组的 ASAS20 应答率为 41.0%,而安慰剂组仅为 22.4%。
2.次要疗效终点
ASAS40 应答率:32.1% (药物组)vs. 18.3%(安慰剂组),(P = 0.0011)(表1,图2A)。
ASAS5/6 应答率:42.8%(药物组)vs. 15.6%(安慰剂组),(P < 0.0001)。
起效时间:艾玛昔替尼显示出起效迅速,从第 2 周开始,各项应答率即持续高于安慰剂(图2B-D)。
3.其他疗效指标
生活质量与功能:第 12 周时,药物组在 BASDAI(疾病活动)、BASFI(功能)、BASMI(脊柱活动度)以及 SF-36 和 ASQoL 评分方面的改善均优于安慰剂(表1、图3A)。
表1 全分析集中第12周的主要终点和次要疗效终点
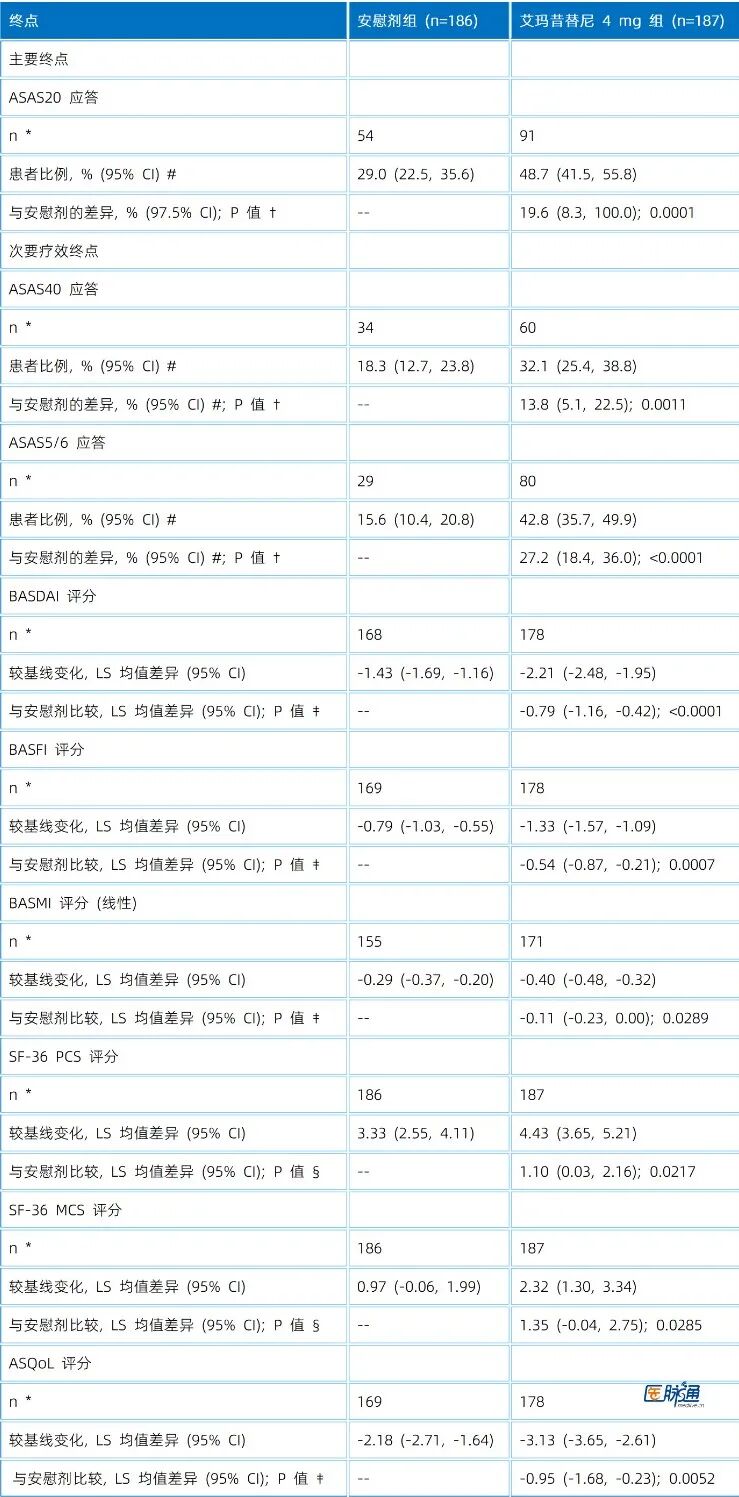
注:LS=最小二乘;CI=置信区间;NRI=无应答插补。
*第 12 周有观测值的患者数量。
#95% CI 使用正态近似法计算。
† P 值使用逆正态组合法计算。
‡ 使用重复测量混合效应模型 (MMRM) 分析。
§ 使用协方差分析 (ANCOVA) 分析。
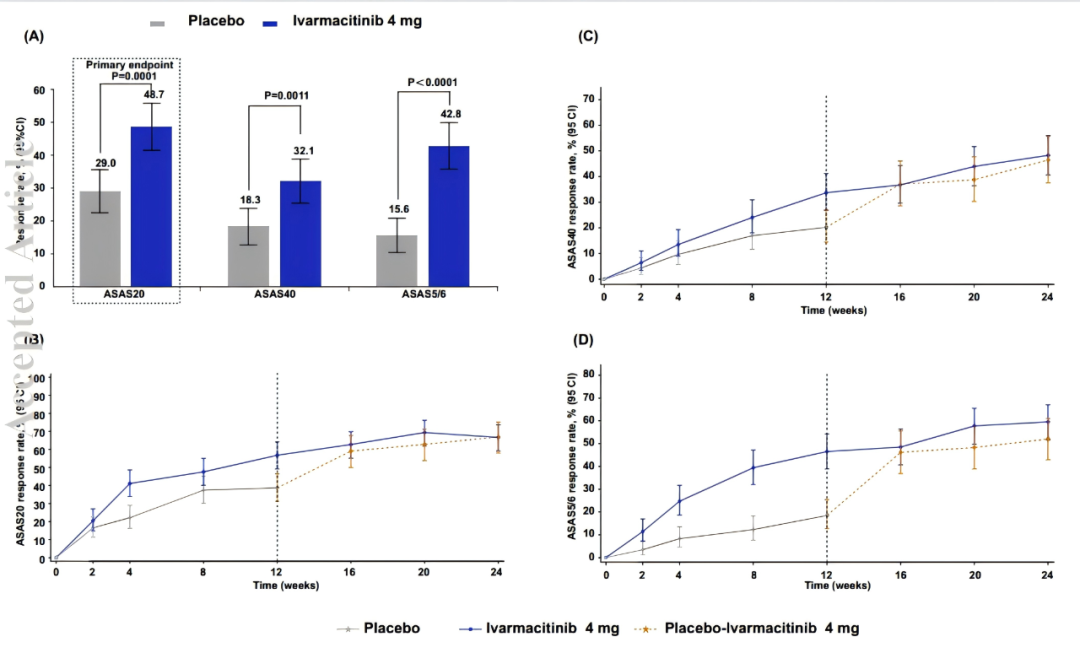
图2 计划访视时达到ASAS 20、ASAS 40和ASAS 5/6缓解的患者比例
(A)第 1 2周达到 ASAS 20、ASAS 40 和 ASAS 5/6 应答的患者比例,采用无应答者插补(NRI)。由于非 COVID-19 原因提前停止治疗或在第 12 周评估前增加背景药物治疗的患者可使用 NRI 进行分析。(B)24 周内达到 ASAS 20 应答的患者比例(观察病例分析)。(C)24 周内达到 ASAS 40 应答的患者比例(观察病例分析)。(D)24 周内达到 ASAS 5/6 应答的患者比例(观察病例分析)。
数据表示为百分比(95% CI)(A-D)。
ASAS,国际脊柱关节炎评估学会; COVID-19,2019 年冠状病毒病;CI,置信区间。
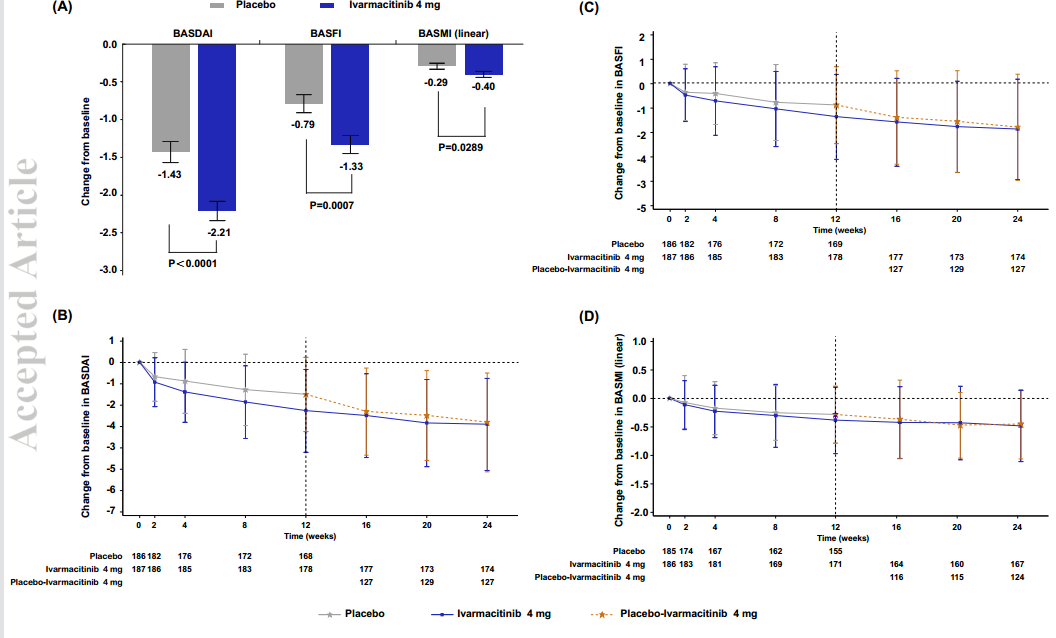
图3 计划访视时 BASDAI、BASFI 和 BASMI(线性)较基线的变化
(A)第 12 周时 BASDAI、BASFI 和 BASMI(线性)较基线的变化。(B)24 周内 BASDAI 较基线的变化(观察病例分析)。(C)24 周内 BASFI 较基线的变化(观察病例分析)。(D)24 周内 BASMI(线性)较基线的变化(观察病例分析)。
数据表示为最小二乘平均值±标准误(A)和平均值±标准差(BD)。
Bath强直性脊柱炎疾病活动度指数;BASFI,Bath强直性脊柱炎功能指数; BASMI,Bath强直性脊柱炎计量指数。
在客观指标方面,第 12 周时,艾玛昔替尼 4 mg 组的 CRP、ESR 以及 MRI 检测的骶髂关节炎症评分(SPARCC)下降幅度均显著大于安慰剂组(SPARCC 评分变化:–7.56 vs. –3.34;P < 0.0001)。
在扩展期,持续接受艾玛昔替尼治疗的患者疗效继续提升。至第 24 周,ASAS20、ASAS40 和 ASAS5/6 应答率分别达到 66.7%、48.3% 和 59.5%。对于最初分在安慰剂组并在第 12 周转为艾玛昔替尼治疗的患者,其各项指标迅速改善,至第 24 周时结果与持续用药组相似。
在 12 周核心治疗期间,艾玛昔替尼 4 mg 组的治疗期间出现的不良事件(TEAEs)发生率为 79.7%,安慰剂组为 65.6%(表2)。
常见不良事件:最常报告的是高尿酸血症(艾玛昔替尼组 16.0% vs. 安慰剂组 5.9%)和上呼吸道感染(艾玛昔替尼组 13.4% vs. 安慰剂组 12.9%)。尽管高尿酸血症发生率较高,但所有病例均为轻度,且无需停止治疗。
严重不良事件 (TESAEs):艾玛昔替尼 4 mg 组发生率为 1.1% (2/187),低于安慰剂组的 2.2% (4/186)。
特别关注事件:艾玛昔替尼组有 1 例系统性机会性感染(轻度单纯疱疹)和 1 例肝功能异常。带状疱疹发生率极低。整个研究期间未报告新诊断的恶性肿瘤、血栓栓塞事件、主要心血管事件(MACE)或死亡。
表2 第0-12周和第12-24周的治疗后出现的不良事件(安全性人群)
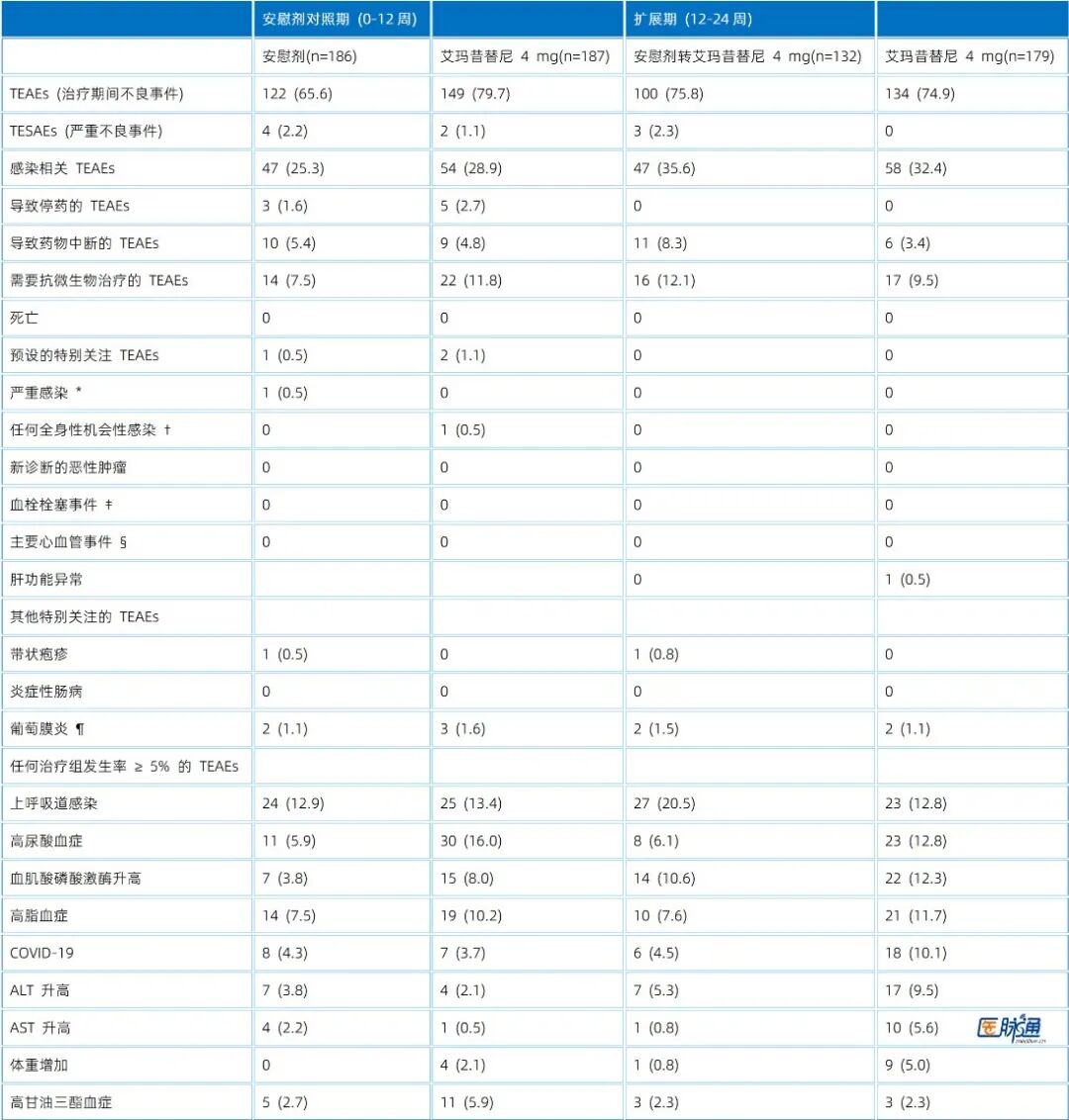
注:数据以 n (%) 表示。
严重感染定义为需要全身抗微生物治疗超过两周的感染,包括败血症、脓毒血症和感染性休克。
† 包括任何全身性机会性感染(例如活动性肺结核、播散性带状疱疹)。
‡ 包括静脉血栓(例如深静脉血栓)、肺血栓栓塞、动脉血栓和脑血管事件。
§ 主要心血管事件包括心血管死亡、非致死性心肌梗死、非致死性卒中、需要住院的不稳定型心绞痛和需要住院的心力衰竭。
|| 肝功能异常定义见原文脚注。
¶ 葡萄膜炎定义为虹膜炎、葡萄膜炎和虹膜睫状体炎的聚集性术语。


在这项注册性 II/III 期试验中,艾玛昔替尼在推荐的 4 mg 剂量下达到了主要终点。第 12 周 48.7% 的 ASAS20 应答率显著优于安慰剂的 29.0%。这种改善在包括高疾病活动度及既往使用过 bDMARDs 的难治性人群在内的各亚组中保持一致。
艾玛昔替尼起效迅速,早在第 2 周即观察到显著改善。虽然因研究设计差异需谨慎直接比较,但艾玛昔替尼 4 mg 的疗效数据与目前批准的 JAK 抑制剂相当,且在客观炎症标志物(CRP、MRI)上的改善进一步支持了其临床获益。这些获益是持久的,持续治疗至 24 周可进一步提高应答率。
安全性方面,艾玛昔替尼 4 mg 组的高尿酸血症发生率高于安慰剂组,这与 JAK 抑制剂的已知效应一致,但病例均为轻度且可控。感染(主要是上呼吸道感染)发生率在两组间相似。未观察到新的安全性信号,也未发生血栓栓塞或 MACE 事件。本研究仅纳入了放射学阳性 axSpA 的中国患者,长期疗效、在其他人种中的效果以及对男性生育能力的影响仍需进一步研究。
研究表明,对于对 NSAIDs 反应不足的活动型 AS 患者,艾玛昔替尼提供了快速、持久且具有临床意义的改善,包括疾病活动度、体征和症状、功能以及 MRI 检测到的炎症改善,且安全性特征可控。研究为将艾玛昔替尼作为活动性 AS 患者的一种新治疗选择提供了证据支持。
参考文献
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)