低血压在射血分数降低的
➤HFrEF患者中低血压常见。
➤核心问题:理论与实践的巨大差距
大规模临床试验证实,指南指导的药物治疗(GDMT)能显著改善HFrEF患者的生存率、住院率、生活质量;
现实世界的困境:真实临床环境中,GDMT的应用情况较差,包括用药启动延迟、剂量滴定不足、长期维持治疗中断等。
➤关键障碍:低血压是启动、实施和升级GDMT最常见障碍。
➤临床误区:因担心低血压而提前减量或停用GDMT。
2025 ESC-HFA临床共识声明强调了低血压被视为导致治疗惰性、阻碍心衰治疗实施的关键因素,总结了该领域的最新证据,并提出了在HFrEF合并低血压患者中优化GDMT的临床实践策略。
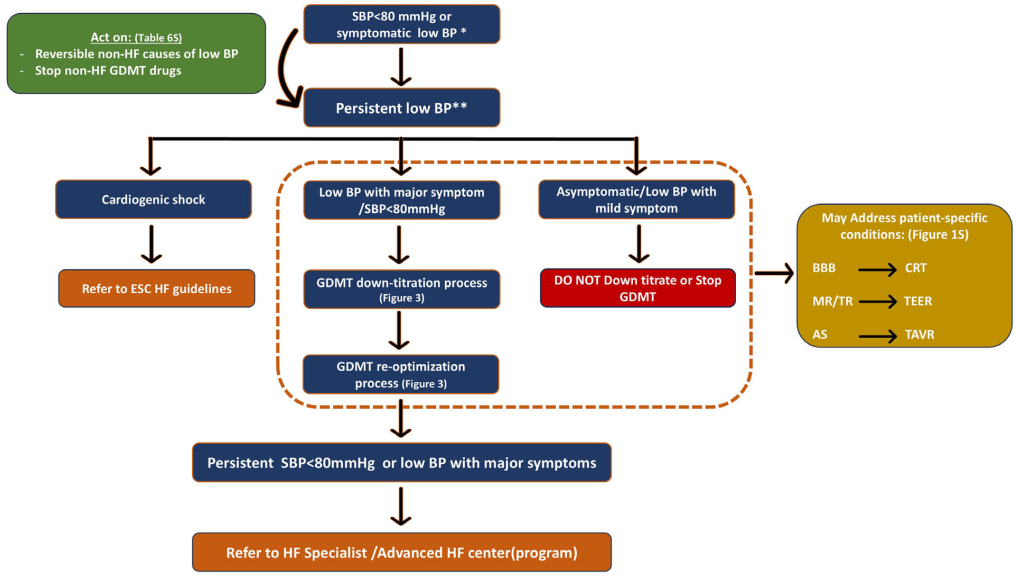
图1 中心图
➤低血压的临床常用定义:
➤关键区分:数值低 vs 有症状:
“低血压”仅是一个数值概念,而“有症状的低血压”直接影响治疗决策。
➤患病率:门诊约为3%-4%,住院急性患者(病情更重)发病率约为9%-22%。
低血压是HFrEF预后不良的标志,但在GDMT治疗下,低血压的预后影响减弱。瑞典心力衰竭注册研究(全球规模最大的心衰真实世界研究之一)通过分析超万例HFrEF患者数据,揭示了SBP与药物剂量对预后的复杂影响。研究结果显示,心血管死亡或心衰住院的复合风险随SBP的降低而增加;同样SBP水平下,心衰用药剂量较高的患者心血管死亡和心衰住院风险较低,这表明除疾病严重程度外,较高的死亡率也可能与该组中达到目标剂量药物的患者较少有关。
刘斌教授指出,多数GDMT对血压影响甚微,即便患者存在血压偏低的情况,仍有相当数量的心衰治疗药物可继续应用。
在因低血压而使心衰患者药物优化治疗面临挑战时,可考虑提前采用心脏相关器械和介入手术。这些措施能改善预后、缓解症状、提升生活质量,并可能通过提升血压,为后续实施GDMT创造条件。
常见策略包括:(1)心脏再同步化治疗(CRT);(2)经导管瓣膜介入手术:
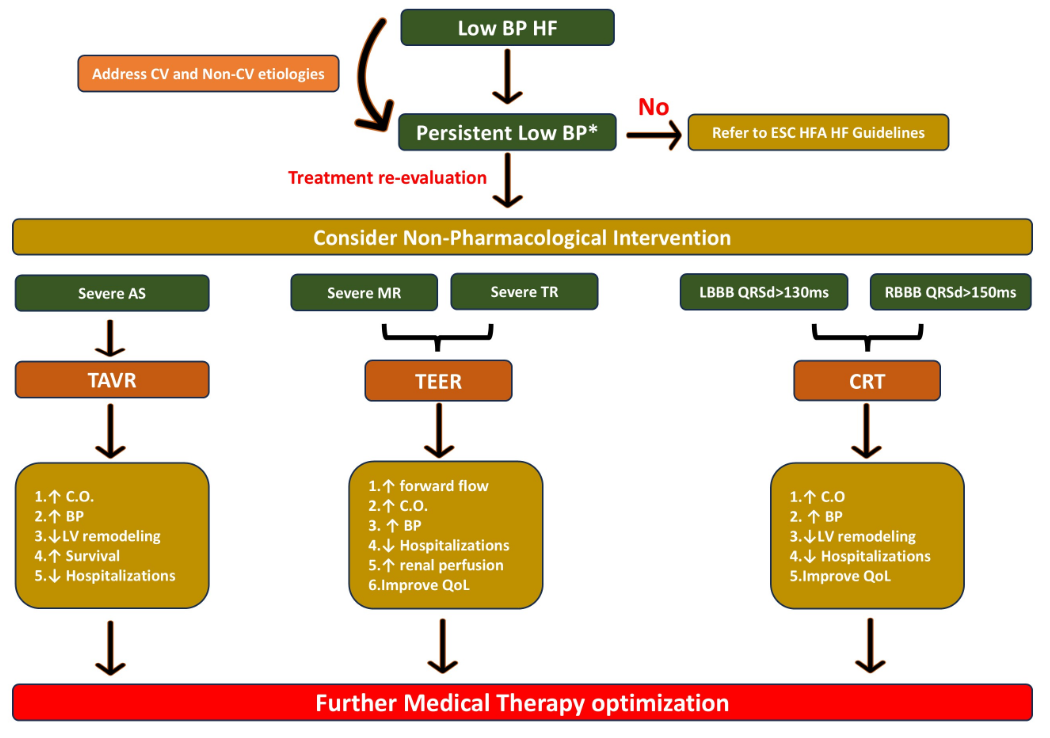
图2 心衰相关器械和介入手术
慢性心衰患者低血压管理的主要流程为:排除
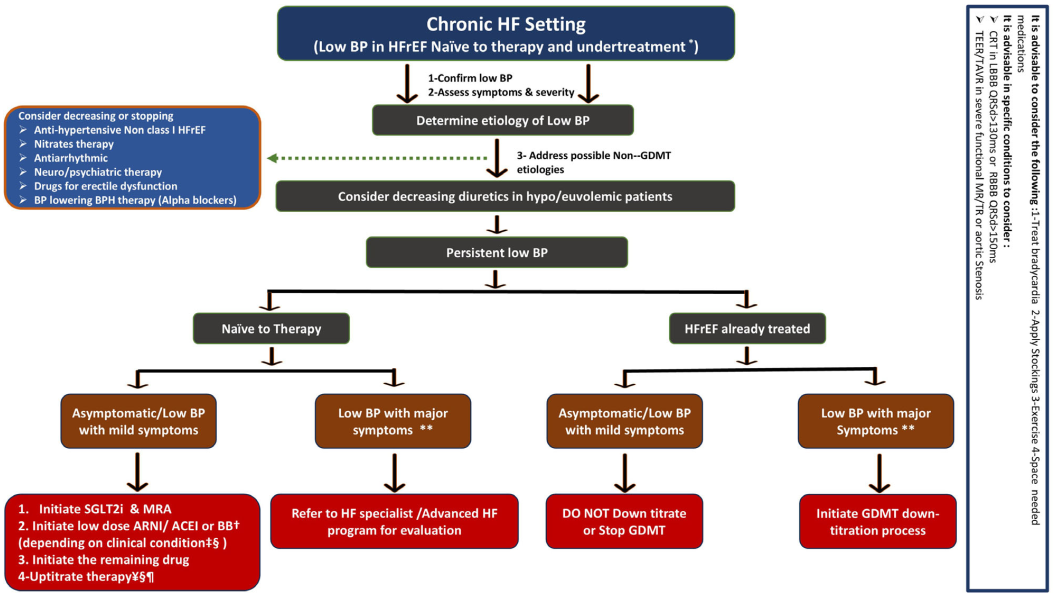
图3 慢性心衰患者的低血压管理
➤核心原则:在无症状或症状轻微的情况下,即使血压低,也应尝试低剂量、分步启动GDMT。
➤启动顺序:
首选:SGLT2抑制剂和盐皮质激素受体拮抗剂(对血压影响最小);
次选:低剂量β受体阻滞剂(心率>70次/分)或极低剂量的
替代方案:
✓若不能耐受沙库巴曲缬沙坦,可考虑低剂量血管紧张素转换酶抑制剂(ACEI)(或血管紧张素II受体拮抗剂[ARB]);
✓优先选择对血压影响较小的选择性β1受体阻滞剂。
➤执行方法:
“低剂量起始,逐个滴定”:一次只启动或调整一种药物,从小剂量开始,逐步增至患者能耐受的最高剂量或目标剂量;
密切监测:根据患者容量状态调整利尿剂剂量,避免过度利尿导致血压进一步降低。
➤核心原则:低血压很常见,且不一定代表不耐受。切勿轻易中断或减少能改善预后的GDMT。
➤患者教育与
➤系统评估步骤:
第一步:评估容量状态(临床、生物标志物、超声),如无充血,可谨慎减少利尿剂剂量,这是首选的调整措施;
第二步:寻找其他病因,评估其他心血管或非心血管原因(如瓣膜病、心肌缺血、治疗
第三步:调整GDMT
✓只有在上述措施无效且症状性低血压持续存在时,才考虑调整其他HFrEF药物的剂量或种类;
✓指导原则:SGLT2抑制剂和MRA影响小,而沙库巴曲缬沙坦影响较大。
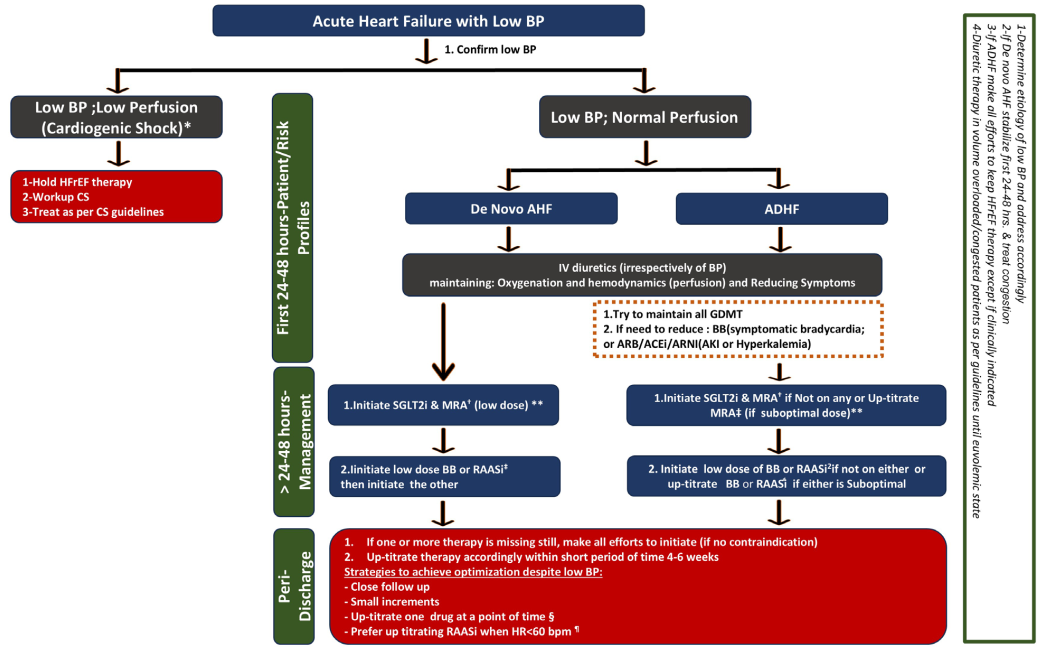
图4 急性心衰患者的低血压管理
➤核心原则:首先甄别心源性休克(SBP<90mmHg+低灌注体征;按照休克指南处理),对于正常组织灌注的急性心衰患者,根据其充血状态进行临床分型,分阶段、个体化管理。
➤初始阶段(入院48小时内):
目标:稳定血流动力学,缓解充血(利尿剂),保证氧合。
策略:根据临床分型决定GDMT:
✓“湿冷/干冷”型可暂停或减量(尤其是β受体阻滞剂和肾素血管紧张素系统抑制剂[RASI]);
✓“温暖”型稳定后可考虑继续或启动。
➤稳定后阶段(48小时后):
目标:尽早启动并优化GDMT。
策略:
✓优先启动:对血压影响最小的药物(SGLT2抑制剂、低剂量MRA);
✓逐步叠加:随后谨慎、小剂量、序贯地引入其他药物(如β受体阻滞剂、ARNI、ACEI、ARB);
✓缓慢上调:增量可持续4-6周,需密切监测。
STRONG-HF研究显示,与常规护理策略相比,在急性心衰入院后2周内将GDMT上调至100%推荐剂量并密切随访的强化治疗策略,能显著改善症状、提高生活质量,并降低180天全因死亡率或心衰再入院率。
对于合并下列特定情况的HFrEF患者,低血压的耐受窗口更窄,即使是轻度低血压也可能引发灾难性的缺血事件,管理需格外谨慎:
管理策略包括:
更保守的目标血压;
更保守的药物调整:在启动或上调GDMT时,需要更小的剂量增量、更长的观察期和更频繁的随访;
更谨慎地平衡GDMT获益与低血压风险;
加强各专科间的协同管理。
➤核心原则:停药是最后手段,且需有序进行
当所有其他策略无效,且患者面临严重低血压(SBP<80mmHg)或难以忍受的症状时,才考虑减少或停用GDMT。必须认识到,停用GDMT本身带来的风险可能远大于药物副作用的风险。
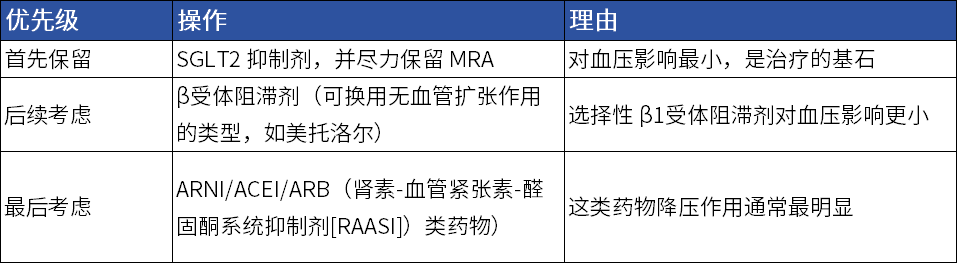
➤药物停用与保留的优先级
表1 药物停用与保留的优先级
➤停药期间的辅助策略
分时服药:错开不同药物的服用时间,避免降压效应叠加;
物理措施:穿下肢加压袜,减少体位性血压下降;
运动康复:已被证实能改善低血压和体位性低血压。
一旦患者情况允许,必须尽快、谨慎地重启GDMT。
重启总则:从最低剂量开始,缓慢递增,避免同时重启两种药物。
SGLT2抑制剂优先:对所有估算肾小球滤过率(eGFR)>20ml/min/1.73m²的HFrEF伴低血压患者,启动SGLT2抑制剂治疗。
后续滴定策略:若患者已使用SGLT2抑制剂,在eGFR 25-30ml/min/1.73m²时可考虑上调MRA;若eGFR<25-30ml/min/1.73 m²,则优先考虑β受体阻滞剂。
ARNI/ACEI/ARB路径:以低或极低剂量的ARNI启动治疗;若无法耐受,则换用对血压影响较小的低剂量ACEI或ARB。
心率管理备选:若未能达到目标心率(<70次/分)且增加β受体阻滞剂剂量不可行,对窦性心律患者考虑加用伊伐布雷定,对房颤患者考虑加用地高辛。
转诊指征:若治疗重启导致持续的症状性低血压和/或低灌注,应将患者转诊给晚期心衰团队以进行进一步管理。
➤证据空白:极低血压患者缺乏RCT证据
主要的心衰临床试验通常纳入的是血压正常的患者,导致血压极低(例如SBP<90或95mmHg)的患者明显代表性不足。
➤未来研究方向:
GDMT在SBP<90mmHg患者中的安全性;
低血压管理策略的循证支持:通过随机对照试验,检验本次专家共识所提出的低血压管理策略,为其提供高级别的随机证据支持;
优化治疗方案的探索:
✓研究停用非必要药物(如非必需心血管药物)对改善GDMT疗效、患者总生存率和生活质量的影响;
✓探索减少利尿剂用量以降低
器械治疗对血压与GDMT优化的影响。
不以血压为导向,而以症状为导向:无症状或症状轻微的低血压绝不是减停GDMT的理由。
明确干预阈值:仅在SBP<80mmHg或低血压伴有相关症状时,才考虑调整GDMT。
精准评估:慢性心衰重点评估体位性低血压;急性心衰重点是评估器官灌注(排除休克)。
优选与基石:SGLT2抑制剂/ARNI对血压影响最小,是低血压患者的治疗基石,应优先使用并尽力保留。
启用与优化顺序:
✓第一步:停用非必需的、有降压作用的其他药物;
✓第二步:若ARNI不耐受,应换用并优化ACEI/ARB;
✓第三步:考虑换用选择性β受体阻滞剂(比索洛尔/美托洛尔等)或加用伊伐布雷定以减少对血压的影响。
非药物治疗的辅助作用:特定条件下器械治疗(如CRT、TEER)或使用地高辛等,有助于为优化GDMT创造条件。
多学科协作:非心衰药物(如治疗前列腺增生的α-受体阻滞剂/抗抑郁药),应协同相关科室,选择对血压影响更小的替代药物。
及时转诊:若持续低血压导致无法启动或优化GDMT,应及早转诊给心衰专家或高级治疗中心。
积极重启:当血压改善后,应立即考虑以“从最易耐受的开始”为原则,重新尝试启用之前停用的药物。
实现优化治疗的实用技巧:
✓分次服药:将每日剂量分开服用,以平稳血药浓度,避免血压骤降;
✓策略选择:优先使用选择性β受体阻滞剂或伊伐布雷定;
✓灵活替代:ARNI不耐受时,积极使用ACEI/ARB作为替代或优化基础。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)