核心要点
■
基因治疗为以往无法治愈的遗传性视网膜疾病提供了新的治疗选择。
■ 光遗传学利用视蛋白(光敏蛋白)将视网膜神经节细胞或双极细胞转化为人工光感受器。
■ 随着多项2期临床试验的开展、监管里程碑的达成,光遗传学有望成为治疗遗传性视网膜疾病所致失明的变革性疗法。
眼部基因治疗为以往无法治愈的遗传性视网膜疾病提供了潜在治疗方案。自2017年美国 FDA 里程碑式地批准 voretigene neparvovec-rzyl(Luxturna;Spark Therapeutics 公司)用于治疗 RPE65 相关视网膜
Luxturna 仍是眼部基因治疗的先驱,为确诊患有双等位基因 RPE65 突变所致遗传性视网膜疾病的患者提供治疗。这种视网膜下注射疗法通过腺相关病毒载体递送功能性 RPE65 基因拷贝[1]。长期随访研究显示,该疗法虽取得一定成功,但也面临挑战:患者视觉功能显著改善的同时,部分患者出现了治疗后进行性色素改变。
今年3月,revakinagene taroretcellwey(Encelto;Neurotech Pharmaceuticals 公司)成为首个获 FDA 批准用于治疗特发性黄斑毛细血管扩张症2型的疗法。
与传统基因替代疗法不同,Encelto 采用封装细胞疗法,通过基因工程改造的视网膜色素上皮细胞持续分泌睫状神经营养因子。该疗法通过玻璃体内植入给药,可减缓光感受器退化 —— 临床试验显示,与假手术相比,24个月内椭圆体带丢失进展显著减少。其创新的半透膜设计既能保护植入细胞免受免疫系统攻击,又能让睫状神经营养因子扩散至玻璃体和视网膜,实现持续治疗递送[2]。
Luxturna 和 Encelto 代表了两种不同的治疗策略:针对特定突变的靶向基因替代疗法,以及持续递送神经营养因子以保护视网膜细胞的疗法。然而,另一种极具前景的不依赖特定基因的类别 —— 光遗传学,为视网膜退化(尤其是晚期患者,其光感受器已几乎或完全丧失)提供了全新治疗思路。
光遗传学的登场
光遗传学解决了
在2021年的一项里程碑式研究中,Sahel 等人利用含 ChrimsonR 的光遗传学疗法联合专用护目镜,首次实现了盲患部分视觉功能的恢复[3]。
多家公司正在推进光遗传学疗法的临床开发,各自采用不同的技术路径。以下是各公司的概述。
① AbbVie/RetroSense Therapeutics
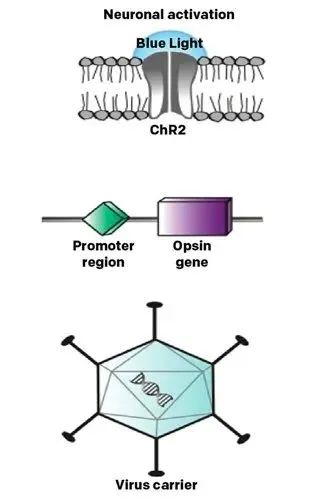
图 2 光遗传学利用病毒载体将光敏视蛋白引入视网膜细胞,使其对光敏感,有望在光感受器严重退化的患者中恢复
② GenSight Biologics

图2 GenSight 公司 GS030-MD 护目镜的设计原型。据 GenSight 公司介绍,该产品的前端有一个摄像头,可以捕捉自然环境,并将图像流发送到设备内部的投影仪上。一根电缆从设备侧面穿过,连接到装有软件的处理单元,该软件可将图像调整到正确的光照强度
③ Nanoscope Therapeutics
④ Bionic Sight
Bionic Sight 公司的方法将光遗传学与神经编码设备结合,将视觉信息转化为模拟视网膜自然编码的模式。该公司的 BS01 试验(NCT04278131)是一项1/2期研究,评估其光遗传学疗法(BS01)用于治疗晚期视力丧失的视网膜色素变性患者。
接受较低剂量的患者显示出适度但持续的改善:5名患者均出现100倍及以上的光敏感度提升,部分患者还获得了运动检测能力。接受最高两种剂量的患者改善更显著:11名患者中有10名视力提升,其中7名患者在 EDTRS 视力表上平均提升近5行[7]。
今年2月,Bionic Sight 公司的 BS01 获 FDA 授予再生医学先进疗法资格。该公司目前正在筹备3期试验,推进疗法的上市批准[7]。
Ray Therapeutics 公司的 RTx-015 采用视紫红质基方法,与通道视紫红质相比可能具有更高的光敏性。该公司近期启动了 ENVISION 试验(NCT06460844)1期研究,探索 RTx-015 在视网膜色素变性或无脉络膜症患者中的应用,并正在开发第二个项目 RTx-021,靶向视网膜双极细胞[8]。
⑥ 中眸医疗科技(武汉)有限公司
中眸医疗科技(武汉)有限公司的 ZM-02 采用了新开发的光敏蛋白,具有更高的光敏性、更优的安全性和更快的对光反应速度。与传统的基因补充或编辑疗法不同,ZM-02 无需针对特定的突变基因,提供了一种普适性的方法,不仅可用于治疗多基因遗传性视网膜病,也可用于治疗老年黄斑变性等其他伴随感光细胞退化的视网膜疾病。
该公司正在开展 MOON 试验(NCT06292650)—— 一项早期1期研究,在视网膜色素变性患者中测试 ZM-02 的多种剂量。2024年11月,该公司宣布美国 FDA 授予 ZM-02 光遗传学疗法用于治疗无特定基因限制的视网膜色素变性患者的孤儿药资格[9]。
技术驱动进步
多项技术创新推动了光遗传学的快速发展。
① 改良视蛋白
许多临床项目使用的视蛋白各具特性:
ChR2(AbbVie 公司的 RST-001):早期研究中使用的原始通道视紫红质-2,光敏性较低,由蓝光激活。
ChrimsonR(GenSight 公司的 GS030):这种红移通道视紫红质对琥珀光而非蓝光响应,降低了光毒性风险,同时与增强护目镜配合使用时可提供足够的光敏性。
MCOs(Nanoscope 公司):这些工程化多特性视蛋白旨在在广谱可见光和环境光水平下发挥作用,有望无需专用护目镜。
Chronos(Bionic Sight 公司的 BS01):与原始通道视紫红质相比,该视蛋白具有更高的光敏性和时间精度,可能实现更优的视觉信息处理。
研究人员正密切关注不同视蛋白的临床表现,尤其是更快的响应时间、光谱敏感性或增强的光敏性能否在不影响安全性的前提下转化为更好的患者结局。
② 靶向细胞的策略选择
不同光遗传学疗法靶向不同的视网膜细胞,这可能对恢复的视觉质量产生影响:
视网膜神经节细胞:AbbVie、GenSight 和 Bionic Sight 公司均靶向这类细胞。这种方法对晚期疾病有效,因为即使光感受器完全丧失,视网膜神经节细胞通常仍存活。然而,靶向视网膜神经节细胞会绕过视网膜中层的自然处理过程。
视杆双极细胞:Nanoscope 公司靶向这类细胞。双极细胞在视觉通路中更接近丢失的光感受器,可能保留更多视网膜的自然处理功能。
最佳靶向细胞可能取决于患者的疾病阶段:早期患者可能从双极细胞靶向中获益更多;而退化极严重的患者可能仅剩视网膜神经节细胞作为可行靶点。
③ 辅助技术
以下技术可增强光遗传学视觉恢复效果:
光放大护目镜(如 GenSight 公司的 GS030-MD)通过检测视觉信息并将放大的光脉冲以特定波长投射到视网膜上,解决光敏性不足的问题。
Bionic Sight 公司使用的神经编码设备旨在将视觉信息转化为模拟自然视网膜编码的光刺激模式,可能向大脑传递更有意义的视觉信息。
待攻克的挑战
尽管进展令人鼓舞,光遗传学仍面临多项挑战:
■ 光敏性限制:即使视蛋白已改进,大多数光遗传学疗法仍需要比正常视觉更高的光强度,因此需要辅助技术或进一步的视蛋白工程改造。
■ 视觉质量:现有方法可恢复基本视觉功能,但患者仍缺乏精细视力和色觉分辨能力。
■ 视网膜重塑:晚期退化导致视网膜结构发生复杂变化,可能限制光遗传学疗效。
■ 长期安全性和持久性:早期结果令人乐观,但长期安全性和疗效持久性仍有待确认。
■ 视觉康复:接受光遗传学疗法的患者需要训练以解读新的视觉信号,这需要专门的康复方案。
自2004年问世以来,光遗传学取得了显著进展。多项临床试验采用不同方法,以不依赖特定基因的方式治疗遗传性视网膜疾病。随着技术成熟,光遗传学将为受毁灭性遗传性视网膜退化影响的患者提供更多治疗选择。
作者和参考文献
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)