2026年1月22日,艾伯维宣布,国家药品监督管理局(NMPA)正式批准利生奇珠单抗用于治疗对传统治疗或生物制剂治疗应答不足、失应答或不耐受的中重度活动性
2025年3月10日,利生奇珠单抗在中国首次获批上市,用于治疗对传统治疗或生物制剂治疗应答不足、失应答或不耐受的中重度活动性
UC是一类慢性炎症性肠道疾病,近年来在我国的发病率和患病率呈不断增长趋势,有研究显示,2013-2018年UC住院增长率为10.68%。全国城镇职工UC标化患病率在2013-2016年的年均增速为24.20%。UC最常发生于青壮年期,根据我国统计资料,发病
UC临床表现为持续或反复发作的
该病多反复发作,迁延难愈,目前其病因未明,缺乏根治疗法,且有癌变风险。一项系统评价研究表明UC患者转化为
利生奇珠单抗是一种人源化、IgG1亚型的单克隆抗体,可以通过与IL-23的p19亚基结合而选择性地拮抗IL-23。此次获批用于治疗UC是基于INSPIRE和COMMAND两项III期临床试验取得的积极结果。
INSPIRE是一项多中心、随机、双盲、安慰剂对照的III期研究,在中至重度活动性UC患者中探究了利生奇珠单抗1200mg(静脉注射)每4周给药一次作为诱导治疗的有效性和安全性。其中,治疗12或24周后实现临床应答的患者进入COMMAND维持治疗研究。
在INSPIRE诱导治疗试验中,主要终点为第12周的临床缓解。研究结果显示,相较于安慰剂,利生奇珠单抗治疗12周显著提高了临床缓解率(20.3% vs 6.2%;调整后组间差异14.0%[95% CI:10.0%-18.0%];P<0.001)
在COMMAND维持治疗试验中,主要终点指标为第52周时临床缓解。研究结果显示,180mg和360mg两种维持剂量治疗52周的临床缓解率均显著优于安慰剂组(40.2% vs 37.6% vs 25.1%)。
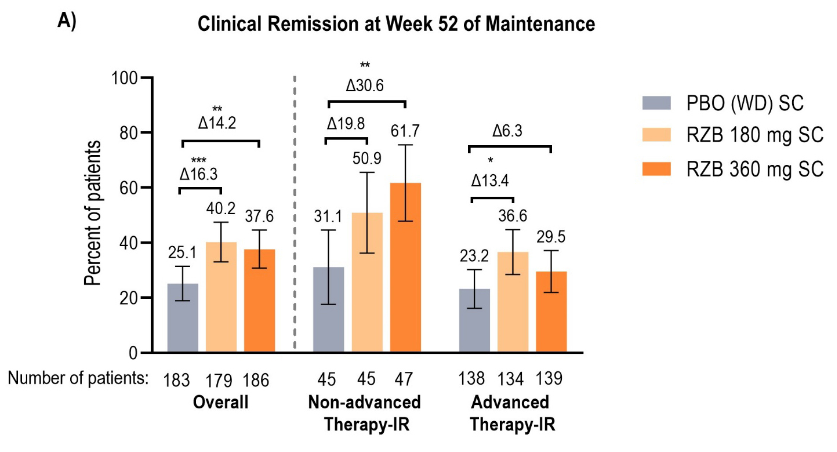
图 维持治疗52周临床缓解情况
UC在我国发病率、患病率呈上升趋势,好发于青壮年期,临床表现多样且病情易反复、迁延难愈,还存在随病程增加的结直肠癌癌变风险,临床管理难度较大。利生奇珠单抗为靶向IL-23 p19亚基的人源化IgG1单克隆抗体,其UC适应证的获批,为临床增添了重要的治疗武器。
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)