免疫耐受是免疫系统的核心特征之一,是机体在长期进化中形成的 “自我保护机制”—— 它能精准区分 “自身成分” 与 “外来异物”,对自身组织细胞保持 “无反应性”,同时对病原体等外来抗原启动高效免疫应答。这种精准的 “取舍” 是维持机体免疫平衡的关键,一旦免疫耐受被打破,将引发自身免疫病、过敏反应、肿瘤或移植排斥等一系列疾病。
10.1016/j.coi.2017.10.003.
一、免疫耐受的定义与核心特征
免疫耐受(Immune Tolerance)是指免疫系统在接触特定抗原后,对该抗原表现出的特异性无应答或低应答状态,这种状态不同于免疫缺陷(免疫系统整体功能低下)或免疫抑制(药物等外力导致的免疫功能暂时抑制),具有以下核心特征:
特异性:免疫耐受是 “针对特定抗原” 的无应答,而非免疫系统的普遍失效。例如,机体对自身蛋白 “白蛋白” 产生耐受,但对流感病毒仍能正常应答;器官移植中,若诱导对供体组织抗原的耐受,免疫系统不会攻击供体器官,却仍能清除病原体。
记忆性:与免疫应答类似,免疫耐受一旦建立,可长期维持(甚至终身)。例如,新生儿期接触某抗原后建立的耐受,成年后再次接触该抗原仍不会产生免疫应答,这一特征与免疫记忆细胞的形成密切相关。
可控性:免疫耐受并非 “不可逆”,在特定条件下(如抗原剂量改变、免疫调节剂干预)可被 “打破” 或 “重建”。例如,肿瘤患者中,肿瘤细胞通过诱导免疫耐受逃避免疫攻击,而使用免疫检查点抑制剂可打破这种耐受,恢复抗肿瘤免疫。
生理性与病理性双重属性:生理性免疫耐受是机体的 “自我保护屏障”,如对自身组织的耐受可避免自身免疫病;病理性免疫耐受则是疾病的诱因,如肿瘤耐受导致肿瘤进展、病原体耐受(如乙肝病毒慢性感染)导致感染迁延不愈。
二、免疫耐受的分类:基于发生阶段与机制的划分
根据免疫耐受发生的时间(个体发育阶段) 和部位(免疫系统成熟部位) ,可将其分为中枢免疫耐受和外周免疫耐受两大类,二者在发生机制、细胞类型和功能上存在显著差异,共同构成机体耐受的 “双重防线”。
(一)中枢免疫耐受:免疫系统成熟阶段的 “自我筛选”
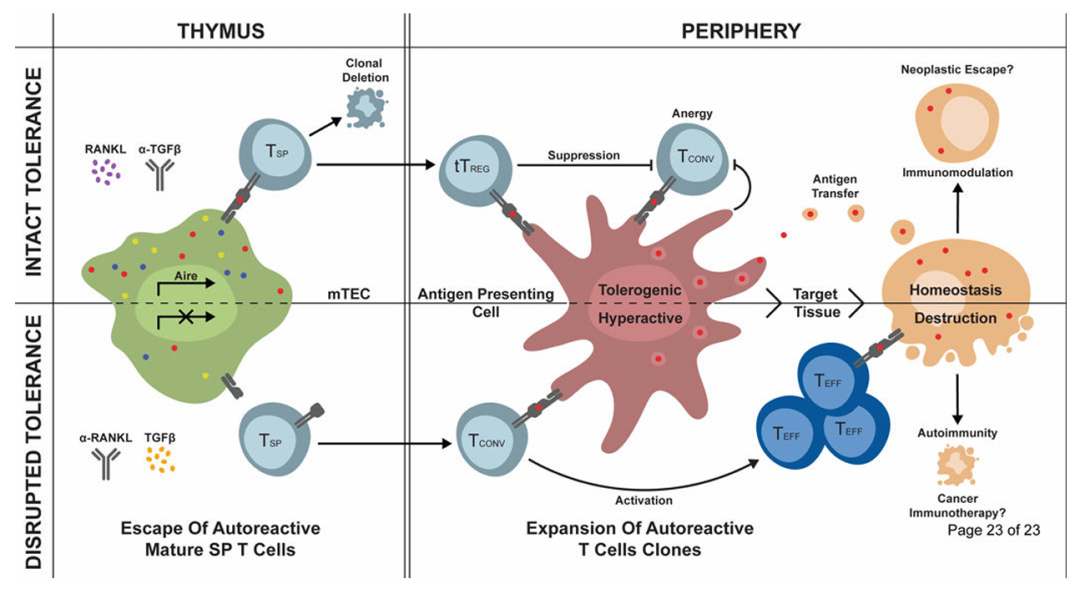
中枢免疫耐受是指未成熟的免疫细胞在中枢免疫器官(胸腺、骨髓)中,接触自身抗原后被清除或失活的过程,是机体避免自身免疫的 “第一道防线”,主要针对 “高亲和力” 的自身反应性免疫细胞。
1. T 细胞中枢耐受:胸腺中的 “阴性选择”
T 细胞在胸腺中完成成熟过程,其中 “阴性选择” 是中枢耐受的核心环节,具体过程如下:
- 前提未成熟 T 细胞(胸腺细胞)在胸腺皮质经历 “阳性选择” 后,获得 “识别自身 MHC 分子” 的能力(即形成 “MHC 限制性”),随后迁移至胸腺髓质,接触由胸腺上皮细胞(TECs)表达的 “自身抗原”。
- 关键分子胸腺髓质上皮细胞(mTECs)表达AIRE 基因(自身免疫调节因子) ,该基因可诱导 “组织特异性抗原(TSAs)” 的表达 —— 即原本只在肝脏、肾脏等外周组织表达的抗原(如胰岛素、甲状腺球蛋白),在胸腺中被 “模拟表达”,确保未成熟 T 细胞能接触到几乎所有自身抗原。
- 选择结果若未成熟 T 细胞的 TCR(T 细胞受体)与胸腺中的自身抗原 - MHC 复合物 “高亲和力结合”,则会启动凋亡程序(克隆清除);只有 TCR 与自身抗原 - MHC 复合物 “低亲和力结合” 或 “不结合” 的 T 细胞,才能存活并迁移至外周,成为成熟 T 细胞。
- 意义通过阴性选择,95% 以上的自身反应性 T 细胞在胸腺中被清除,从源头避免了外周 T 细胞对自身组织的攻击。若 AIRE 基因突变(如自身免疫性多内分泌腺病综合征),TSAs 无法在胸腺表达,自身反应性 T 细胞逃逸至外周,将引发多器官自身免疫损伤。
2. B 细胞中枢耐受:骨髓中的 “克隆清除与受体编辑”
B 细胞在骨髓中成熟,其中枢耐受机制比 T 细胞更复杂,主要通过 “克隆清除” 和 “受体编辑” 两种方式实现:
- 克隆清除未成熟 B 细胞的 BCR(B 细胞受体)与骨髓中的自身抗原(如膜结合型自身蛋白)“高亲和力结合” 时,会激活凋亡信号,导致该 B 细胞克隆被清除,这一过程与 T 细胞的阴性选择类似。
- 受体编辑若未成熟 B 细胞的 BCR 与自身抗原 “中等亲和力结合”,不会直接凋亡,而是启动RAG 基因(重组激活基因) 的重新表达,使 BCR 的轻链基因发生二次重排,生成新的 BCR。若新 BCR 不再识别自身抗原,B 细胞可继续成熟;若仍识别自身抗原,则启动克隆清除。
- 意义受体编辑是 B 细胞中枢耐受的 “纠错机制”,可减少自身反应性 B 细胞的清除率,同时避免其对自身组织产生应答。若 RAG 基因功能异常,受体编辑失效,自身反应性 B 细胞将逃逸至外周,可能引发系统性红斑狼疮(SLE)等自身免疫病。
(二)外周免疫耐受:成熟免疫细胞的 “外周调控”
中枢免疫耐受并非 “完美”—— 部分自身抗原(如某些组织特异性抗原仅在成年后表达、或在胸腺 / 骨髓中不表达)无法被中枢免疫器官识别,导致少量自身反应性 T/B 细胞逃逸至外周。外周免疫耐受则是针对这些 “漏网之鱼” 的 “第二道防线”,通过多种机制抑制其活化,主要发生在外周淋巴器官(淋巴结、脾脏)和组织中。
1. 克隆无能:“信号缺失” 导致的免疫细胞失活
免疫细胞的活化需要 “双信号”:第一信号是抗原与受体的结合(如 TCR - 抗原 - MHC 复合物、BCR - 抗原),第二信号是共刺激分子的相互作用(如 T 细胞表面 CD28 与抗原提呈细胞(APC)表面 B7 的结合)。若仅存在第一信号,缺乏第二信号,免疫细胞将处于 “失活状态”(克隆无能),无法增殖和分化。
- T 细胞克隆无能外周组织中的 APC(如树突状细胞 DC)在 “稳态下”(无病原体感染)不表达或低表达共刺激分子(B7-1/B7-2),仅表达 MHC 分子。当自身反应性 T 细胞接触 APC 提呈的自身抗原时,仅获得第一信号,缺乏第二信号,最终成为 “无能 T 细胞”—— 这类细胞不仅自身无应答,还可能通过分泌抑制性细胞因子(如 IL-10)抑制其他免疫细胞。
- B 细胞克隆无能B 细胞的活化同样需要 T 细胞的辅助(Tfh 细胞分泌的 IL-21)。若自身反应性 B 细胞识别自身抗原后,无法获得 Tfh 细胞的辅助信号(因 Tfh 细胞已通过克隆无能失活),则 B 细胞无法活化,最终凋亡或成为 “无能 B 细胞”。
2. 克隆清除:外周组织中的 “自身反应性细胞清除”
部分自身反应性免疫细胞在中枢耐受中逃逸后,若在周 - 围组织中接触到 “高浓度自身抗原”,且伴随炎症信号(如组织损伤释放的危险信号),会被进一步清除,即外周克隆清除。
例如,胰岛 β 细胞损伤时,释放大量胰岛素(自身抗原),同时释放 ATP 等危险信号,激活局部 DC。DC 提呈胰岛素抗原给自身反应性 T 细胞,同时表达共刺激分子(因危险信号激活),使 T 细胞活化 —— 但活化的 T 细胞若持续接触高浓度胰岛素,会启动 “活化诱导的细胞死亡(AICD)”:通过 Fas-FasL 通路(T 细胞表面 Fas 与自身或其他细胞表面 FasL 结合)诱导凋亡,最终清除自身反应性 T 细胞,避免胰岛进一步损伤。
3. 调节性 T 细胞:免疫耐受的 “专职调控者”
10.31083/j.fbl2911377
调节性 T 细胞(Treg)是一类具有 “免疫抑制功能” 的 T 细胞亚群,是外周免疫耐受的核心执行者,主要分为两类:
- 自然调节性 T 细胞(nTreg)在胸腺中发育成熟,占外周 CD4+T 细胞的 5%-10%,表面高表达 CD25(IL-2 受体 α 链)和转录因子 Foxp3(Treg 的标志性分子)。nTreg 通过直接接触(如表达 CTLA-4,竞争性结合 APC 表面的 B7 分子,抑制 T 细胞活化)或分泌抑制性细胞因子(IL-10、TGF-β),抑制自身反应性 T 细胞的活化和增殖。
- 诱导性调节性 T 细胞(iTreg)在 peripheral 组织(如肠道、脾脏)中,由初始 CD4+T 细胞在 “低剂量抗原 + TGF-β” 的条件下诱导分化而来,其功能与 nTreg 类似,但主要在局部组织(如肠道黏膜)发挥耐受作用,例如抑制肠道对食物抗原的过度应答,避免食物过敏。
若 Foxp3 基因突变(如 IPEX 综合征),Treg 无法正常发育和功能,自身反应性 T 细胞失控活化,将引发严重的自身免疫病(如幼年型糖尿病、肠炎),甚至危及生命。
4. 免疫忽视:“低亲和力 + 低浓度” 导致的免疫无应答
免疫忽视是指免疫系统对 “低亲和力” 或 “低浓度” 的自身抗原 “视而不见” 的状态 —— 由于自身抗原与免疫细胞受体的亲和力过低,或抗原浓度过低,无法达到免疫细胞活化的阈值,因此不产生免疫应答。
例如,某些组织特异性抗原(如中枢神经系统中的髓鞘碱性蛋白 MBP)在正常情况下释放量极少,且与自身反应性 T 细胞的 TCR 亲和力较低,免疫系统无法感知其存在,形成免疫忽视。但当脑组织损伤(如脑梗、外伤)时,MBP 大量释放,浓度升高,可打破免疫忽视,激活自身反应性 T 细胞,引发中枢神经系统自身免疫病(如多发性硬化症)。
5. 细胞因子介导的耐受:“抑制性微环境” 的塑造
外周组织中的细胞因子环境对免疫耐受的维持至关重要 —— 若局部组织中 “抑制性细胞因子”(如 TGF-β、IL-10、IL-35)占主导,可抑制免疫细胞的活化,促进耐受形成。
例如,肝脏是 “免疫特惠器官”(移植后排斥反应发生率低),其原因之一是肝脏中的枯否细胞(Kupffer 细胞)和肝窦内皮细胞可分泌大量 TGF-β,形成抑制性微环境:一方面抑制自身反应性 T 细胞的活化,另一方面诱导 iTreg 的分化,从而维持肝脏对自身抗原的耐受;同时,这种微环境也能抑制移植后供体抗原特异性 T 细胞的攻击,降低排斥风险。
三、影响免疫耐受建立与维持的关键因素
免疫耐受的形成并非 “固定不变”,而是受抗原、机体状态、环境等多种因素调控,这些因素决定了耐受的 “强度” 和 “持续时间”。
(一)抗原因素:耐受的 “启动信号”
抗原是诱导免疫耐受的 “核心诱因”,其剂量、类型、给药途径、持续时间直接影响耐受的建立:
抗原剂量:“高剂量耐受” 与 “低剂量耐受”
- 高剂量抗原(尤其是可溶性抗原,如白蛋白、胰岛素)可直接诱导免疫细胞凋亡(克隆清除)或失活(克隆无能)。例如,给小鼠注射高剂量牛血清白蛋白(BSA),可诱导 B 细胞和 T 细胞对 BSA 的耐受,这一现象称为 “高带耐受”。
- 低剂量抗原可通过诱导 iTreg 的分化,间接抑制免疫应答,形成 “低带耐受”。例如,口服低剂量食物抗原(如牛奶蛋白),可在肠道诱导 iTreg 分泌 IL-10,抑制肠道对食物抗原的过度应答,避免食物过敏。
抗原类型:“可溶性抗原” 更易诱导耐受
- 可溶性抗原(如自身蛋白、小分子药物)因不易被 APC 吞噬和提呈,且无法有效激活共刺激信号,更易诱导克隆无能;而颗粒性抗原(如细菌、病毒)或聚合性抗原(如抗体交联的抗原)可被 APC 高效吞噬,激活共刺激信号,更易诱导免疫应答,而非耐受。
抗原给药途径:“口服 / 静脉给药” 优先诱导耐受
- 口服抗原可通过 “肠道黏膜免疫耐受” 机制(如诱导 iTreg、分泌 TGF-β),使免疫系统对该抗原产生 “全身耐受”(即口服耐受),这也是口服脱敏治疗(如花粉过敏)的理论基础。
- 静脉给药可使抗原直接接触外周免疫细胞,且避免了 APC 的活化(无炎症信号),易诱导克隆无能;而皮下 / 肌肉注射抗原可激活局部 APC(如 DC),更易诱导免疫应答。
抗原持续时间:“长期接触” 巩固耐受
- 短期接触抗原仅能诱导 “暂时耐受”,而长期、持续接触抗原(如自身抗原终身存在于体内)可使耐受状态稳定维持,甚至形成 “终身耐受”。例如,慢性乙肝病毒感染中,病毒长期存在于肝细胞内,可诱导免疫系统对病毒抗原的耐受,导致感染迁延不愈。
(二)机体因素:耐受的 “内在基础”
机体的年龄、免疫系统成熟度、遗传背景是决定免疫耐受能否建立的 “内在条件”:
年龄:“新生儿期易诱导耐受,成年期难诱导”
- 新生儿期免疫系统尚未成熟(胸腺未发育完全、Treg 数量少),此时接触抗原易诱导终身耐受;而成年期免疫系统已成熟(中枢耐受机制完善、免疫细胞活性高),需更高剂量抗原或更强的免疫抑制干预才能诱导耐受。例如,新生儿期接受器官移植,排斥反应发生率远低于成年患者。
免疫系统状态:“免疫抑制状态下易诱导耐受”
- 当机体处于免疫抑制状态(如使用免疫抑制剂、感染导致免疫功能低下)时,免疫细胞活性降低,此时接触抗原易诱导耐受;而当机体处于免疫激活状态(如感染、炎症)时,APC 活化、共刺激信号增强,难以诱导耐受,甚至可能打破已有的耐受。
遗传背景:“MHC 基因型影响耐受易感性”
- MHC(主要组织相容性复合体)基因决定了自身抗原的提呈效率:若 MHC 分子与自身抗原的结合能力强,易在胸腺中通过阴性选择清除自身反应性 T 细胞,耐受易建立;若 MHC 分子与自身抗原结合能力弱,自身反应性 T 细胞易逃逸至外周,耐受难建立。例如,携带 HLA-DR4 基因型的人群,MHC 分子与类风湿因子(自身抗原)结合能力强,类风湿关节炎的发病率显著高于其他人群。
(三)环境因素:耐受的 “外部调控”
感染、药物、营养等环境因素可通过影响免疫系统状态,间接调控免疫耐受:
感染:“打破或促进耐受”
- 某些病原体(如 EB 病毒、幽门螺杆菌)可通过 “分子模拟” 机制(病原体抗原与自身抗原结构相似),激活自身反应性 T 细胞,打破自身耐受,引发自身免疫病(如 EB 病毒感染与系统性红斑狼疮相关)。
- 某些病原体(如寄生虫)可分泌抑制性分子(如 TGF-β 类似物),抑制宿主免疫系统,促进对自身抗原的耐受,同时也使宿主对病原体产生耐受,导致感染慢性化。
药物:“人工调控耐受”
- 免疫抑制剂(如环孢素、他克莫司)可抑制 T 细胞活化,辅助诱导移植耐受;免疫检查点抑制剂(如 PD-1 抗体)可阻断 PD-1/PD-L1 通路(肿瘤细胞通过该通路诱导免疫耐受),打破肿瘤耐受,恢复抗肿瘤免疫。
营养:“肠道菌群影响黏膜耐受”
- 肠道菌群可通过代谢产物(如短链脂肪酸)诱导肠道 iTreg 的分化,维持肠道黏膜对食物抗原和菌群抗原的耐受;若肠道菌群失调(如抗生素滥用导致有益菌减少),iTreg 数量降低,易引发食物过敏或炎症性肠病(IBD)。
四、免疫耐受的临床应用:从疾病治疗到健康管理
免疫耐受的机制研究为多种疾病的治疗提供了 “新策略”—— 通过 “重建耐受” 治疗自身免疫病和过敏反应,通过 “打破耐受” 治疗肿瘤和慢性感染,通过 “诱导耐受” 降低器官移植排斥反应。
(一)自身免疫病:重建对自身抗原的耐受
自身免疫病的核心机制是 “自身耐受被打破”,自身反应性免疫细胞攻击自身组织。因此,治疗的关键是 “重建对自身抗原的耐受”,而非单纯抑制免疫功能(传统免疫抑制剂的局限性)。
口服耐受诱导:治疗肠道相关自身免疫病
- 口服低剂量自身抗原(如髓鞘碱性蛋白 MBP 治疗多发性硬化症、胰岛素治疗 1 型糖尿病),可在肠道诱导 iTreg 分化,通过分泌 IL-10 和 TGF-β,抑制全身自身反应性 T 细胞的活化。目前,口服 MBP 已进入多发性硬化症的 Ⅱ 期临床试验,可显著减少患者的复发频率。
Treg 过继治疗:精准调控免疫耐受
- 从患者外周血中分离 Treg,在体外扩增后回输体内,可增强局部组织的免疫抑制效应。例如,在 1 型糖尿病患者中,回输自体扩增的 Treg 可抑制胰岛 β 细胞的损伤,延缓疾病进展;在系统性红斑狼疮患者中,Treg 回输可降低自身抗体水平,缓解皮疹、肾炎等症状。
抗原肽疫苗:诱导特异性耐受
- 设计与自身抗原核心序列一致的短肽(如胶原肽治疗类风湿关节炎),通过皮下注射诱导自身反应性 T 细胞的克隆无能或凋亡。这类疫苗仅针对自身反应性免疫细胞,不影响正常免疫功能,避免了传统免疫抑制剂的副作用。
(二)器官移植:诱导对供体抗原的耐受
器官移植的主要障碍是 “移植排斥反应”—— 受体免疫系统将供体器官视为 “外来抗原”,启动免疫攻击。若能诱导受体对供体抗原的 “特异性耐受”,可实现 “无免疫抑制剂的移植存活”(即 “免疫耐受移植”),这是移植医学的终极目标。
骨髓嵌合体诱导:建立 “双向耐受”
- 在移植前,向受体输注供体骨髓细胞,使受体体内同时存在供体和受体的免疫细胞(即 “混合嵌合体”)。供体骨髓细胞可在受体胸腺中诱导供体抗原特异性 T 细胞的阴性选择,同时受体免疫细胞也对供体抗原产生耐受,形成 “双向耐受”。目前,该技术已在肾脏移植中应用,部分患者可长期停用免疫抑制剂,且无排斥反应。
共刺激信号阻断:抑制 T 细胞活化
- 使用单克隆抗体(如抗 CD28 抗体、抗 CTLA-4 抗体)阻断 T 细胞活化的第二信号,诱导供体抗原特异性 T 细胞的克隆无能。例如,在心脏移植中,联合使用抗 CD28 抗体和低剂量免疫抑制剂,可显著延长移植物存活时间,降低急性排斥反应的发生率。
间充质干细胞(MSC)治疗:塑造抑制性微环境
- MSC 可分泌 TGF-β、IL-10 等抑制性细胞因子,诱导 iTreg 分化,同时抑制 DC 的活化。在肝移植中,输注供体来源的 MSC 可减少移植后肝内炎症反应,促进供体抗原耐受的建立,降低慢性排斥反应的风险。
(三)肿瘤:打破对肿瘤抗原的耐受
肿瘤细胞通过多种机制诱导免疫耐受(如高表达 PD-L1、分泌 TGF-β),逃避免疫系统的攻击(即 “肿瘤免疫逃逸”)。因此,肿瘤免疫治疗的核心是 “打破肿瘤免疫耐受”,恢复抗肿瘤免疫应答。
免疫检查点抑制剂:解除 T 细胞 “刹车”
- 肿瘤细胞通过表达 PD-L1(程序性死亡配体 1),与 T 细胞表面的 PD-1(程序性死亡受体 1)结合,抑制 T 细胞活化(即 “免疫刹车”)。PD-1/PD-L1 抗体可阻断这一结合,解除 T 细胞的抑制状态,恢复其抗肿瘤活性。目前,PD-1 抗体已用于治疗黑色素瘤、非小细胞肺癌、肝癌等多种肿瘤,部分患者可实现长期缓解。
肿瘤疫苗:激活自身抗肿瘤免疫
- 以肿瘤抗原(如肿瘤相关抗原 TA、突变抗原 neoantigen)为靶点,设计疫苗诱导自身反应性 T 细胞的活化。例如,在黑色素瘤患者中,接种黑色素瘤抗原(如 MART-1)疫苗可激活肿瘤特异性 T 细胞,清除残留肿瘤细胞,降低复发风险。
CAR-T 细胞疗法:改造 T 细胞以打破耐受
- 从患者外周血中分离 T 细胞,在体外通过基因工程改造,表达针对肿瘤抗原的嵌合抗原受体(CAR),使 T 细胞能精准识别并攻击肿瘤细胞,不受肿瘤免疫耐受机制的抑制。目前,CAR-T 细胞疗法已在白血病、淋巴瘤等血液肿瘤中取得显著疗效,部分患者可实现治愈。
(四)过敏反应:诱导对过敏原的耐受
过敏反应是免疫系统对 “无害抗原”(如花粉、尘螨、牛奶蛋白)过度应答的结果,核心是 “对过敏原的耐受缺失”。通过 “脱敏治疗” 诱导对过敏原的耐受,是根治过敏的唯一方法。
皮下脱敏治疗:逐步诱导耐受
- 从低剂量开始,皮下注射过敏原提取物,逐渐增加剂量,使免疫系统逐渐适应过敏原,诱导 Treg 分化和 IL-10 分泌,抑制 IgE 抗体的产生(IgE 是过敏反应的关键抗体)。例如,在花粉过敏患者中,皮下脱敏治疗可使花粉季节的打喷嚏、流鼻涕等症状显著减轻,部分患者可实现长期脱敏。
舌下脱敏治疗:安全便捷的口服耐受
- 将过敏原提取物滴于舌下,通过口腔黏膜吸收,诱导局部 iTreg 的分化,形成黏膜耐受。该方法无需注射,安全性高,适合儿童和青少年。目前,舌下脱敏治疗已用于尘螨、花粉等过敏原的脱敏,有效率可达 70% 以上。
五、总结与展望
免疫耐受是机体免疫平衡的 “调控核心”,其机制涉及中枢免疫器官的 “克隆筛选” 和外周组织的 “多重调控”,是生理性保护与病理性损伤的 “分水岭”。随着对免疫耐受分子机制的深入解析(如 AIRE、Foxp3、PD-1/PD-L1 等关键分子的发现),临床应用已从 “非特异性免疫抑制” 转向 “特异性耐受调控”—— 从自身免疫病的 Treg 治疗,到器官移植的嵌合体诱导,再到肿瘤的免疫检查点抑制,免疫耐受技术正重塑疾病治疗的范式。
未来,随着单细胞测序、基因编辑(如 CRISPR-Cas9)等技术的发展,我们将能更精准地 “编辑” 免疫细胞的耐受特性(如改造 Treg 的抗原特异性),实现 “个体化的耐受调控”;同时,肠道菌群、代谢产物等环境因素与免疫耐受的关联研究,也将为慢性病(如肥胖、糖尿病)的防治提供新靶点。可以预见,免疫耐受将成为连接基础免疫与临床转化的 “桥梁”,为人类健康提供更精准、更安全的治疗方案。
其他参考资料
Cheru N, Hafler DA and Sumida TS (2023) Regulatory T cells in peripheral tissue tolerance and diseases. Front. Immunol. 14:1154575. doi: 10.3389/fimmu.2023.1154575
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)