钙化防御(曾称“钙化性尿毒症性小动脉病”)是一种罕见的皮肤血管病变,以微血管钙沉积和血栓形成为特征,可导致组织缺血及继发皮肤坏死。虽然肾功能衰竭患者发生钙化防御的风险最高,但该病也可见于无肾脏疾病者。因此,使用“肾源性”和“非肾源性”进行区分能更准确地描述该病。早期识别与干预对改善预后至关重要,但因该病临床表现多样且主要依赖临床诊断,常导致诊断延误。
【风险因素】
绝大多数钙化防御病例为CKD 3期及以上患者的肾源性钙化防御,其中透析依赖性肾功能衰竭是最主要的风险因素。其他可能增加风险的合并症包括糖尿病、肝病、恶性肿瘤、甲状旁腺功能亢进、高磷血症以及结缔组织病。此外,既往使用皮质类固醇、维生素K拮抗剂、含钙磷结合剂、维生素D或静脉铁剂也与钙化防御风险升高有关。女性、年龄超过60岁BMI(体重指数)>30 kg/m²是明确的人口统计学风险因素。
病例中的患者正在服用含钙磷结合剂、活性维生素D补充剂、维生素K拮抗剂及静脉铁剂,因此该问题的最佳答案为E 。
【临床表现与诊断】
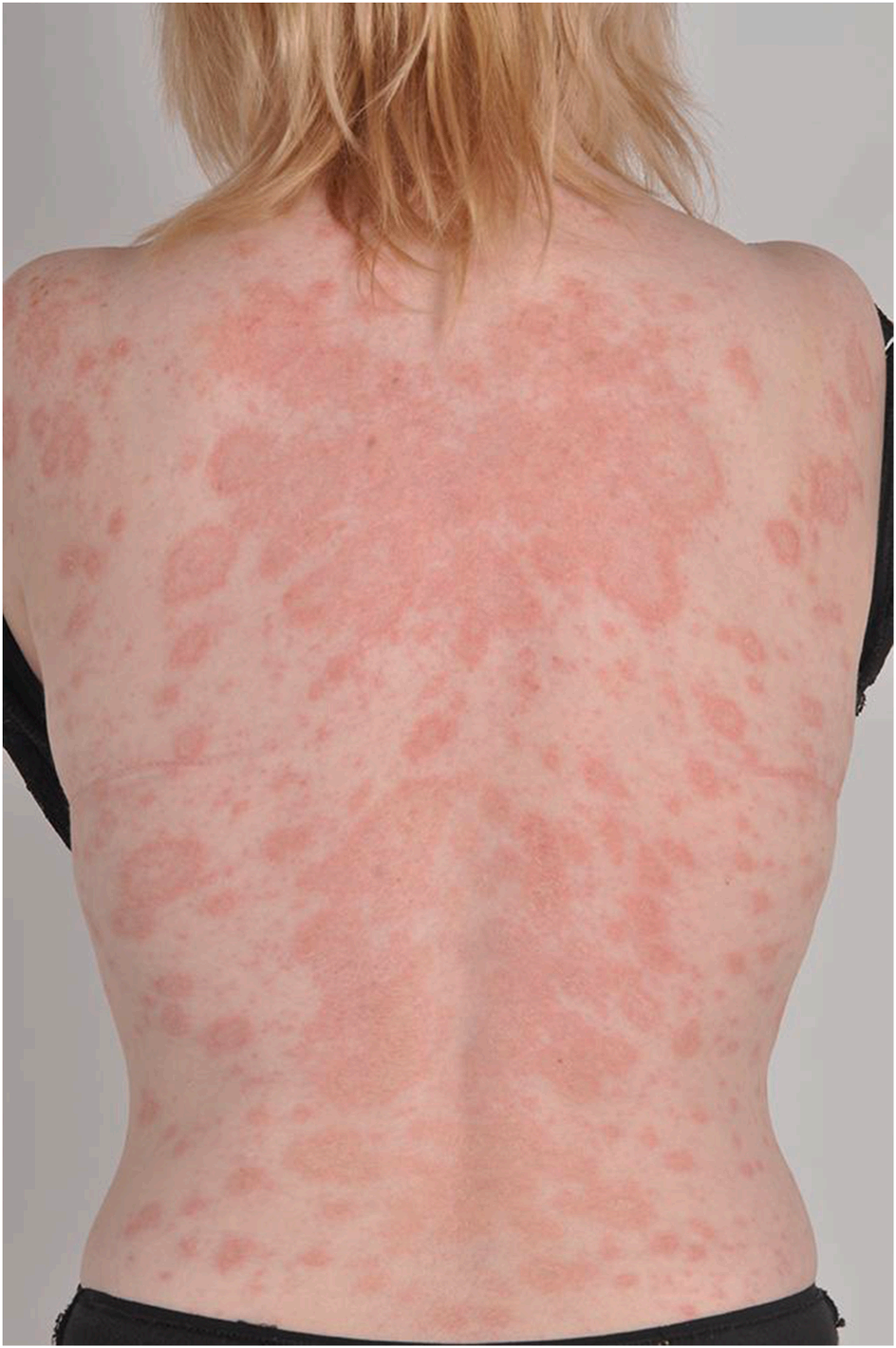
对于具有特征性皮肤表现的高危患者,若皮损出现在高脂肪区域(如腹部、臀部、大腿及乳房),应高度警惕钙化防御可能。然而,该病临床表现因病变范围、皮肤色素沉着和解剖分布差异而多样,易与其他疾病混淆。此外,机械清创可能破坏皮损的原始形态,进一步增加诊断难度。
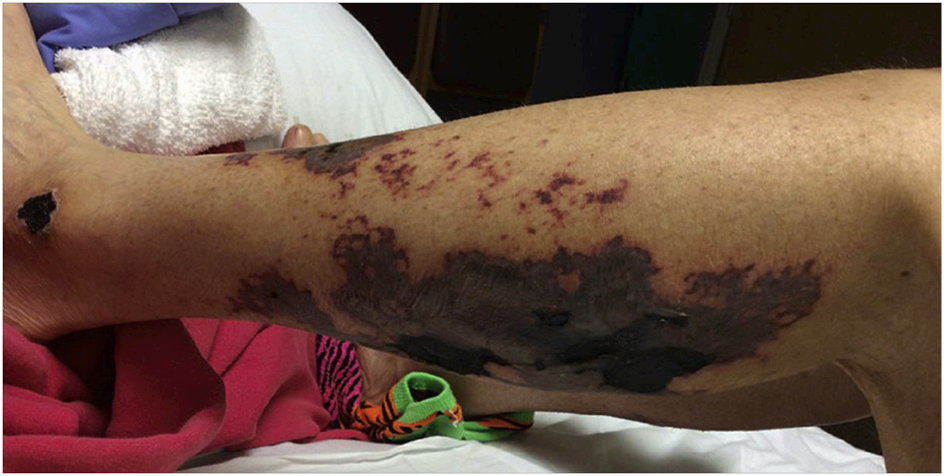
疾病早期,患者常主诉疼痛程度远超体格检查所见,且疼痛可早于任何皮肤改变出现。这一表现尤其对肾功能衰竭患者具有警示意义,提示钙化防御的可能。早期皮损可呈局部红斑,类似蜂窝织炎,但通常不伴皮温升高,反而伴有皮肤硬化及与检查不符的疼痛。其他早期表现包括非消退性网状紫癜或分支状紫癜性斑片/斑块,硬化区域可出现橘皮样纹理改变。对于肤色较深的患者,若未在充足光线下仔细检查,早期或轻微的红斑与紫癜易被忽略;其紫癜可能表现为色素沉着而非典型紫红色,因此全面细致的检查尤为重要。随着病情进展,可能出现水疱或大疱,皮肤逐渐溃烂,最终覆盖皮革样黑色焦痂。
目前诊断钙化防御尚无金标准方法,主要依据临床表现。在某些情况下,皮肤活检和影像学检查可提供辅助信息。皮肤活检的作用存在争议,因取样技术限制、缺乏典型组织学表现或病理经验不足,可能导致假阴性结果。典型病理特征包括真皮深层及皮下组织的小血管钙化,伴纤维蛋白血栓形成,以及覆盖其上的真皮与表皮坏死。
然而,假阳性结果也较常见,有观点认为需同时观察到点状钙化和血栓形成,才能提高诊断特异性。此外,钙化防御中亦有科布内现象的报道。因此,是否进行活检需根据具体病例权衡利弊。
影像学检查可为诊断提供支持,特别在活检结果不明确或存在取样禁忌时。非增强CT和超声是有效的辅助手段:非增强CT中,血管钙化呈现为明亮的线性结构;床旁超声对皮损位于活检禁忌部位(如阴茎)时尤其具有应用价值。
【病理生理学】
钙化防御的发病机制尚待阐明,其主要病理过程包括内皮功能障碍、微血管钙化及血栓形成三个关键环节。微血管钙化的起源被认为是钙化促进因子与抑制因子失衡所形成的促钙化微环境,该环境可能与胎球蛋白A、焦磷酸盐及羧化基质Gla蛋白(MGP)等抑制因子水平降低有关。慢性肾脏病(CKD)患者常用的华法林会抑制维生素K依赖的MGP羧化,从而促进血管钙化。
钙化主要累及中小血管的中膜,呈环周性分布,常伴有内膜纤维增生。这一表现不同于以内膜增厚为特征的动脉粥样硬化,也与以血管纤维化为特点的慢性血管病变有所区别。
【治疗策略】
目前美国食品药品监督管理局(FDA)尚未批准任何针对钙化防御的特异性疗法。该类患者的管理需依赖多学科协作,综合采取以下措施:通过优化医疗方案控制风险因素、开展系统性治疗、加强伤口护理与感染预防,并实施疼痛管理。涉及的关键科室包括肾脏科、皮肤科、疼痛与姑息医学科、伤口护理科、外科及营养科。
医疗管理应重点控制疾病进展的风险因素,包括优化钙、磷等矿物质水平,并避免PTH过高。对于PTH升高的患者,优先使用拟钙剂(如西那卡塞)而非甲状旁腺切除术,以预防“骨饥饿综合征”及相关严重低钙血症的发生。但若拟钙剂治疗后PTH未迅速下降,鉴于疾病可能快速进展甚至危及生命,应考虑甲状旁腺切除术。同时需审核患者用药,停用可能促进钙化的治疗药物。
对于需要抗凝治疗的患者,宜考虑采用非华法林方案,如阿哌沙班或普通肝素。在条件允许时,应尽量避免皮下注射,以减少皮肤创伤引发新皮损的风险。肾功能衰竭患者可通过强化透析方案(例如延长治疗时间或增加治疗频率)来优化磷及其他溶质的清除效果。
皮肤科、伤口护理科与外科的协作对促进愈合、防止组织进一步坏死至关重要。若局部酶学清创不充分或伤口存在感染,可采用保守性焦痂及坏死组织清除。对于非感染性伤口,条件允许时化学清创优于常规手术清创,以避免刺激疾病活动;也可待药物治疗使活动性紫癜消退后再行手术干预。
为降低脓毒症风险,若出现以下情况建议使用抗生素:大量脓性引流、原有稳定皮损出现新发或扩展性红斑,或生命体征异常。由于溃疡常伴有严重定植,伤口培养结果可靠性有限,因此治疗宜选用广谱抗生素,并需警惕真菌感染,尤其对免疫功能低下患者。
此外,高压氧治疗(HBOT)在促进伤口愈合和降低死亡率方面显示出潜在效果。由于治疗在密闭舱内进行,需注意患者可能出现的焦虑和幽闭恐惧反应。对每周接受三次血液透析的患者而言,HBOT的时间安排也存在一定难度。
-硫代硫酸钠:虽未获FDA批准用于钙化防御,但凭借其血管舒张、抗钙化及抗炎作用,常被用于该病的治疗。其疗效依据主要来自观察性研究和病例报告。给药方式包括在血液透析期间静脉输注,起始剂量通常为每次12.5 g,可根据耐受情况逐渐增至25 g;非透析患者也可经外周静脉给药。临床推荐疗程约为3个月。常见不良反应包括恶心、呕吐、阴离子间隙增高型代谢性酸中毒、QT间期延长,长期使用可能导致骨矿物质丢失。此外,该药也可直接注射于活动性皮损内部。
-己酮可可碱具有抗氧化作用,可抑制血管钙化。该药通过增强红细胞柔韧性和局部灌注,已应用于多种缺血性皮肤病变的治疗。
-维生素K:一项Ⅱ期双盲临床试验表明,植物甲萘醌(维生素K1)可减轻疼痛强度并改善皮损总面积。
尽管近期研究显示钙化防御患者全因死亡率已降至44.1%,生存预期有所改善,但患者仍持续经历严重且常对阿片类药物耐药的缺血性与神经病理性疼痛。该患者群体的疼痛管理、姑息治疗及心理问题常未得到系统关注,建议及早咨询疼痛专科医师。可能需要采用多模式镇痛方案,包括氯胺酮、苯二氮䓬类药物、椎管内麻醉及神经冷冻消融等治疗手段。