近期,《美国肾脏病杂志》(AJKD,IF=8.2)发表了"Skin Disorders in Kidney Disease: Core Curriculum 2026",通过剖析典型病例,阐述肾脏病常见皮肤病变的诊疗策略,涵盖慢性肾脏病相关性瘙痒症(CKD-aP)、获得性穿孔性皮肤病(APD)、皮肤钙质沉着症(CC)、钙化防御、皮肤狼疮及
尽管目前尚未发现所有CKD相关皮肤病变存在统一的发病机制,但已有若干病理生理学机制被证实与其相关:
【
在CKD的病程中,本应由肾脏正常排泄的溶质开始发生蓄积。疾病进展至晚期时,尿素可沉积于皮肤表面,形成表现为灰白色沉积的尿毒症霜,但这一现象在肾脏替代治疗普及的今天已较为罕见。此外,尚有多种未被常规定量检测的大分子溶质,即使在尿素清除充分的情况下,仍可能在皮肤病变(如瘙痒症)的发生发展中起到作用。
【代谢紊乱】
高血清磷水平可导致真皮及皮下组织的中小血管发生钙化。血管钙化不仅参与外周血管病变及钙化防御的发病机制,且当血清钙水平升高或皮肤受到创伤时,还可能诱发皮肤钙质沉着症,并进一步加剧钙化防御的进展。
【炎症反应与自身免疫机制】
多种疾病(如
52岁男性,因
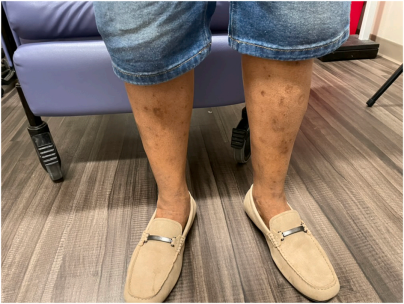
图1 患者小腿皮肤干燥、有鳞屑和色素沉着斑点
下列哪种药物是控制该患者瘙痒症状最合适的初始治疗方案?
A. 润肤剂
B.
C.
D.
正确答案:A
上下滑动查看
59岁女性患者,因2型糖尿病导致肾功能衰竭,已接受13年血液透析治疗。她因剧烈瘙痒前往医院急诊就诊,导致最近一次透析治疗提前1小时终止。回顾其透析记录显示,过去一个月内她每次透析仅完成3小时或更短时间(处方时长为4小时)。就诊时患者生命体征稳定。皮肤检查发现其四肢有多处角化过度性斑块。患者目前用药包括:氨氯地平10 mg每日一次;碳酸司维拉姆1600 mg随餐服用;羟嗪10 mg睡前服用;加巴喷丁300 mg每周三次(透析后服用);骨化三醇0.5 μg每周三次。门诊透析实验室检查显示:单室模型Kt/V值为1.0,血钙9.0 mg/dL,血磷6.1 mg/dL,糖化血红蛋白(HbA1c)6.0%,白蛋白3.1 g/dL,甲状旁腺激素(PTH)423 pg/mL。其皮肤病变表现如图2所示。
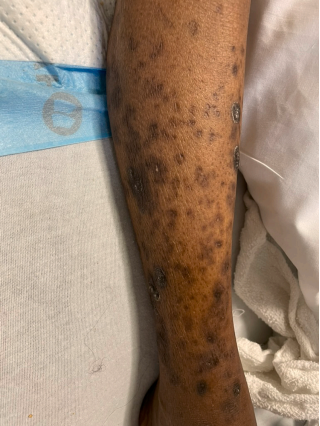
图2 患者手臂或腿部有明显的硬皮、角化斑块
下列哪种疗法可能对该患者的皮肤病变有效?
A. 口服泼尼松
B. 硫唑嘌呤
C. 外用2%-10%水杨酸
D. 霉酚酸酯
正确答案:C
上下滑动查看
48岁男性患者,因疲劳、乏力、食欲不振及双侧肘部、肩部和下肢出现直径约1厘米的坚硬无痛性结节(与图3所示相似)至急诊就诊。部分皮损已溃破,渗出白垩样物质。患者约4个月前开始自觉疲劳,此前健康状况一直良好。全身症状在过去3个月内逐渐加重,皮肤病变于就诊前约3周开始出现。患者未服用任何药物,亦未补充钙剂或维生素D。体格检查其余无殊。实验室检查显示:血清尿素氮(SUN)68 mg/dL,肌酐5.4 mg/dL(6个月前基线肌酐值为1.1 mg/dL),血红蛋白8.3 g/dL,血钙12.1 mg/dL,血磷5.7 mg/dL,甲状旁腺激素(PTH)9 pg/mL。其1,25-二羟维生素D水平为75 pg/mL(正常范围:18-64 pg/mL)。
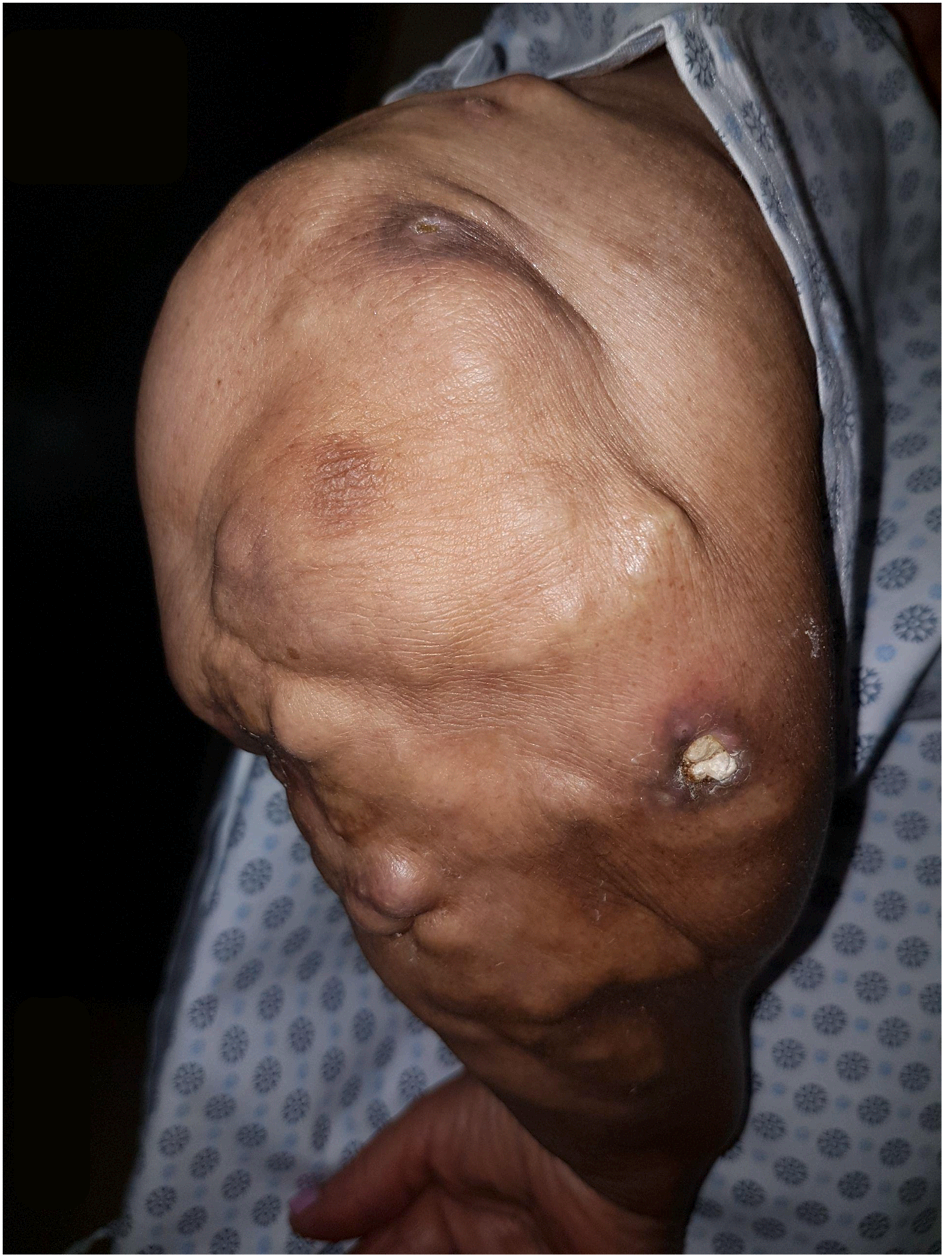
图3 右侧手臂和前臂出现渐进性、疼痛性皮下结节。部分皮损已溃破,渗出灰白色粉笔样物质
下列哪种疾病可解释该患者的临床表现?
A. 三发性甲状旁腺功能亢进症
B. 钙化防御
C. 乳-碱综合征
D. 结节病
正确答案:D
上下滑动查看
参考文献:
Colleen M. Glennon, et al.Skin Disorders in Kidney Disease: Core Curriculum 2026,
American Journal of Kidney Diseases,Volume 87, Issue 1,2026,Pages 102-114,ISSN 0272-6386.
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。仅供HCP观看。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)