
本期配图来自2025年11月7日发表在ACS Applied Materials & Interfaces( IF 8.2 )上的文章《Thermosensitive Hydrogel-Mediated Chemo-Photothermal Combined Immunotherapy for Triple-Negative Breast Cancer》[1]
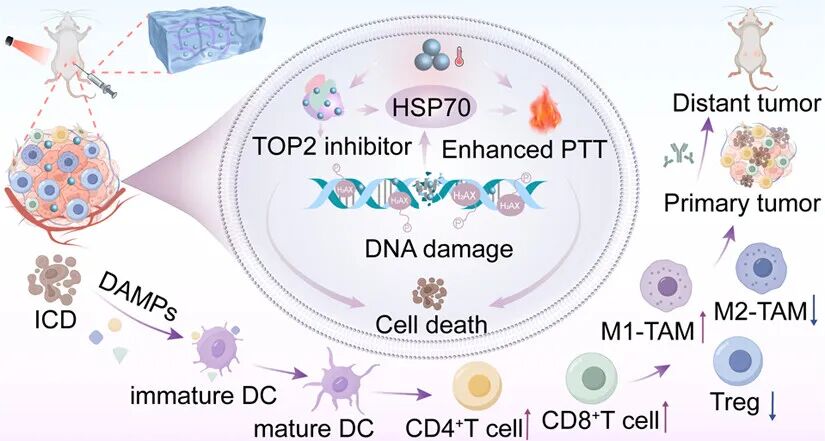
图1.使用多功能CS/GP@MTO水凝胶进行协同三阴性
本图呈现了多功能CS/GP@MTO水凝胶在近红外光(NIR)照射下通过光热和化疗双重作用诱导肿瘤细胞死亡,激活CD4⁺ T细胞和CD8⁺ T细胞直接杀伤肿瘤细胞,并且削弱免疫抑制微环境,抑制转移灶生长的多重作用机制。
近红外光(NIR)照射下,水凝胶产生高效光热效应,使肿瘤局部温度升至约53.5℃,直接杀伤肿瘤细胞
水凝胶负载的拓扑异构酶II抑制剂(TOP2 inhibitor)米托蒽醌(MTO)诱导DNA损伤(DNA damage),进而导致细胞死亡(cell death)
同时,下调热
肿瘤细胞在光热和化疗协同作用下发生免疫原性细胞死亡(Immunogenic Cell Death,ICD),释放损伤相关分子模式(DAMPs,Damage-Associated Molecular Patterns)如钙网蛋白(CRT)、高迁移率族蛋白B1(HMGB1)、ATP。这些信号激活未成熟树突状细胞(immature DC),使其成熟为成熟树突状细胞(mature DC)
成熟DC迁移至淋巴结,激活CD4⁺ T细胞和CD8⁺ T细胞,大量浸润肿瘤组织,直接杀伤肿瘤细胞
同时,促进M2型肿瘤相关巨噬细胞(M2-TAM)向M1型肿瘤相关巨噬细胞(M1-TAM)转化,增强抗肿瘤炎症反应;抑制 调节性T细胞(Regulatory T cell,Treg),削弱免疫抑制微环境
原发肿瘤(Primary tumor)的免疫激活可通过血液循环传递至远端肿瘤(Distant tumor),抑制转移灶生长
背景补充
三阴性乳腺癌中肿瘤免疫微环境的高度抑制特性,显著限制了PD-1/PD-L1抑制剂等免疫治疗的疗效。光热治疗(PTT)作为一种创新治疗手段,凭借其精准的时空可控性和可调的温度选择性,展现出日益广阔的临床应用前景。因此,本研究创新性地选用临床获批的淋巴结示踪剂——
参考文献:
Luo Y, Liao Z, Liao H, Wu Y, Tan W, Chen M, Xu Y, Wang L, Long X, Niu C. Thermosensitive hydrogel-mediated chemo-photothermal combined immunotherapy for triple-negative breast cancer. ACS Applied Materials & Interfaces. 2025;17(45):5c17119. DOI: 10.1021/acsami.5c17119

往期推荐
氨诱导的T淋巴细胞死亡以增强乳腺癌免疫治疗" data-itemshowtype="0" linktype="text" data-linktype="2" hasload="1">图解乳“献” | 第119期:仿生有机纳米酶作为肿瘤疫苗,靶向抑制氨诱导的T淋巴细胞死亡以增强乳腺癌免疫治疗
编辑:Sophia
审校:Luna
排版:Sophia
执行:Ocean
医脉通是专业的在线医生平台,“感知世界医学
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)