皮肤型红斑狼疮(CLE)是一种复杂的炎症性皮肤病,既可独立存在,也是
CLE主要分为四大亚型:急性型(ACLE)、亚急性型(SCLE)、慢性型(CCLE)及间歇性CLE(ICLE)(图1 A、B)。其中CCLE尤其是盘状红斑狼疮(DLE)最为常见,约占全部病例的80%。患者多以某一亚型为主要表现,但亦可合并多种亚型。在亚型内部,可进一步根据
CLE的诊断需要综合评估皮肤病变的起病时间、持续时间和形态特征、组织病理学及实验室检查结果。
组织病理学表现因亚型而异,典型表现为界面性皮炎,即真皮黏液沉积和表皮-真皮交界处(DEJ)炎性浸润,伴基底角质形成细胞死亡(图1 C)。部分CLE患者(如肿胀型狼疮)无典型界面性皮炎,但具有黏蛋白沉积、真皮乳头
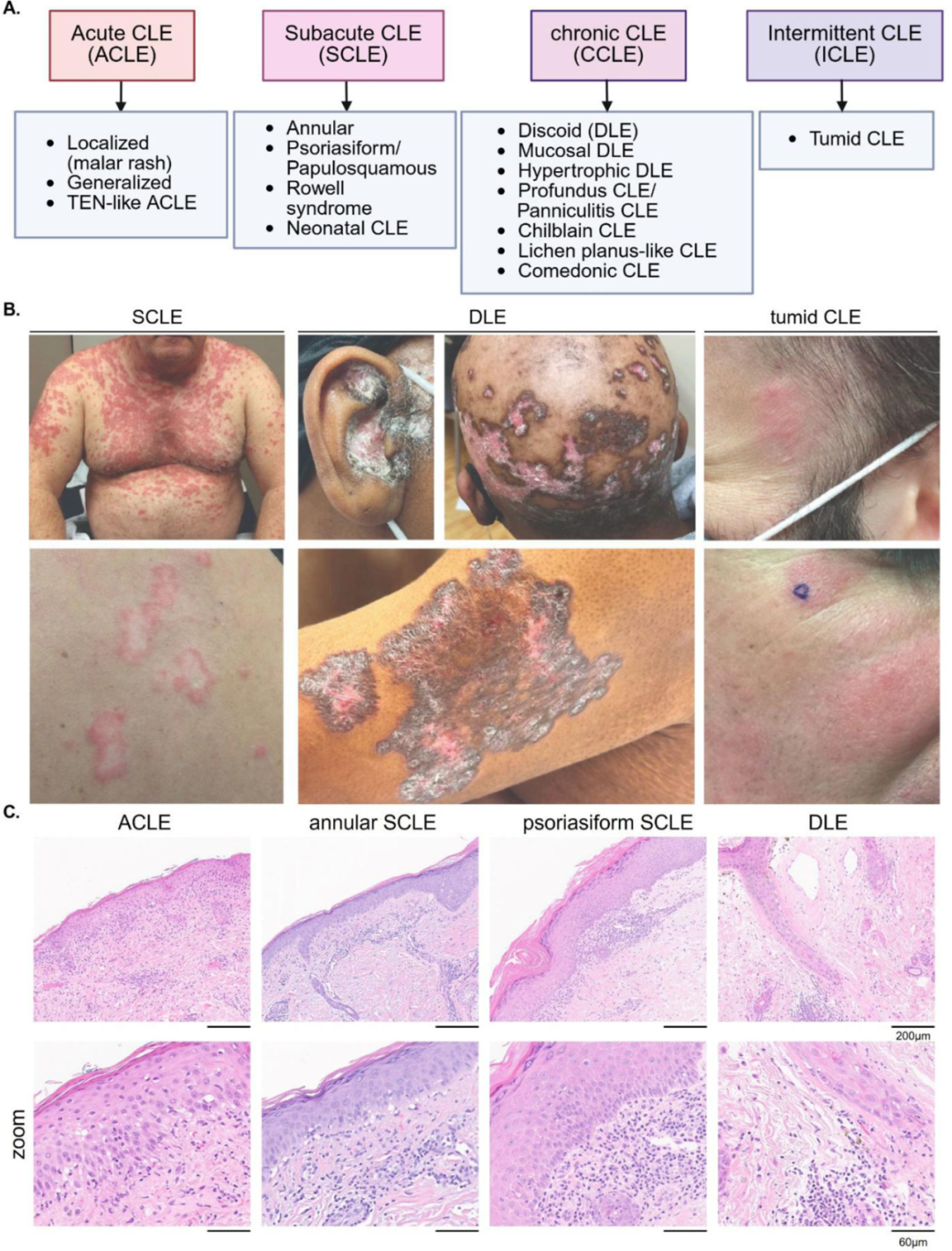
图1. 皮肤型红斑狼疮(CLE)分类、皮肤病变形态学及组织病理学。
A. 根据杜塞尔多夫分类法划分的CLE四大亚型及众多特异性亚型。B. SCLE、DLE及肿胀型CLE的临床影像。SCLE特征为日光暴露区对称性分布的环形或丘疹鳞屑性斑块。环形病灶常伴中央白斑样色素减退。盘状狼疮多发于面部、耳廓及头皮,广泛性病变时亦可累及颈部以下日光暴露区。需注意其病灶表现为色素沉着性边缘,中央呈凹陷性色素减退性萎缩及瘢痕。肿胀型日光性皮炎患者在日光暴露区可见硬化性
体格检查
体格检查需关注皮肤黏膜有无慢性CLE加重及持续超过两周的口腔溃疡。
实验室检查
实验室检查包括
诊断方法还包括直接免疫荧光检测(
确诊后应采用皮肤红斑狼疮疾病面积和严重程度指数评估疾病活动度与损伤。此外还需评估疼痛、瘙痒程度及皮肤病对生活质量的影响。
过去四十年来,美国CLE发病率保持稳定,不同性别或年龄组均无明显变化趋势。人口研究显示,发病率为3.9-4.3/10万人年,患病率估计为70-109/10万人。欧洲数据与此类似。女性发病率约为男性的3倍,平均发病年龄集中在50至60岁。值得注意的是,在男性及老年群体中,CLE发病率高于SLE,60-69岁为发病峰值年龄段。
不同种族与族群在CLE发病率及疾病负担方面存在显著差异。在美国,黑人CCLE(特别是盘状红斑狼疮)发病率显著高于白人,可达白人的3至5倍,且通常病情更重、发病更早。新西兰数据显示,毛利人和太平洋岛民患CLE(尤其是DLE)的风险也远高于欧洲裔人群。这些差异可能由遗传与环境因素共同导致,需进一步研究以明确其相对作用。
进展为SLE的风险
孤立性CLE患者的死亡率与普通人群相似,标准化死亡率为1.23(95% CI: 0.88-1.66)。然而,部分CLE患者初诊时即合并SLE(约24%),或在随访中发展为SLE(额外增加18%),这会显著增加其发病和死亡风险。孤立性CLE进展为SLE的比例在成人中为0%-42%,儿童中为0%-31%,进展可能发生在确诊后的早期或晚期。
CLE类型是影响SLE进展风险的重要因素。急性红斑性狼疮(ACLE)常与活动性SLE相关。在其他亚型中,SCLE患者进展风险最高,泛发性DLE同样具有较高风险。系统性自身免疫标志物可用于风险分层,相关因素包括:抗核抗体(ANA)(尤其高滴度)、血细胞减少等血液学异常,以及符合其他狼疮分类标准。抗Ro/SSA抗体阳性也可能与风险增加相关,但缺乏直接比较。
部分仅根据皮肤黏膜标准(如
监测CLE患者向SLE进展的风险
目前,尚无主要医学组织发布关于监测CLE患者进展为SLE的正式指南。有学者建议采用临床监测结合实验室监测的方法。临床监测应包括全面的全身皮肤检查(含黏膜评估)及系统性症状回顾。实验室监测可合理包含
多种遗传因素与CLE相关,其亚型存在重叠且独特的遗传关联。单基因型CLE/SLE主要与I型干扰素通路慢性激活相关,即“干扰素病”。单基因型CLE典型表现为家族性冻疮性狼疮。
TREX1基因杂合突变:最为常见。该基因编码一种参与清除胞质DNA的核酸外切酶,其功能下降会导致胞质DNA蓄积,进而通过cGAS-STING通路持续激活I型干扰素反应。患者常出现自身抗体、系统性干扰素特征及光敏感。
SAMHD1基因突变:可导致另一种家族性冻疮性狼疮,表型包括紫斑性斑块、甲
TLR7通路基因突变:TLR7及其转运蛋白UNC93B1的错义突变可导致SLE,并伴有包括冻疮性狼疮在内的皮肤表现。
非单基因性(常见型)CLE具有更复杂的遗传背景,涉及多个基因。主要关联包括:
HLA相关基因:全基因组关联研究发现CLE相关SNP位点位于6号
其他免疫相关基因:ITGAM、FCGR2A、VDR、STK17A等基因的变异与SLE皮肤受累倾向相关。
干扰素通路基因:IFNK是CLE与SLE共有的风险位点。
致病机制核心——Ⅰ型干扰素(IFN)信号通路
I型干扰素通过其受体(IFNAR)激活JAK1和TYK2,导致STAT1/2磷酸化并与IRF9形成复合物,入核后诱导干扰素刺激基因(ISGs)表达。ISGs的慢性上调即为“IFN特征”。该特征在CLE患者的皮损处及非皮损、避光皮肤中均能被强烈检测到,甚至在具有自身抗体但未达狼疮诊断标准的“不完全性狼疮”患者中也有增强。
I型干扰素是关键的炎症介质,能影响髓系细胞活化与代谢、T细胞极化,并提高组织对刺激的敏感性。靶向该通路的药物在难治病例中疗效显著,进一步证实了其在CLE发病中的重要性。
I型干扰素可由角质形成细胞、基质细胞及免疫细胞产生。研究发现,除浆细胞样树突状细胞外,其他髓系细胞是狼疮皮肤中I型干扰素的主要产生者(图2)。
I型干扰素的产生由识别不同来源核酸的内源性免疫机制触发:
胞质RNA可通过TLR3/7/8或胞质感受器(RIG1/MDA5-MAVS)诱导IFN。
胞质DNA(如微生物或线粒体来源)被环鸟苷酸-腺苷酸合酶(cGAS)识别,通过环鸟苷酸-腺苷酸(cGAMP)激活STING-TBK1-IRF3通路。
Z-DNA结合蛋白1(ZBP1)通过结合Z构象DNA促进IFN信号与细胞死亡。
这些感受器的表达与信号传导受到严格调控。其抑制因子的破坏或感受器本身(如cGAS、ZBP1)被IFN诱导后慢性过度表达,形成前馈式自分泌循环,可能驱动了狼疮皮肤中I型干扰素的慢性激活循环。
CLE与SLE中的非病灶性皮肤功能障碍
非病灶性狼疮皮肤角质形成细胞存在内在失调,这种失调在培养中持续存在,可能由表观遗传修饰驱动。部分功能障碍源于IFN-κ的慢性上调,阻断IFN-κ可使紫外线诱导的炎症反应恢复正常。
单细胞RNA测序研究表明,非皮损区角质形成细胞产生的富含干扰素的环境,会促使皮肤浸润的非经典单核细胞获得促炎特性并转化为CD16+树突状细胞,其是狼疮中的致病性免疫细胞。研究还发现,非病变皮肤存在Hippo信号通路的表观遗传失调,这可能增加细胞凋亡倾向。此外,SLE基底层角质形成细胞中过氧化物酶体增殖物激活受体γ(PPARγ)水平受抑制,也可能促使其干扰素产量增加(图2)。这些功能失调的角质形成细胞持续分泌I型干扰素,可激活树突状细胞并影响髓系细胞异常分化。总体模型显示,这种持续的低水平干扰素分泌使个体在紫外线等外部刺激下更易发生强烈的炎症反应。
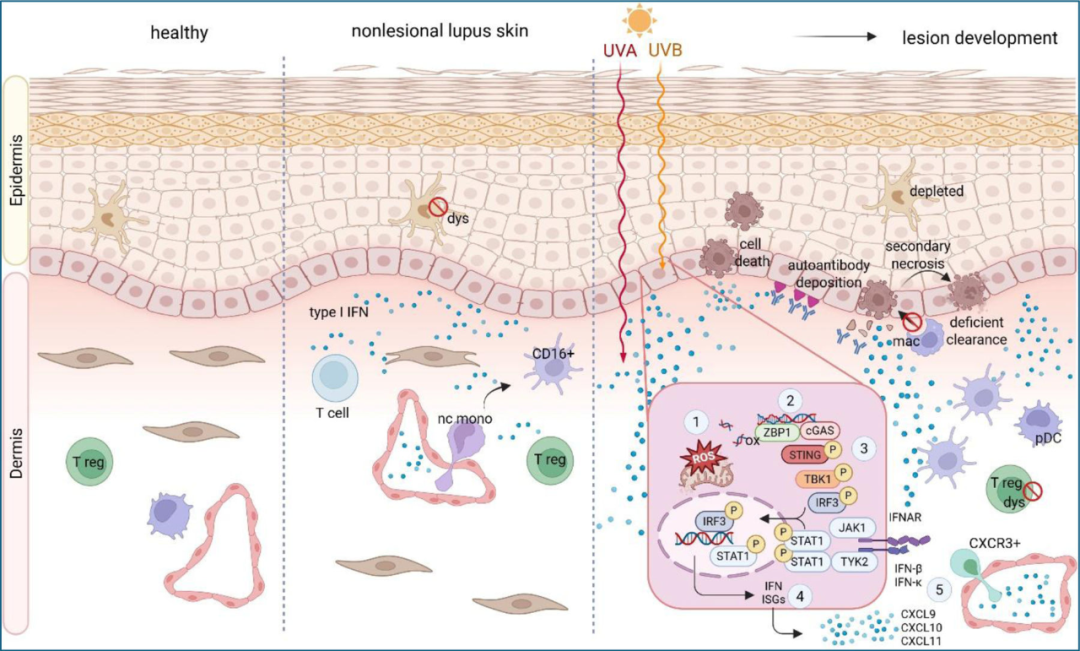
图2 狼疮患者的非病变皮肤表现出较高的I型IFN评分、功能失调的朗格汉斯细胞和可能来自非经典单核细胞的CD 16+单核细胞数量增加。
皮肤病变的诱发因素
(一)紫外线辐射
对紫外线(UV)辐射的光敏感性是CLE的核心特征之一,可影响81%的患者,且与肤色无关,甚至引发SLE患者的系统性发作。
CLE/SLE的光敏感性在临床上定义为:出现符合CLE组织学特征的光分布性皮疹,和/或伴有延迟出现的全身症状。这需与晒伤等其他即刻性光敏反应相鉴别。
潜在机制涉及紫外线(UVB和UVA)对角质形成细胞的影响。研究发现,狼疮角质形成细胞在UVB照射后会产生超强的炎症性免疫反应,干扰素和趋化因子分泌显著增强。干扰素在紫外线诱导的细胞死亡增加和T细胞活化中起关键作用(图2)。
机制上,紫外线辐射可通过cGAS通路触发炎症,而I型干扰素(在狼疮皮肤中本就增高)会进一步通过Z-DNA结合蛋白1(ZBP1)加剧这一过程(图2)。紫外线会导致线粒体应激,促使线粒体DNA以Z型构象释放。Z-DNA与ZBP1结合后,会强烈激活cGAS,导致剧烈的I型干扰素和炎性细胞因子产生。ZBP1在CLE及皮肌炎等光敏性疾病中均有上调(图2)。
此外,紫外线照射后,凋亡的角质形成细胞会在细胞表面暴露Ro/SSA、La/SSB等自身抗原,这些抗原可被抗体结合形成免疫复合物。紫外线还能诱导表皮邻近细胞(包括具有耐受性的表皮朗格汉斯细胞)功能失调,削弱其对角质形成细胞的保护作用,从而放大光敏反应。
在表皮之外,狼疮样的高干扰素环境会扭曲髓系细胞的募集和功能,使其产生促炎而非抗炎反应。同时,慢性I型干扰素暴露也会导致调节性T细胞功能障碍,并激活T细胞,加剧紫外线诱导的炎症。近期研究还提示,淋巴流动性降低也可能是自身免疫性光敏感性的一个潜在促进因素。
(二)金黄色葡萄球菌
SLE患者的皮肤微生物群与健康人不同。金黄色葡萄球菌作为一种常见定植菌,可能参与CLE的发病机制。
SLE患者中该菌定植率更高,鼻腔携带会增加皮损复发风险。CLE皮损处也常被该菌定植。其产生的介质可诱导炎症和I型干扰素生成,破坏皮肤屏障并增强对SLE角质形成细胞的黏附。使用局部抗生素莫匹罗星清除皮损处的金黄色葡萄球菌后,可观察到I型干扰素相关基因表达下降、炎症减轻及皮肤屏障功能改善。这表明该菌的定植会形成一个加剧干扰素产生和炎症的正反馈循环。
小鼠动物实验也支持其致病作用。反复暴露于该菌蛋白可诱发狼疮样表现。即使在无感染的情况下,其定植也可能引发多器官的无菌性炎症。干扰素表达增加可能促进该菌的皮肤浸润与扩散。紫外线、吸烟等其他已知诱因会破坏皮肤屏障,可能进一步影响微生物的相互作用。
(三)吸烟
吸烟会增加CLE和SLE的发病风险及疾病活动度,并与特定皮损类型(如盘状、肿胀型)及光敏感相关。
当前吸烟的SLE/CLE患者病情更重,生活质量更差,且烟草暴露会以剂量依赖方式加剧皮肤炎症与损伤。吸烟还会降低治疗效果:它会显著削弱抗疟药(如羟氯喹)的疗效,导致吸烟者治疗反应率远低于非吸烟者。吸烟同样可能限制甲氨蝶呤、霉酚酸酯等其他免疫抑制剂的作用。
机制上,研究发现吸烟与SLE患者皮损加重、BAFF水平升高及IFN-γ降低独立相关。具体作用通路仍需进一步研究。这些发现强调了戒烟对于改善SLE和CLE患者皮肤病预后的重要性。
(四)病变皮肤
病变皮肤中的炎症回路:CLE皮损存在显著的炎症回路,涉及角质形成细胞、成纤维细胞、髓系细胞、T细胞和B细胞的相互作用。
角质形成细胞通过高表达CXCL9/10/11等趋化因子,招募CXCR3+细胞毒性T细胞。其产生的III型干扰素也可能促进趋化因子过表达。基底细胞空泡变性和凋亡物质清除不足导致细胞碎片积累,持续激活先天免疫通路。
免疫复合物沉积于表皮-真皮连接处,可能与角质形成细胞表面自身抗原(如Ro/SS-A, La/SS-B)暴露及吞噬功能不足有关。TNF-α能增加这些抗原的表达。
皮损区T细胞数量增加。CD8+ T细胞通过释放颗粒酶B和穿孔素直接造成损伤。CD4+ T细胞主要为Th1型,其产生的干扰素γ可被I型干扰素进一步放大,增强细胞毒性。但皮损T细胞也表现出活化程度相对较低和耗竭状态。IL-17A表达虽有报道,但其产生量低,且靶向IL-17通路的治疗未显示显著临床获益。
髓系细胞中,浆细胞样树突状细胞(pDCs)曾被认为是I型干扰素的主要来源。但新证据表明,在CLE皮损中,pDCs产生的干扰素水平低于其他髓系细胞或角质形成细胞,且来自患者的pDCs呈现功能耗竭表型(干扰素产生和T细胞激活能力下降)。靶向pDC药物(如利替利单抗)的疗效机制是否特异于pDC尚需更多数据。
炎症加剧还因免疫耐受机制受损。皮损处朗格汉斯细胞减少。调节性T细胞(Tregs)数量正常但功能失调(图3),表现为高干扰素特征和耗竭,可能与慢性干扰素暴露及代谢改变(如糖酵解增加)有关。初步研究提示调节Treg代谢可能改善皮损。
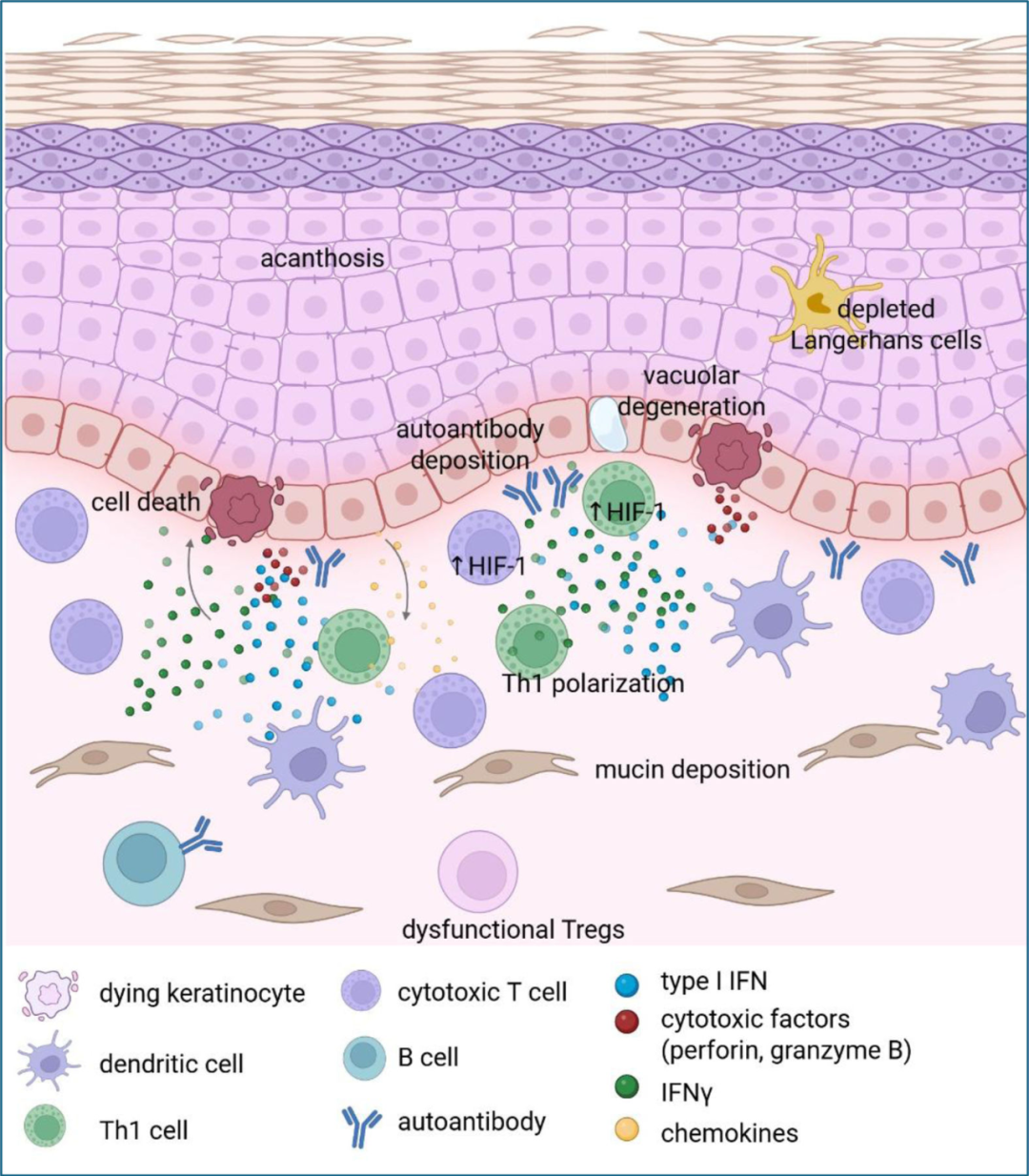
图3 狼疮皮损中的炎症回路。
CLE的治疗需采取多模式策略,包括避免诱因及根据个体情况使用局部和全身治疗。除羟氯喹外,目前尚无其他FDA批准的CLE疗法。但靶向I型干扰素通路等新疗法已显示出前景。
1.常规疗法
局限性皮损:首选外用糖皮质激素或钙调神经磷酸酶抑制剂(如他克莫司、吡美莫司)。
广泛性或难治性病例:首选口服抗疟药羟氯喹(HCQ),其通过干扰溶酶体功能抑制免疫细胞活化和I型干扰素产生。
2.二线治疗
对上述药物疗效不佳者,可使用甲氨蝶呤、硫唑嘌呤等免疫抑制剂。
治疗反应预测:
某些自身抗体(如抗dsDNA、抗Smith抗体)阳性可能提示对抗疟药反应较差。特定的细胞与分子特征(如高表达TNF的髓系树突状细胞增多)也可能与耐药有关。
3.新兴疗法
主要聚焦靶向免疫调节,尤其是I型干扰素通路。
单克隆抗体:Anifrolumab(抗IFNAR)、贝利尤单抗(抗BLyS)、Litifilimab(抗BDCA2)等,部分已在临床试验中显示出改善皮损的效果。
小分子抑制剂:如TYK2抑制剂氘可来昔替尼、TLR7/8抑制剂Enpatoran等。
深度B细胞清除疗法:如CD19靶向CAR-T疗法,在个案报告中显示出使SLE皮肤表现完全消退的潜力。
4.从治疗转向预防
皮肤炎症变化可能早于皮损出现。动物模型表明,皮肤炎症可诱发全身性免疫激活。一项观察性研究提示,早期使用羟氯喹治疗孤立性CLE可能降低其进展为SLE的风险。未来需要更多前瞻性研究来明确治疗CLE是否能预防SLE,新型靶向药物为此提供了更多可能性。
对于CLE患者而言,治疗前景日益明朗。目前对疾病的认识仍在不断深化,已涌现出许多包含靶向治疗在内的可能改变患者生命的治疗方案。未来的研究将致力于明确CLE中确切的致病细胞群体及其在不同亚型间的差异,为实现个体化治疗、乃至免疫重置或治愈创造可能。推动自身免疫性疾病的研究与投入,是实现这一突破性进展的关键。
参考文献:
Klein B, Billi AC, Abernathy-Close L, Kahlenberg JM. Cutaneous lupus erythematosus - from pathogenesis to targeted therapy. Nat Rev Rheumatol. 2025 Dec;21(12):703-718. doi: 10.1038/s41584-025-01318-6.
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)