儿童肥胖增加了终生患代谢性疾病的风险,但其对肝脏衰老的直接影响尚不清楚。尽管肠道菌群调节代谢衰老,但肥胖所改变的微生物群如何加速与年龄相关的肝脏病理变化仍需机制研究。
采用已建立的新生仔鼠过度喂养模型,通过减少窝仔数诱导儿童期肥胖。在出生后第3天,将小鼠窝仔数标准化为每窝3-4只(营养过剩组)或8-9只(正常营养对照组)。对老年雄性小鼠(24-28月龄)进行综合表型分析,包括:生存分析、
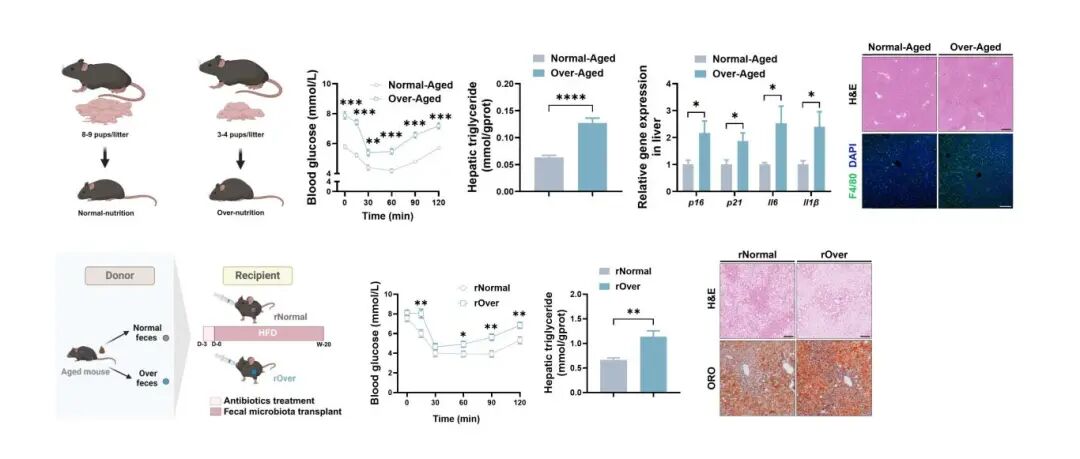
生存分析表明,新生儿期热量过剩显著降低老年小鼠的中位寿命。与正常营养对照组相比,老年营养过剩小鼠表现出加速的代谢功能障碍,包括肥胖、严重的胰岛素抵抗、
FMT研究表明,rOver小鼠出现严重的代谢紊乱,包括肝肿大、肝脏甘油三酯含量增加、胰岛素敏感性受损和进行性MASLD。值得注意的是,rOver小鼠表现出明显的肌肉减少症表型。基于16S rRNA测序分析显示,营养过剩队列中Akkermansia显著耗竭。这些微生物差异在FMT受体中依然持续存在,rNormal小鼠的Akkermansia丰度显著高于rOver小鼠。
本研究证实生命早期营养过剩可重新编程全身衰老轨迹,确立了肠道菌群在驱动并发的肝脏代谢功能障碍与肌肉减少症进展中的因果作用。
本研究通过严谨的实验设计,首次系统阐明了新生儿期过度喂养如何通过重塑肠道菌群,进而程序化地加速机体代谢衰老及肝脏病理进程。该研究将生命早期营养、肠道微生态与老年期肝脏代谢异常与肌少症有机联系,为理解衰老的发育起源提供了关键证据。
在研究设计上,我们采用“减少窝仔数”这一经典模型模拟新生儿期过度喂养,并前瞻性追踪至极老龄阶段,实现了从生命早期到衰老终点的全程观察。生存分析显示,早期过度喂养显著缩短中位寿命,直接证实早期营养状态对生命长度的深远影响。在表型层面,研究不仅观察到老年过度喂养小鼠出现全身性代谢紊乱(如肥胖、胰岛素抵抗、血脂异常),更在器官与分子层面系统揭示了肝脏脂质沉积加剧、炎症细胞浸润增多以及骨骼肌质量与功能显著下降等衰老相关病理改变。尤其值得注意的是,肝脏与骨骼肌组织中细胞衰老标志物及衰老相关分泌表型因子表达同步上调,提示过度喂养可能通过激活细胞衰老程序,共同推动MASLD与肌少症的“共加速”进展。
将老年过度喂养小鼠的肠道菌群移植至年轻受体后,后者在高脂饮食挑战下,竟重现了包括肝脂肪变性加重、胰岛素敏感性下降以及肌肉流失在内的多重加速衰老表型。该结果不仅将肠道菌群从“相关因素”提升为“因果媒介”,也表明早期不良营养所塑造的肠道失调菌群,其致病潜力可长期存在并持续驱动代谢衰老。微生物群落分析进一步揭示,Akkermansia在过度喂养组及其对应受体中均呈现持续性减少,提示该菌的耗竭可能是介导不良代谢程序与加速衰老的关键环节。
综上所述,本工作创新性地构建了“早期营养—肠道菌群—MASLD和肌少症”这一科学框架,强调生命早期干预的长期健康价值,并指出以Akkermansia为代表的特定肠道微生物或其下游通路,有望成为延缓肝脏和肌肉代谢性衰老的潜在干预靶点。


范建高 教授
参考文献:
Jiangao Fan,Cen Xie,Yameng Liu,Jingyi Xu. NEONATAL OVERFEEDING ACCELERATES AGE-RELATED LIVER PATHOLOGIES AND METABOLIC DYSFUNCTION THROUGH GUT MICROBIOTA.AASLD 2025, Abstract-4332.
医脉通是专业的在线医生平台,“感知世界医学
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)