获得性
研究背景
研究表明,SAA患者的早期造血干/祖细胞水平显著下降,而血小板生成素(TPO)及其受体激动剂EPAG可刺激造血功能并在成人SAA中显示良好疗效4-6。然而,尽管研究显示IST联合EPAG可显著提高成人SAA患者的应答率至80%以上7,儿童SAA患者中的疗效仍存在争议且数据有限,尚未明确最佳治疗策略8,9。为了评估EPAG联合IST在儿童SAA患者中的疗效和安全性,土耳其小儿血液学学会骨髓衰竭科学工作组开展了一项回顾性研究并与单纯IST治疗进行比较。
研究方法
本研究为多中心回顾性研究,评估了EPAG联合IST治疗儿童SAA患者的安全性和疗效,并与标准IST治疗组进行了比较。共有16个儿童血液学中心参与本研究。第1组由接受EPAG+IST作为一线治疗的儿童SAA患者组成;第2组为历史对照组,接受标准IST一线治疗的儿童患者。同时,根据研究中中位年龄8.95岁进行了亚组分析,以评估年龄对治疗结果的影响。
研究结果
1. 患者特征
本研究共纳入95例儿童SAA患者,根据治疗方案分为两组:38例接受EPAG联合IST(第1组),57例接受标准IST(第2组)。两组患者在诊断时年龄、
总体来看,两组患者基线特征相对可比,仅血小板计数存在轻微差异。
2. 血液学反应
EPAG+IST组患者在3个月和6个月时的完全缓解(CR)及总缓解率(ORR)均高于IST组(P=0.02)。具体而言,EPAG+IST组CR率在3个月为15.6%,6个月为48.1%,而IST组分别为1.8%和13.3%(P=0.01,P=0.002)。这些结果表明,EPAG联合治疗不仅能提高应答率,更能显著加快血液学恢复速度。
3. 总生存(OS)与无事件生存(EFS)
OS率:EPAG+IST组1/2/5年OS率分别为89.2%、86.5%、82.6%;IST组分别为80.4%、74.7%、72.2%。
EFS率:EPAG+IST组1/2/5年EFS率分别为81.1%、78.4%、74.3%;IST组分别为71.3%、65.4%、53.5%。
两组在长期随访中,EPAG联合组在各时间点均呈现数值上的优势趋势(如5年EFS率:74.3% vs. 53.5%),提示其长期价值仍值得进一步研究。
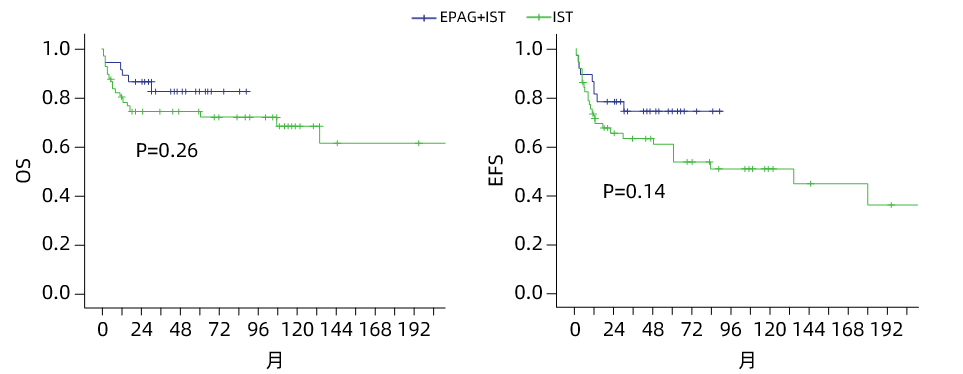
图1 各治疗组OS与EFS比较3
4. 亚组分析
亚组分析显示,年龄>8.95岁的儿童在EPAG+IST组中,6个月和1年ORR显著更高(P=0.012和P=0.010)。整个EPAG+IST组的6个月和1年应答率也显著高于年龄<8.95岁的患者(P=0.007和P=0.005)。不同年龄亚组间OS无显著差异,但接受IST治疗的年轻患者EFS更好(P=0.006)。整体上,年长儿童对EPAG联合治疗的获益更为显著。
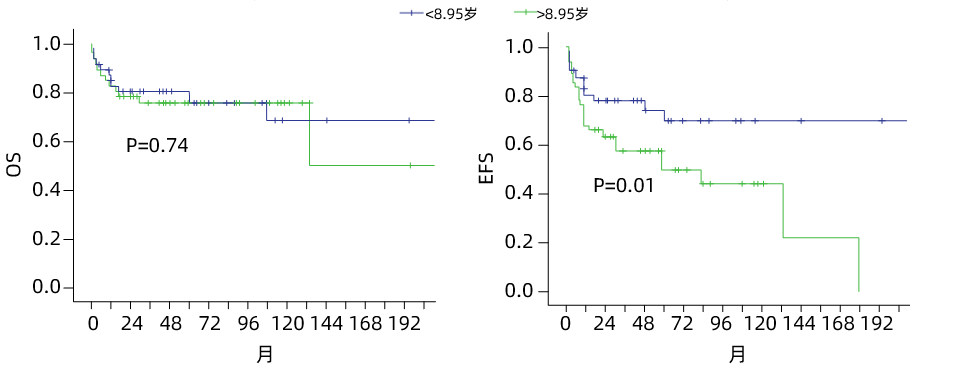
图2 按中位年龄分组(亚组1:<8.95岁;亚组2:>8.95岁)比较OS与EFS3
结论
与单独使用IST相比,EPAG联合IST能够更快诱导治疗反应,且不会增加毒副作用。值得注意的是,在EPAG+IST组中,诊断时年龄较大的儿童与更高的治疗应答率显著相关。未来大规模、前瞻性、多中心研究有望进一步确证其在儿童SAA一线治疗中的优势地位。
SAA是一种以急性起病、免疫介导为主的造血干细胞缺陷性疾病,病情进展迅速,若不及时治疗可导致严重并发症甚至死亡。在儿童患者中,疾病表现和治疗反应存在较大异质性,因此选择较优一线治疗策略对于改善短期和长期预后至关重要。传统一线治疗以IST为核心,包括抗胸腺细胞球蛋白联合
在儿童SAA中,最新的多中心回顾性研究同样提示EPAG联合IST在早期即可带来更高的完全缓解率和总体应答率,尤其在年长儿童中优势更为明显。虽然长期随访中,两组在OS和EFS方面的差异尚未达到统计学显著,但EPAG联合组在多个结局指标上均表现出更积极的趋势,至少显示其疗效不逊于单纯IST,更重要的是显著改善了早期造血恢复。整体而言,EPAG的核心价值在于加快应答、缩短造血低谷期,从而帮助儿童患者更快度过最危险的阶段。
在安全性方面,EPAG表现令人鼓舞。儿童患者总体耐受性良好,未观察到严重毒副作用增加。最常见的不良事件是可逆性的肝功能异常和
总的来说,EPAG联合IST能够显著提升儿童SAA患者的早期血液学应答率,特别是在年长儿童中效果更加突出。其在保证安全性的同时加快造血恢复,为优化儿童SAA的一线治疗策略提供了坚实依据。未来的大规模、多中心前瞻性研究将进一步明确其长期预后价值,并有望推动EPAG成为儿童SAA一线治疗的重要组成部分。
尽管EPAG联合IST在儿童SAA的早期血液学反应中显示出优势,但本研究结果表明,长期随访中无论是OS还是EFS,在EPAG联合IST组与单独IST组之间均未显示显著差异。这一发现与部分先前儿童研究一致8,9,提示EPAG的主要优势体现在早期反应和血液学恢复速度方面,而对长期生存及复发率的影响有限。
目前可获得的临床资料显示,EPAG在儿童群体中的耐受性总体良好。这一点对于长期需要多线治疗、器官储备相对有限的儿童尤为重要。值得强调的是,研究并未发现EPAG显著增加克隆性演变的风险,这在一定程度上缓解了人们对于“促增殖药物”在骨髓衰竭背景下应用的顾虑。
值得注意的是,儿童人群对EPAG的疗效存在一定差异。年长儿童通常应答率更高,这可能与免疫成熟度、造血干细胞储备以及药物代谢相关。这也凸显了个体化治疗的重要性:对于造血恢复缓慢或临床高风险的患儿,EPAG或许能显著缩短造血低谷期,降低感染和出血风险。
未来,儿童SAA的治疗策略应当更加精准化。一方面,需要通过多中心、前瞻性试验进一步明确EPAG在不同年龄层、不同危险分层患儿中的真实价值;另一方面,应探索生物学标志物来预测应答,从而筛选最适合的受益人群。此外,还需评估EPAG的最佳用药时机、疗程长度以及停药后的维持情况,以优化治疗决策。
总体而言,EPAG联合IST不仅能够加快血液学恢复,还具备良好的安全性和可控的耐受性,为儿童SAA治疗提供了重要的新选择。随着未来更多循证研究的推进,EPAG有望进一步巩固其在儿童SAA一线治疗体系中的地位,并推动整体预后的持续改善。
专家介绍
叶宝东 教授

孙慧平 教授
上海交通大学医学院附属瑞金医院血液科副主任医师
上海瑞金医院舟山分院血液科执行主任
中国医药教育协会止血与血栓分会常务委员
亚太医学生物免疫学会血液病分会常务委员
中华中医药学会血液病分会委员
参考文献
1. Masmas, T., et al. EWOG-SAA: Consensus for the treatment of SAA (2023): 1-20.
2. Killick, Sally B., et al. British journal of haematology 172.2 (2016).
3. Atay, Didem, et al. Turkish Journal of Hematology 42.3 (2025).
4. Townsley, Danielle M., et al. New England Journal of Medicine 376.16 (2017): 1540-1550.
5. Alexander, Warren S., et al. (1996): 2162-2170.
6. Qian, Hong, et al. Cell stem cell 1.6 (2007): 671-684.
7. Li, Xiaoli, et al. Annals of Hematology 103.9 (2024): 3483-3491.
8. Groarke, Emma M., et al. British journal of haematology 192.3 (2021): 605-614.
9. Zhao, Yufei, et al. Frontiers in pediatrics 10 (2023): 1095143.
10. Babushok, Daria V., et al. Blood Advances 8.15 (2024): 3946-3960.

戳“阅读原文”,查看更多内容
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)