原发性骨髓纤维化(primary myelofibrosis, PMF)是一种起源于造血干细胞阶段的克隆性
迄今尚无PMF的流行病学调查资料。估算的欧洲PMF的年发病率为(0.1~1)/10万。 估算的美国每年患者数约为13000例。中位发病年龄为69~76岁。本病病因不明。
采用WHO(2022)标准(表1)。
表1 PMF诊断标准*(WHO 2022)

*诊断需要满足3条主要诊断标准和至少1条次要诊断标准
Pre-PMF:原发性骨髓纤维化,纤维化前期;Overt-PMF: 原发性骨髓纤维化,明显纤维化期;MPN:骨髓增殖性肿瘤;MDS:骨髓增生异常综合征/肿瘤
PMF患者确诊后应根据国际预后积分系统(IPSS)、动态国际预后积分系统(DIPSS)或DIPSS-Plus预后积分系统(表2)对患者进行预后分组。IPSS 适合初诊患者,而DIPSS和DIPSS-Plus则适合患者病程中任一时点的预后判定。新近又提出了MIPSS70和 MIPSS-70+ version 2.0两个预后积分系统,分别适合有可供分析的细胞遗传学和分子学检查结果的≤70岁和>70岁患者的预后危度分组。评分细则 MIPSS70 为 HGB<100g/L、外周血原始细胞比例≥2%、骨髓纤维化水平≥2、体质性症状、缺少1型CALR突变、1个高分子危度(high-molecular-risk,HMR)突变(包括ASXL1、SRSF2、EZH2或IDH1/2)突变各赋值1分,白细胞>25×109 /L、血小板<25×109 /L和≥2 个HMR突变各赋值2分,根据累积积分将患者分为低危组(0~1分)、中危组(2~4 分)和高危组(≥5 分);MIPSS-70+ version 2.0 为中度
表2 国际预后积分系统(IPSS)和动态国际预后积分系统(DIPSS)
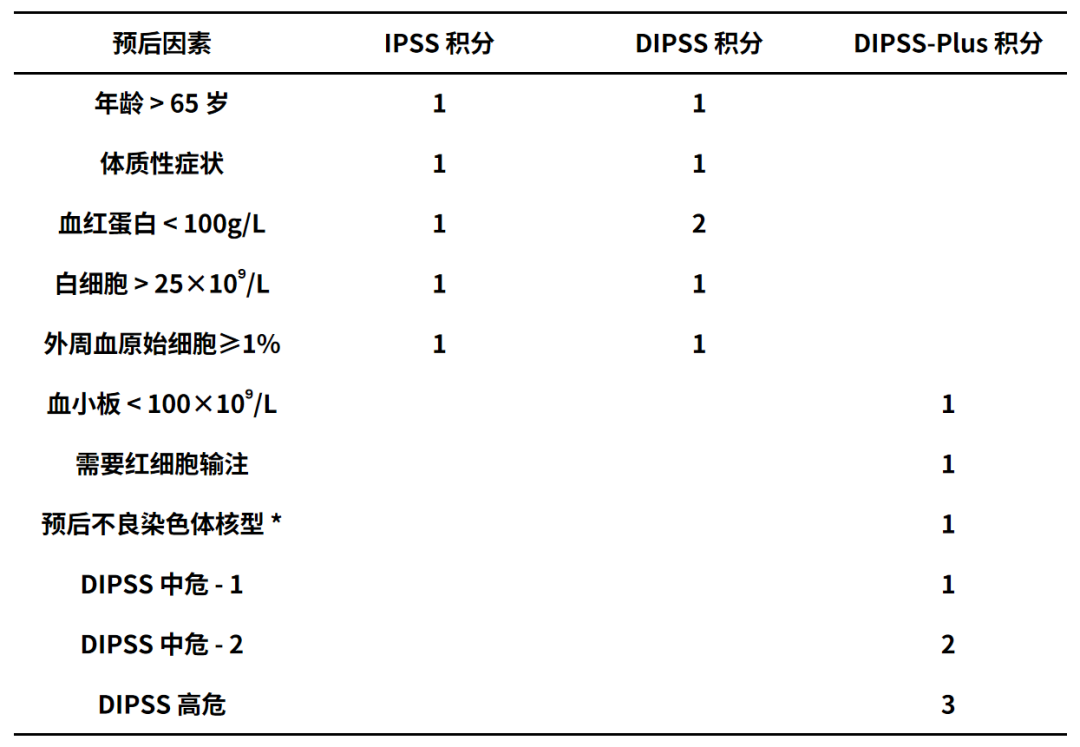
*不良预后染色体核型包括复杂核型或涉及+8,-7/7q-,i(17q),-5/5q-,12p-, inv(3)或 11q23 重排的单个或2个异常。
IPSS分组:低危(0分)、中危-1(1分)、中危-2(2分)、高危(≥3分);
DIPSS分组:低危(0分)、中危-1(1或2分)、中危-2(3或4分)、高危(5或6分);
DIPSS-Plus分组:低危(0分)、中危-1(1)、中危-2(2或3分)、高危(4~6分)。
应综合考虑患者的预后分组(较低危组:DIPSS≤2,DIPSS-plus≤1,MIPSS-70≤3,MIPSS-70+ version 2.0≤3 ;较高危组:DIPSS>2 ,DIPSS-plus>1 ,MIPSS-70≥4 ,MIPSS-70+ version 2.0≥3)、是否存在一系列临床问题(如贫血、
有症状性贫血的患者应输注红细胞,血小板减少性出血或血小板计数 <10×109/L 的患者,酌情输注血小板,有可能接受HSCT的患者应输少白细胞的血制品。 反复感染的患者可采取预防性抗生素。血小板无效输注的出血患者应考虑给予抗纤溶药物。
现今已证实对PMF贫血有效的药物有
雄激素可使1/3~1/2患者的贫血得到改善,糖皮质激素可使1/3严重贫血或血小板减少的患者得到改善,因此,伴贫血和/或血小板减少的患者初治时可联合使用雄激素(
促红细胞生成素(EPO)治疗PMF的观点尚不统一,有作者对已发表文献进行Meta分析的结论是EPO治疗PMF贫血的有效率为30%~40%。主要适用于血清 EPO<100U/L 且有贫血的患者,常用剂量为30000~50000U/周。
小剂量
迄今已获批用于PMF治疗的JAK2抑制剂有
芦可替尼是伴症状性(左上腹痛和脾脏压迫影响进食)或严重(肋下15cm)脾大、 MPN10评分>44或严重瘙痒(>6分)或不是其他原因导致的超预期的体重下降(过去 6 个月内下降>10%)或不能解释的
盐酸吉卡昔替尼获批适应症中危或高危患者,推荐起始剂量为100mg, BID。 Fedratinib\Pacritinib和momelotinib尚未在我国获批上市。Fedratinib获批适应证为中危2和高危患者,推荐剂量为400mg,QD。Pacritinib获批适应证为中危-2和高危且血小板计数 ≤50×109/L患者,推荐剂量为200mg,b.i.d.。momelotinib 获批适应证为中危2和高危患者,推荐剂量为200mg,QD。
allo-HSCT是目前唯一可能治愈PMF的治疗方法,但它合并有相当高的治疗相关死亡率和罹病率。适应证为年龄<60 岁的较高危患者, 以及或是输血依赖或是有不良细胞遗传学和/或分子学异常的患者。此外,是否选择 HSCT 还必须考虑其他可导致allo-HSCT失败的不良因素,包括红细胞输注负荷,重度脾大,使用非HLA相合的同胞供者,造血干细胞移植合并疾病指数(HCT-CI)评分高,高龄,疾病晚期和非 HLA 完全相合的无关供者。现一般推荐 JAK2 抑制剂作为 HSCT 前桥接治疗, 但尚未形成JAK2抑制剂最佳给药方案共识。如选择 allo-HSCT,应当向有丰富移植经验的医生进行咨询。
是有症状的脾大患者的首选药物之一,该药也用于控制有症状的
IFN-α是Pre-PMF患者有效的降细胞药物,但对有严重贫血或全血细胞减少的严重骨髓纤维化患者疗效极其有限。常用剂量为 3.5×106U/次,每周三次,疗程至少为12个月。
脾切除术的指征包括有症状的
放射治疗可缓解肝、脾大所致的饱胀症状,但症状缓解时间较短(中位期间3~6个月)。脾区照射的总剂量为 0.1~0.5Gy,分为5~10次照射,可出现血细胞减少,其致死率在10%以上。低剂量放疗是PMF相关非肝脾EMH的治疗选择,当出现临床症状时,可采用低剂量病灶局部放疗(0.1~1Gy分为5~10次照射)。
应考虑试验性或姑息性治疗。应考虑对有选择的患者进行JAK2抑制剂联合BCL2抑制剂或去甲基化药物联合BCL2抑制剂或强烈诱导化疗治疗,然后行异基因HSCT进行巩固。对于拟行HSCT的患者,移植前需疾病逆转至慢性期,也许不需达完全缓解。
疗效标准采用 2013 年的骨髓增殖性肿瘤研究与治疗国际工作组 (International Working Group-Myeloproliferative Neoplasms Research and Treatment, IWG-MRT)和欧洲
表3 原发性骨髓纤维化疗效评价标准


戳“阅读原文”,查看更多内容
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)