铁皮石斛衍生碳点通过修复肠道粘膜-上皮-免疫多重屏障缓解结肠炎
Dendrobium Officinale-Derived Carbon Dots Nanozymes Alleviate Colitis by Orchestrating Intestinal Mucus-Epithelium-Immune Barriers
Advanced Science
DOI: https://doi.org/10.1002/advs.202512567 [IF=14.1]
来源:IBD Daily

发表截图
碳点的微小粒径与表面丰富的官能团使其在生物医学领域备受关注,其中,生物质来源的前体因其低毒性、富含杂原子及良好的生物相容而极具潜力,中草药中丰富多样的糖类、酸类、酚类化合物及糖苷类物质在高温条件下会发生脱水反应生成糠醛衍生物,随后进一步聚合形成芳香族结构并碳化形成碳核,是合成碳点的理想前体。
该研究以铁皮石斛为前体通过水热法合成了具有类酶活性的碳点(DO-CDs)。在急性与慢性结肠炎模型中,DO-CDs 通过减少肠道组织中炎症细胞的浸润、促进结肠杯状细胞增殖、上调紧密连接蛋白表达,重构结肠免疫稳态,实现对结肠黏膜屏障、上皮屏障及免疫屏障的修复,进而显著抑制结肠炎进展。该研究为以中草药为前体的碳点作为炎症性肠病的多靶点治疗药物提供了理论基础。
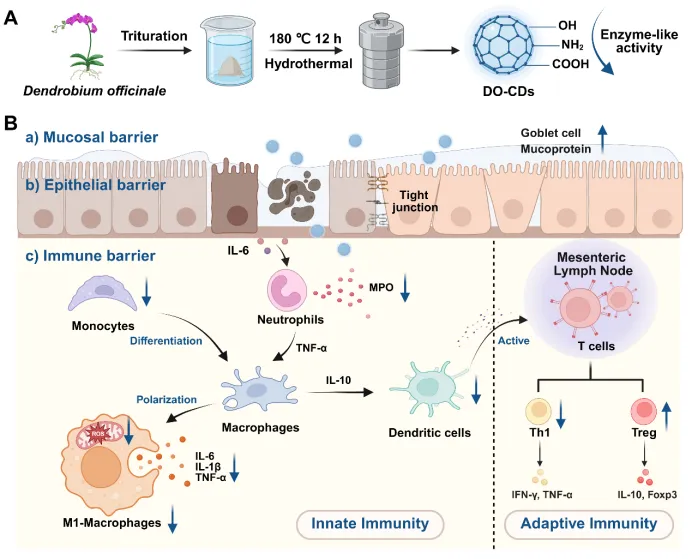
图 1:铁皮石斛碳点(DO-CDs)的合成过程及其治疗结肠炎的生物学机制。(A)采用水热法合成DO-CDs,其表面修饰有羟基、氨基与羰基等官能团。(B)DO-CDs 通过修复多屏障缓解结肠炎进展,具体包括:a)黏膜屏障(增加杯状细胞数量并上调黏蛋白表达);b)上皮屏障(修复细胞间紧密连接蛋白的表达);c)免疫屏障(调控固有免疫与适应性免疫)。
1.DO-CDs的合成与表征
以铁皮石斛为前体通过水热法合成了石斛碳点(DO-CDs)。透射电子显微镜(TEM)结果表明,DO-CDs 分散性良好,呈准球形,基于粒径分布的统计分析,其平均直径为 1.3 ± 0.3 纳米。高分辨率透射电子显微镜(HRTEM)显示 DO-CDs 中存在间距为 0.23 纳米的晶格条纹,与石墨的(100)晶面一致,表明其具有类石墨晶体结构(图 2A)。原子力显微镜(AFM)结果证实了 DO-CDs 的单分散性,其高度与平均粒径一致,表明其呈球形或准球形(图 2B)。为评估 DO-CDs 的稳定性,连续 7 天测量了其 Zeta 电位。结果表明,Zeta 电位无显著变化(图 2C,S1A)。光学表征表明,DO-CDs 的紫外 - 可见吸收光谱在约 280 nm处有一个吸收带,这归因于 sp² 杂化结构的 π-π* 跃迁。在 350 nm的最佳激发下,荧光光谱显示在 438 nm处有一个发射峰(图 2D,图 S1)。上述结果表明成功合成了 DO-CDs。
研究接下来探究了 DO-CDs 的表面结构。拉曼光谱显示在 1335.11 cm⁻¹(D 带,无序缺陷)和 1565.07 cm⁻¹(G 带,石墨结构)处有两个特征峰,I(D)/I(G) 比值为 1.19,表明其表面富含缺陷的石墨结构,这与它们表面存在杂化基团有关(图 2E)。X 射线衍射(XRD)分析显示在 22° 处有一个宽泛的衍射峰,这对应于石墨碳的(002)晶面(图 2F)。这一观察结果表明,DO-CDs 的碳结构主要由富含缺陷的纳米石墨晶体组成,这与生物质水热碳化过程中不完全石墨化过程的观点相符。¹H 核磁共振谱在 6.00 - 7.00 ppm(烯质子)、3.00 - 4.00 ppm(羟基连接的碳)、1.0 - 1.8 ppm(脂肪烃)和 2.0 - 2.5 ppm(羧基/氨基的α-H)之间显示出峰(图 2G)。傅里叶变换红外光谱分析确定了关键的功能基团:在 3350.8 cm⁻¹ 处有一个宽峰(N-H 伸缩)、2930.4 cm⁻¹(C-H)、1616.1 cm⁻¹(C=O)、1600 cm⁻¹(C=N)和 1120 cm⁻¹(C-O)(图 2H)。X 射线光电子能谱证实了碳、氮和氧的存在(图 2I)。高分辨率 C1s 光谱揭示了四个成分:288.8 eV(O-C=O/N-C=O)、286.5 eV(C-O)、285.7 eV(C-N)和 284.6 eV(C=C/C-C)(图 2J)。O1s 谱图在 533 eV(C-O)和 531 eV(C=O)处显示出峰(图 2K),而 N1s 谱图表明存在石墨氮(400.9 eV)和吡咯氮(399.9 eV)(图 2L)。综合这些结构分析表明,DO-CDs 具有富含缺陷的石墨结构框架,并且表面富含多种官能团(氨基、羧基、羰基等),这可能赋予其潜在的药理活性和催化性能。
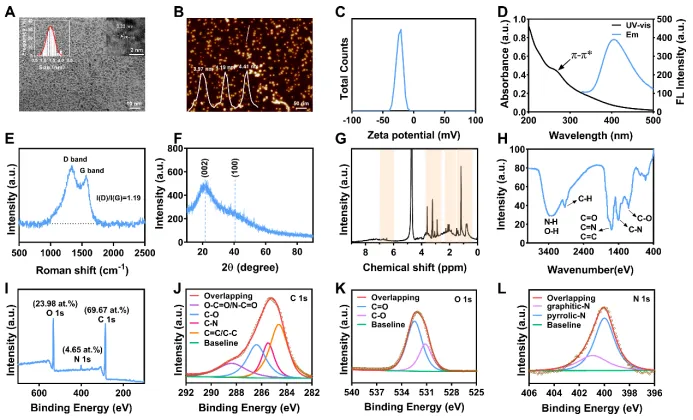
图 2:DO-CDs 的表征。(A)DO-CDs 的透射电子显微镜(TEM)图像(比例尺:10 nm)和高分辨率透射电子显微镜(HR-TEM)图像(比例尺:2 nm,以及尺寸分布直方图。(B)DO-CDs 的原子力显微镜(AFM)图像和分布高度(比例尺:50 nm)。(C)DO-CDs 的 Zeta 电位。(D)DO-CDs 的紫外(黑色)和荧光(蓝色)光谱。(E)DO-CDs 的拉曼光谱。(F)DO-CDs 的 X 射线衍射(XRD)图谱。(G)DO-CDs 的¹H 核磁共振(NMR)谱。(H)DO-CDs 的傅里叶变换红外(FT-IR)光谱。(I)DO-CDs 的 X 射线光电子能谱(XPS)全谱。(J)DO-CDs 的 C 1s 高分辨率 XPS 谱。(K)DO-CDs 的 O 1s 高分辨率 XPS 谱。(L)DO-CDs 的 N 1s 高分辨率 XPS 谱。
2.DO-CDs的抗氧化能力
该研究首先使用 ABTS 测定法评估了 DO-CDs 的总抗氧化能力。将不同浓度的 DO-CDs 与·ABTS⁺共孵,每隔 60 秒测量溶液在 405 nm处的吸光度。结果表明,随着 DO-CDs 浓度的增加,混合物的蓝色逐渐褪去,同时吸光度降低,这表明 DO-CDs 具有出色的整体抗氧化活性(图 3A-C)。
接下来,进一步检验了DO-CDs 的 ROS 清除能力。·O₂⁻ 清除能力通过硝基蓝四唑(NBT)法和商业
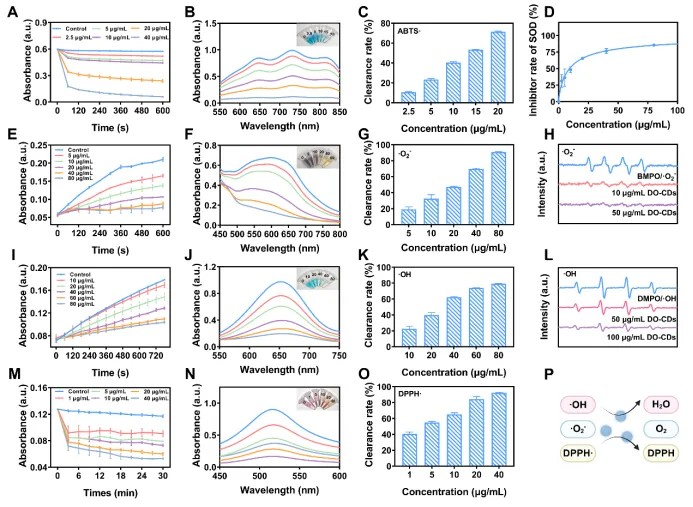
图 3:DO-CDs 的抗氧化能力。(A)动力学曲线,(B)紫外-可见吸收光谱,以及(C)在不同 DO-CD 浓度下 10 分钟内 ⋅ABTS⁺ 自由基的消除效率。(D)DO-CD 的类SOD酶活。(E)动力学曲线,(F)紫外-可见吸收光谱,(G)10 分钟的清除率,以及(H)清除 ⋅O₂⁻ 自由基的 ESR 信号。(I)动力学曲线,(J)紫外-可见光谱模式,(K)12 分钟的清除百分比,以及(L)清除 ⋅OH 自由基的 ESR 信号。(M)动力学曲线,(N)紫外-可见吸收光谱,(O)30 分钟对 DPPH·的抑制率。(P)抗氧化机制示意图。
3.DO-CDs在细胞水平上的抗氧化及抗炎性能
细胞摄取是 DO-CDs 发挥作用的第一步。.研究监测了 DO-CDs-Cy5.5 被 RAW264.7 细胞摄取的情况,在 6 小时时达到 92.7%(图 4A、B)。然后使用 Mito-Tracker 和 Lyso-Tracker 来标记线粒体和溶酶体。DO-CDs 与线粒体共定位的皮尔逊相关系数为 0.96(图 4C-E),而与溶酶体共定位的系数为 0.64(图 4F-H)。这些结果表明,DO-CDs 具有线粒体靶向能力和溶酶体逃逸特性。
为了评估 DO-CDs 在 RAW264.7 细胞中的抗氧化作用,该研究使用了 DCFH-DA 和 DHE 探针来评估细胞内活性氧的清除情。在 DCFH-DA 测定中,H₂O₂ 处理的细胞表现出强烈的绿色荧光,这证实了活性氧水平的升高。与 DO-CDs 共孵育显著降低了这种荧光,表明有效清除活性氧(图 4I)。流式细胞术进一步量化了这一效果(图 4K)。在 DHE 测定中也观察到了类似的结果(图 4J、L)。上述结果表明,DO-CDs 在细胞水平上具有很强的抗氧化能力。
除了产生活性氧外,巨噬细胞极化在炎症性疾病中起着关键作用。通过 CD86 荧光标记评估了 LPS 诱导的 M1 型巨噬细胞极化。DO-CDs 处理降低了 M1 型巨噬细胞的比例(图 4N、O),而M2 型巨噬细胞的数量显著增加(图 S2)。这些结果充分表明,DO-CDs 不仅能显著抑制巨噬细胞向促炎性 M1 型细胞的极化,还能有效地促进其向抗炎性 M2 型细胞的转变,从而在减轻炎症反应方面发挥重要作用。此外,qPCR 分析显示,DO-CDs 在 RNA 水平上显著下调了 LPS 诱导的促炎性细胞因子,如 TNF-α、IL-6 和 IL-1β(图 4P)。总之,DO-CDs 对由氧化应激引起的线粒体损伤和细胞死亡具有保护作用,为将 DO-CDs 用于精确治疗结肠炎提供了证据。
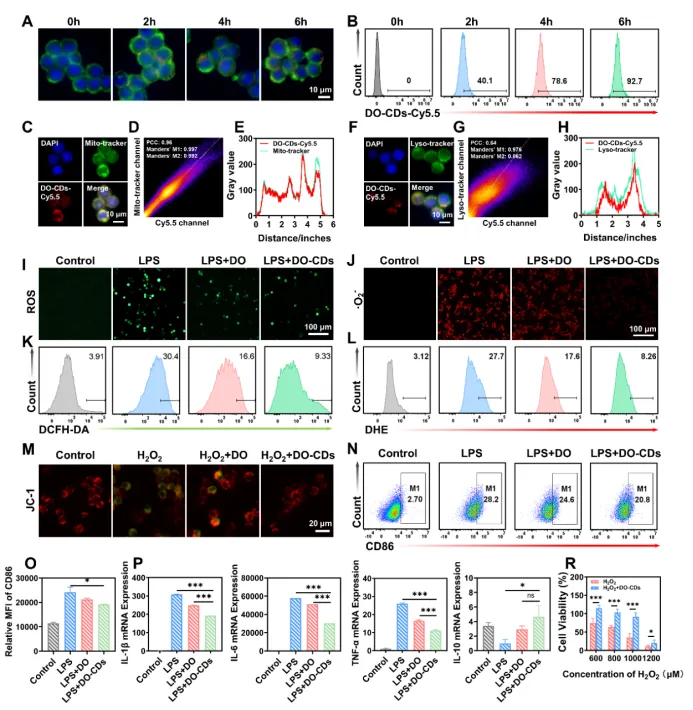
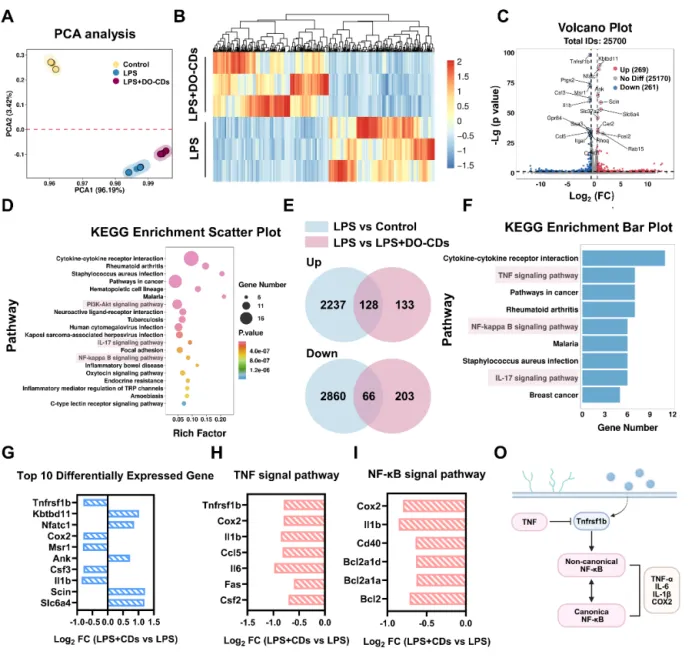
图 4:DO-CDs在细胞水平上的抗氧化和抗炎效果。(A)RAW264.7 细胞对 DO-CDs 的摄取情况(比例尺:10 μm)。(B)使用流式细胞术检测 RAW264.7 细胞中的 DO-CDs-cy5.5。荧光显微镜图像显示 DO-CD 与线粒体(C)和溶酶体(F)的共定位(比例尺:10 μm)。细胞器共分布的定量分析:用于线粒体(D)和溶酶体(G)共定位的皮尔逊相关系数和曼德重叠系数。DO-CD 在线粒体(E)和溶酶体(H)内的分布曲线图。RAW264.7 巨噬细胞内活性氧的可视化:DCFH-DA(I)和 DHE(J)荧光探针(比例尺:100 μm)。使用DCFH-DA 进行细胞内活性氧水平的流式细胞术定量(K)以及通过 DHE 进行超氧阴离子检测(L)。(M)JC-1 染色的 RAW264.7 细胞荧光图像(比例尺:20 μm)。(N)M1 型巨噬细胞的流式细胞术分析和 CD86 标记定量(O)。(P)不同处理下 Raw264.7 细胞中炎症因子 IL-6、IL-1β、TNF-α 和 IL-10 的 qPCR 结果。(R)H₂O₂ 处理后的细胞活力。
4.DO-CDs的生物学机制
为了探究 DO-CDs 如何发挥抗炎和抗氧化作用,该研究对 LPS 刺激的巨噬细胞进行了转录组测序分析。主成分分析显示,三组之间存在显著的特征差异,这表明样本分组是有效的,并为后续分析的科学性提供了统计证据(图 5A)。接下来,比较了 LPS 组和 LPS + DO-CDs 组之间差异表达的基因(图 5B)。与 LPS 组相比,DO-CDs 上调了 269 个基因,下调了 261 个基因,这证明了 DO-CDs 是通过调节特定基因的表达来发挥生物学作用的(图 5C)。为了进一步探究这些差异表达基因的生物学功能,该研究对 LPS 组和 LPS + DO-CDs 组之间的基因进行了 KEGG 富集分析,结果表明 DO-CDs 可能通过 PI3K-Akt、IL-17 和 NF-κB 等信号通路减轻 LPS 诱导的细胞损伤。DO-CDs 可能通过这些炎症通路调节细胞的氧化应激状态(图 5D)。
为了更精确地阐明 DO-CDs 所涉及的生物学机制,该研究利用维恩图(图 5E)分析了在对照组和 LPS + DO-CDs 组中与 LPS 组相比,持续上调或下调的差异表达基因。这些基因表明,DO-CDs 主要通过 TNF-NF-κB 信号通路发挥作用(图 5F)。因此,DO-CDs 的潜在治疗机制如下:通过下调 Tnfrsf1b 的表达,干扰非经典 NF-κB 通路的上游激活节点,从而抑制这两个通路的协同激活,最终实现炎症水平的系统性降低(图 5O)。
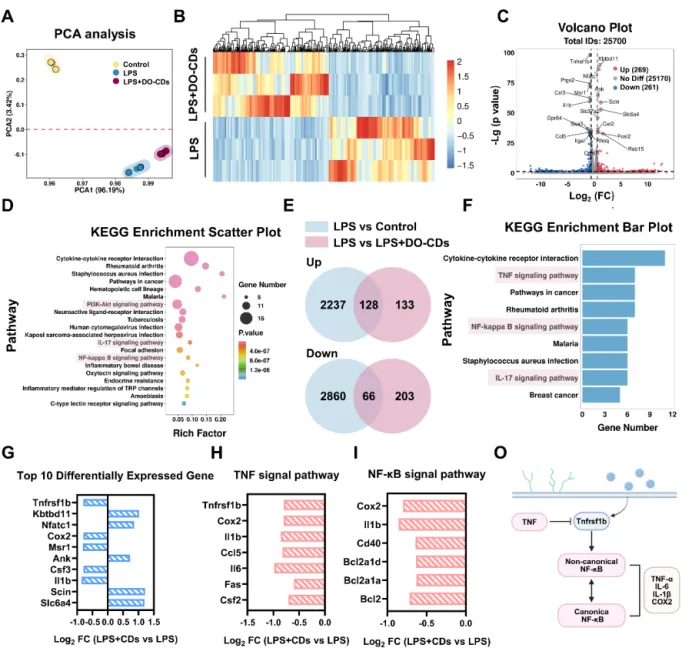
图 5:通过转录组测序分析 DO-CDs 的生物学机制。(A)对“对照组”、“LPS 组”和“LPS + DO-CDs 组”进行主成分分析。热图(B)和火山图(C)显示了“LPS 组”和“LPS + DO-CDs 组”之间差异表达基因的差异情况。(D)KEGG 富集分析。(E)维恩图。(F)差异表达基因的 KEGG 富集分析。(G)“LPS 组”和“LPS + DO-CDs 组”之间差异表达的前 10 个基因。(H)TNF 信号通路中的差异表达基因。(I)NF-κB 信号通路中的差异表达基因。(O)生物学机制示意图。
5.DO-CDs 对急性结肠炎的治疗效果
为了在动物层面全面探究 DO-CDs 对结肠炎的治疗效果,该研究通过连续 7 天在小鼠饮用水中加入 2.5% 的葡聚糖硫酸钠(DSS)建立了急性结肠炎模型。模型成功诱导后,进行了为期 4 天的治疗干预,并每日监测体重变化、粪便特征以及疾病活动指数(DAI)(图 7A)。建模后,根据体重变化将小鼠随机分为五组:对照组、DSS 组、DSS + 5-ASA 组、DSS + DO 组和 DSS + DO-CDs 组。
组织采集结果显示,药物干预使体重恢复,其中 DSS + DO-CDs 组的恢复最为显著(图 7B)。同时,DSS + DO-CDs 组的疾病活动指数(DAI)评分也呈现出同步下降的趋势。结果表明,随着体重和炎症状态的改善,小鼠的活力逐渐恢复(图 7C)。同时,结肠长度测量显示,DSS + DO-CDs 组与 DSS 组之间存在显著差异(图 7D)。这表明 DO-CDs 恢复了结肠的长度(图 7E)。
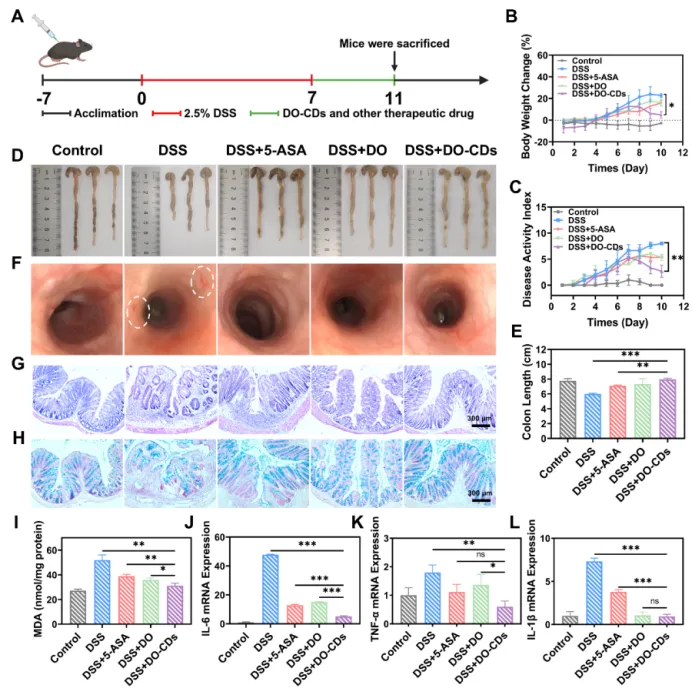
图 6. DO-CDs 对急性结肠炎的治疗效果。(A)实验设计示意图。(B)体重监测。(C)疾病活动指数(DAI)评分。(D)结肠照片及(E)长度统计。(F)
6.DO-CDs对慢性结肠炎的治疗效果
为了探究 DO-CDs 对慢性结肠炎(其特征为持续性和反复性炎症)的治疗效果,建立了慢性结肠炎小鼠模型以更好地模拟病理进程(图 8A)。数据显示,在 DSS 饲喂阶段,小鼠体重显著下降。尽管在恢复期部分体重有所恢复,但由于结肠炎复发,DSS 组在第二轮 DSS 建模后体重恢复明显受阻。相比之下,DSS + DO-CDs 组表现出更优的体重恢复(图 8B)。图 8C 和 8D 展示了各组的结肠形态,表明与 DSS 组相比,DSS + DO-CDs 组的结肠长度有显著增加。内镜检查显示,DSS 组由于慢性反复损伤,出现严重的肠壁出血、组织脆弱和弹性丧失,而 DO-CDs 治疗有效缓解了肠道出血(图 8E)。HE 染色和阿尔辛蓝染色显示,DSS + DO-CDs 组的隐窝结构更完整,黏蛋白含量更高,表明黏膜屏障得到了修复(图 8F、G)。
肠紧密连接蛋白位于肠上皮细胞之间,是肠上皮屏障的关键组成部分。当紧密连接蛋白的表达减少或其结构被破坏时,肠上皮通透性增加,有害物质容易进入血液,引发全身性炎症。对结肠紧密连接蛋白进行免疫荧光染色和 Western blot 分析发现,DO-CDs 治疗后 Occludin、ZO-1 和 Claudin-1 的表达显著上调。这种上调与有害物质从肠腔向固有层的转运减少有关,从而降低了固有层内免疫细胞的活化频率。这些发现表明结肠上皮屏障得到了有效修复(图 8H-L)。由于 M1 巨噬细胞的过度活化与肠壁免疫细胞浸润、隐窝脓肿形成以及黏膜屏障损伤密切相关,DSS + DO-CDs 组中 CD86 标记的 M1 巨噬细胞显著减少表明 DO-CDs 对结肠炎引起的物理屏障损伤具有良好的修复作用(图 8H)。髓过氧化物酶(MPO)是中性粒细胞活化的标志酶,其活性与炎症部位中性粒细胞浸润呈正相关,在 DSS + DO-CDs 组中水平降低,表明中性粒细胞迁移减少,局部炎症减轻(图 8M)。丙二醛(MDA)是脂质过氧化的终产物,反映自由基对生物膜的氧化损伤,在 DSS + DO-CDs 组结肠中水平降低,表明氧化应激状态得到改善(图 8N)。在炎症评估方面,qPCR 数据证实 DO-CDs 显著下调了促炎细胞因子 iNOS、IL-6、IL-1β 和 TNF-α 的表达(图 8O-R)。这些研究结果表明,DO-CDs 治疗在慢性结肠炎病例中能有效恢复黏膜和上皮屏障的完整性。
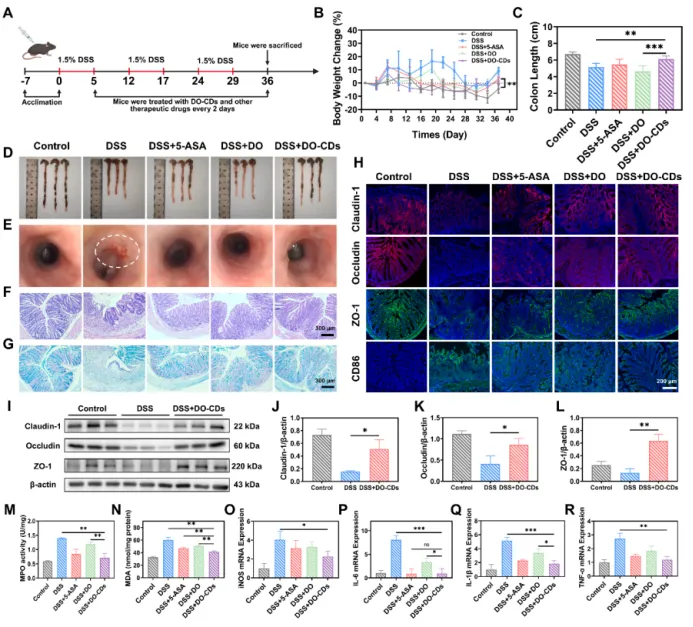
图 7. DO-CDs 对慢性结肠炎的治疗效果。 (A)评估 DO-CDs 在慢性结肠炎模型中治疗效果的实验方案示意图。 (B)体重波动情况。结肠图像(D)和长度测量(C)。 (E)肠道内镜图像。 (F)HE 染色。 (G)阿尔辛蓝染色(标尺:300 μm)。 (H)结肠组织中 occludin、claudin-1、ZO-1 和 CD86 的免疫荧光图像(标尺:200 μm)。 蛋白质印迹分析(I)以及 occludin(J)、claudin-1(K)、ZO-1(L)的定量图表。结肠组织中的 MPO 活性(M)和 MDA 含量(N)。iNOS(O)、IL-6(P)、IL-1β(Q)和 TNF-α(R)的 mRNA 表达水平。
7.DO-CDs对肠道免疫屏障的影响
肠道免疫屏障作为抵御病原体入侵的关键防线,在结肠炎的发病机制中起着核心作用。该屏障不仅能精准识别并清除诸如细菌和病毒等外来病原体,还能在黏膜受损时通过免疫细胞释放的细胞因子和生长因子启动上皮修复程序,从而维持肠道的稳态。肠道免疫屏障由先天免疫系统和适应性免疫系统组成,通过协同机制运作:先天免疫依靠中性粒细胞、巨噬细胞和树突状细胞的快速反应,而适应性免疫则通过 T 细胞亚群在树突状细胞介导的抗原呈递后调节免疫反应。这些系统的动态平衡是肠道免疫稳态的基础,如图 9A 中的免疫细胞相互作用网络所示。
为了研究 DO-CDs 在慢性结肠炎中的免疫调节机制,通过图 S3-6 中的流式细胞术门控策略,该研究分析了不同治疗组中免疫细胞亚群的比例和数量变化情况(图 S3-6)。流式细胞术分析显示,DSS 组和 DSS + DO-CD 组之间固有层中中性粒细胞的比例没有显著差异(图 9B、C),这可能归因于持续的炎症驱动下的中性粒细胞募集动态以及它们较短的寿命,从而维持着“持续募集 - 快速凋亡”的平衡状态。然而在使用 DO-CD 进行治疗后,单核细胞的比例显著降低。单核细胞可以分化为巨噬细胞和树突状细胞。其减少表明 DO-CD 能够有效地抑制免疫反应,从而控制炎症活动并稳定免疫反应(图 9D)。尽管 DSS + DO-CD 组中的巨噬细胞比例未达到统计学显著差异,但它们呈现出下降趋势(图 9E、F),其中促炎的 M1 巨噬细胞和树突状细胞与 DSS 组相比显著减少(图 9G)。这些结果表明,DO-CDs 可以通过调节先天免疫层面的巨噬细胞极化以及抑制树突状细胞的过度激活来中断炎症反应的进程,从而减少抗原呈递、抑制异常的 T 细胞激活,并进一步抑制后续的适应性免疫变化(图 9H、I)。
树突状细胞(DCs)呈递抗原后会激活适应性免疫。该研究使用流式细胞术评估了肠系膜淋巴结中 Th1 和 Treg 细胞的比例。Th1 细胞主要通过分泌以 IFN-γ 和 TNF-α 为主的促炎性细胞因子来维持慢性肠道炎症。其中,IFN-γ 通过细胞间相互作用强化先天免疫的促炎表型,增强抗原呈递能力,并促进免疫细胞向炎症部位的募集。相反,Treg 细胞在结肠炎中是肠道免疫稳态的中心调节因子;它们的缺乏会导致免疫耐受失衡和黏膜屏障损伤。统计结果表明,与 DSS 组相比,DSS + DO-CDs 组的 Th1 细胞比例显著降低,Treg 细胞数量增加,并且 Treg/Th1 比例恢复到正常控制水平(图 9J-N)。这些发现表明,DO-CDs 逆转了巨噬细胞向促炎性 M1 品质的极化过程,加剧了肠道黏膜炎症浸润,并通过双向调节 Th1/Treg 细胞的动态平衡增强了由过度 Th1 细胞激活引起的氧化损伤。这种作用证实了 DO-CDs 在纠正免疫失调方面的治疗能力,并为它们在慢性结肠炎中对黏膜屏障修复的作用提供了直接的免疫学证据。
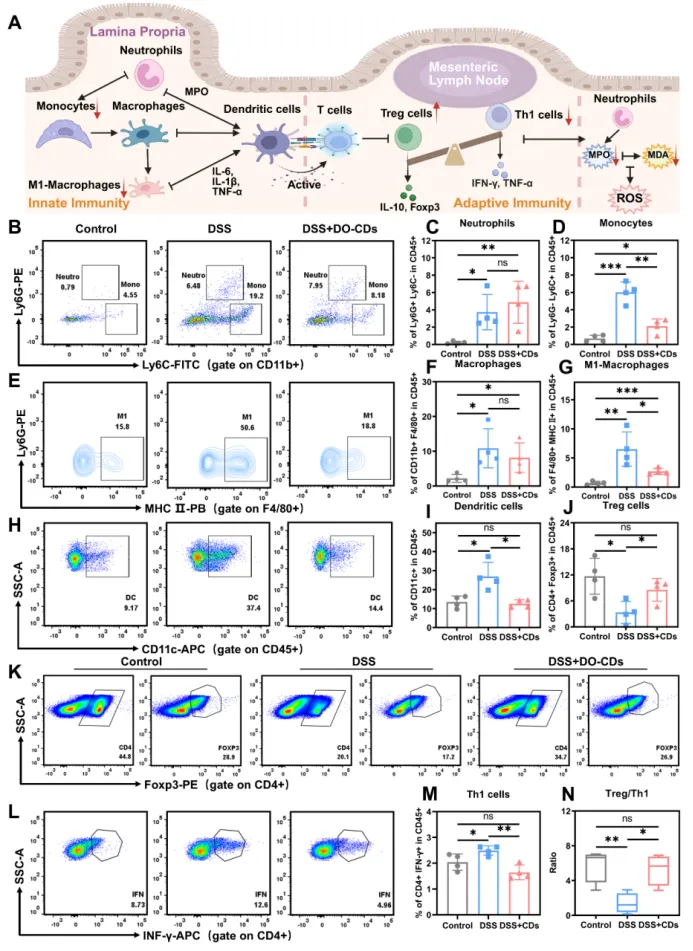
图 8. DO-CDs 对慢性结肠炎中免疫细胞的影响。(A)DO-CDs 对先天免疫和适应性免疫影响的示意图。(B)中性粒细胞和单核细胞的流式细胞术检测。中性粒细胞的统计数据(C)和单核细胞的统计数据(D)。(E)M1 型巨噬细胞的流式细胞术检测。巨噬细胞的统计数据(F)和 M1 型巨噬细胞的统计数据(G)。(H)树突状细胞的流式细胞术检测。树突状细胞的统计数据(I)和调节性 T 细胞的统计数据(J)。(K)调节性 T 细胞的流式细胞术检测。(L)Th1 细胞的流式细胞术检测。Th1 细胞的统计数据(M)。(N)调节性 T 细胞与 Th1 细胞的比例。
总结
该研究通过自由基清除、炎症调节以及肠道屏障修复等机制,系统地评估了 DO-CDs 的治疗潜力,该研究在体内和体外模型中均进行了验证。在 DSS 引发的慢性结肠炎模型中,DO-CDs 有效地降低了 M1 型巨噬细胞的比例,抑制了树突状细胞的激活,恢复了 Th1/Treg 细胞的平衡,并下调了促炎性细胞因子的表达。由于炎症细胞浸润减少,结肠上皮细胞之间紧密连接蛋白的表达增加,促进了肠道机械屏障的修复。同时,杯状细胞分泌的黏蛋白在上皮屏障上形成了保护性的黏液层,恢复了肠道的黏膜屏障。这些结果表明,DO-CDs 通过重塑黏膜-上皮-免疫屏障,减轻了结肠炎的进展,为天然产物衍生的 CD 在生物医学领域的应用提供了理论基础和技术参考。
致谢
西安交通大学张明真&西安医学院第一附属医院张明鑫
团队供稿
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)