10万人群研究证实:低度全身炎症增加银屑病风险,三类标志物可预警
2025-08-01
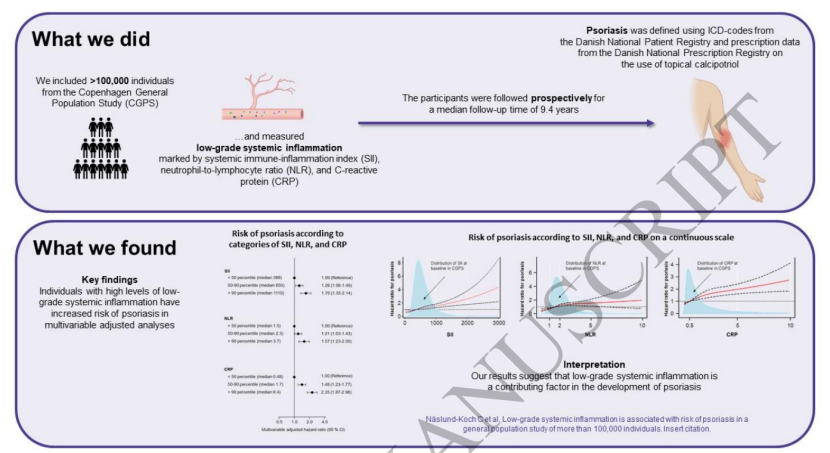
银屑病是一种复杂的多因素自身免疫性疾病,其发病机制涉及适应性免疫和先天免疫机制的失调。近年来,越来越多的研究发现银屑病患者存在低度全身炎症,但这种炎症究竟是皮肤病变的“溢出效应”,还是疾病发生的驱动因素,一直存在争议。近日,发表于《英国皮肤病学杂志》的一项前瞻性队列研究给出了明确答案:在超过10万人的大规模人群中,低度全身炎症是银屑病(尤其是中重度病例)的独立危险因素,系统性免疫炎症指数(SII)、中性粒细胞与淋巴细胞比值(NLR)和C反应蛋白(CRP)这三类炎症标志物可有效预测发病风险。
研究设计:10万人大队列追踪9年,聚焦三类炎症标志物本研究数据来源于哥本哈根一般人群研究(CGPS),这是一项前瞻性队列研究,于2003-2015年间纳入了105,418名20-100岁的丹麦居民,中位年龄58岁,其中55%为女性。研究通过以下方法开展分析:
入组时采集血液样本,检测并计算三类炎症标志物——SII(计算公式:血小板×中性粒细胞/淋巴细胞)、NLR(中性粒细胞/淋巴细胞)和CRP,同时收集性别、年龄、吸烟、饮酒、体力活动、教育水平、高血压、血脂异常、肥胖等潜在混杂因素信息。通过丹麦国家患者登记系统,使用ICD编码(ICD-8:696.09、696.10、696.19;ICD-10:L40)识别银屑病病例;以卡泊三醇(单独或与外用糖皮质激素联用)处方作为轻度银屑病的敏感性分析指标。中位随访9.4年(四分位数范围6.7-11.9年),采用Cox比例风险回归模型计算hazard ratios(HR),评估炎症标志物与银屑病发病风险的关联,并调整潜在混杂因素。
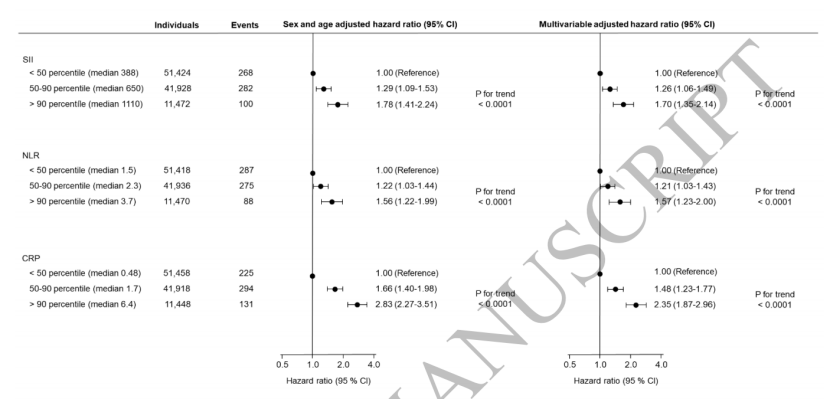
在调整性别、年龄及生活方式等混杂因素后,结果显示:-SII:高水平(≥75百分位数)人群的银屑病发病风险是低水平(<75百分位数)人群的1.40倍(95%置信区间1.19-1.66);-NLR:高水平人群风险为低水平人群的1.30倍(1.10-1.54);-CRP:高水平人群风险达低水平人群的1.75倍(1.48-2.06)。图2 不同分档的SII、NLR、CRP与银屑病发病风险关联
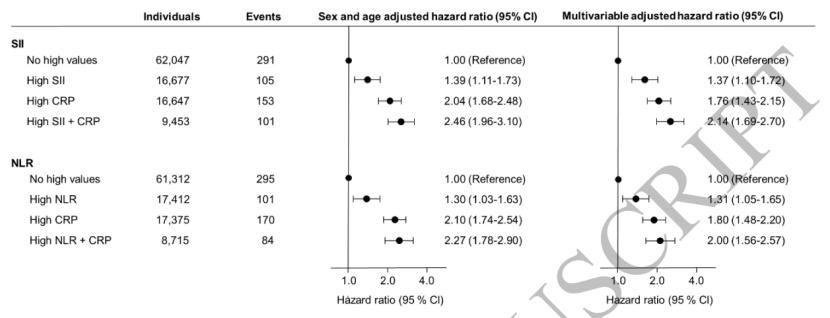
敏感性分析显示,以卡泊三醇处方定义的轻度银屑病中,炎症标志物与发病风险的关联略有减弱(如CRP高水平者HR=1.26);而在医院诊断的银屑病(多为中重度)中,关联强度更高,提示低度全身炎症对中重度银屑病的影响更突出。当SII或NLR与CRP联合分析时,风险进一步升高:-同时存在高SII和高CRP者,银屑病风险是两者均低者的2.14倍(1.69-2.70);-同时存在高NLR和高CRP者,风险为2.01倍(1.58-2.55)。这表明三类标志物联合使用可更精准识别银屑病高危人群(见图3)。图3 SII或NLR与CRP联合升高时的银屑病发病风险
研究团队结合基础免疫机制,对“全身炎症→银屑病”的病理链条提出以下解释:中性粒细胞、淋巴细胞等免疫细胞比例失调(如NLR升高),会打破皮肤局部免疫平衡。例如,中性粒细胞过度活化可释放大量促炎细胞因子(如IL-17、TNF-α),激活皮肤角质形成细胞和树突状细胞,启动银屑病特征性的Th17免疫应答。
CRP作为经典炎症标志物,其水平升高反映体内慢性炎症状态。持续的低度炎症会诱导血管内皮生长因子(VEGF)、趋化因子等表达,促进皮肤血管新生和免疫细胞浸润,为银屑病发生提供“炎症土壤”。
SII综合血小板、中性粒细胞、淋巴细胞的动态变化,更全面反映全身炎症网络。血小板激活后释放的血小板源性生长因子(PDGF),可直接刺激角质形成细胞增殖;同时,血小板与中性粒细胞的相互作用(如形成中性粒细胞胞外诱捕网,NETs),会加剧皮肤局部免疫损伤,最终触发银屑病皮损形成。
对于有银屑病家族史、肥胖、代谢综合征等高危人群,建议定期检测SII、NLR、CRP。当标志物水平持续升高(尤其是联合异常时),需警惕银屑病发病,可结合皮肤镜、皮肤活检等手段早期识别亚临床病变。现有银屑病治疗以皮损局部干预(如外用糖皮质激素、光疗)和系统抗炎(如TNF-α抑制剂)为主。本研究提示,针对全身低度炎症的“上游干预”可能更具价值——未来可探索小剂量抗炎药物(如IL-1抑制剂、JAK抑制剂)用于高危人群的预防性治疗,延缓疾病发生。吸烟、肥胖、缺乏运动等是全身炎症的重要诱因。临床实践中,应强化患者教育:-吸烟者需戒烟,可降低CRP水平约30%-50%;-肥胖患者通过减重(如BMI降低5%-10%),可显著改善NLR、SII等指标;-规律运动(每周150分钟中等强度)能有效抑制慢性炎症因子释放,从源头减少银屑病发病风险。尽管本研究在大样本人群中验证了全身炎症与银屑病的关联,但仍存在以下待解决问题:➤因果关系确认
队列研究虽显示炎症标志物先于银屑病发生,但无法完全排除残余混杂(如未测量的遗传因素、肠道菌群紊乱)。未来需通过孟德尔随机化、干预性试验(如抗炎治疗后观察银屑病发病率变化)进一步确认因果关系。
➤种族与地域差异
研究人群为丹麦白人,结果能否推广至亚洲、非洲等其他种族?不同地域的环境因素(如紫外线暴露、感染流行率)如何影响全身炎症与银屑病的关联?这些需多中心、跨种族队列研究补充。
➤精准阈值界定
目前仅基于百分位数划分标志物水平,缺乏临床实践中“高危/低危”的精准阈值(如CRP具体多少mg/L时银屑病风险显著升高)。后续需结合机器学习,构建个性化风险预测模型,优化临床决策。
本研究通过10万人大队列9年追踪,首次在一般人群中明确:低度全身炎症是银屑病(尤其是中重度)的独立危险因素,SII、NLR、CRP三类标志物可有效预警发病风险。这一发现颠覆了“银屑病仅为皮肤局部疾病”的传统认知,将疾病防控从“被动治疗皮损”前移至“主动管理全身炎症”。未来,随着炎症机制研究深入和精准医学发展,有望通过调控全身炎症微环境,实现银屑病的“源头防控”。临床医生需重视炎症标志物的筛查价值,结合生活方式干预、早期抗炎治疗,为银屑病高危人群打造更全面的防治方案——这不仅是降低银屑病发病率的关键,更是推动皮肤病学从“疾病治疗”向“健康管理”转型的重要一步。
参考文献:
[1]Näslund-Koch C, Kvist-Hansen A, Bojesen SE, Skov L, Kobylecki CJ, Vedel-Krogh S. Low-grade systemic inflammation is associated with risk of psoriasis in a general population study of more than 100 000 individuals. Br J Dermatol. 2025;193(2):250-258. doi:10.1093/bjd/ljaf147
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)