既往的糖尿病肾病(DN)遗传学研究多基于临床表型定义的糖尿病肾脏疾病(Diabetic Kidney Disease, DKD)队列开展。但由于DKD患者中常合并其他类型肾脏疾病,导致研究无法精准解码真正的DN遗传易感位点。此外,由于DKD队列缺乏精准的病理表型数据,对已发现的遗传变异与肾脏病理特征之间的关联,及其在DN致病机制中的确切作用认识存在不足。并且,现有DKD遗传学研究大多在欧美人群中进行,导致相关研究成果难以直接应用于中国人群。
因此,亟需开展基于肾脏活检确诊的中国人群DN精准表型队列的遗传学研究,解析DN真正的遗传易感位点,阐明其生物学意义,并验证关键位点的致病机制,从而为理解DN发生发展机理,制定疾病防控策略提供科学依据。
2025年7月25日,由东部战区总医院,国家慢性肾病临床医学研究中心刘志红院士领衔的研究团队,在Cell子刊Cell Reports Medicine发表题为Multimodal analysis stratifies the genetic susceptibility and reveals the pathogenic mechanism of kidney injury in diabetic nephropathy的研究论文。研究联合国内12家单位,成功构建了目前全球最大规模、经肾活检明确诊断为DN的精准表型队列。以此为基础,首次绘制了中国汉族人群DN患者遗传图谱,发现了10个新的DN疾病风险SNP位点;创新性的整合DN患者“基因型-肾脏基因表达谱-病理表型-临床表型”的多维度、多模态数据,全面解析了关键致病遗传变异与DN病理和临床表型的关联,阐明其生物学意义;揭示了关键致病突变加重肾小管细胞线粒体损伤促进DN发生发展的关键分子机制。这项研究全面和系统的解读了DN的遗传发病机制,为未来制定疾病关键防控策略和精准干预手段奠定了重要的理论基础。
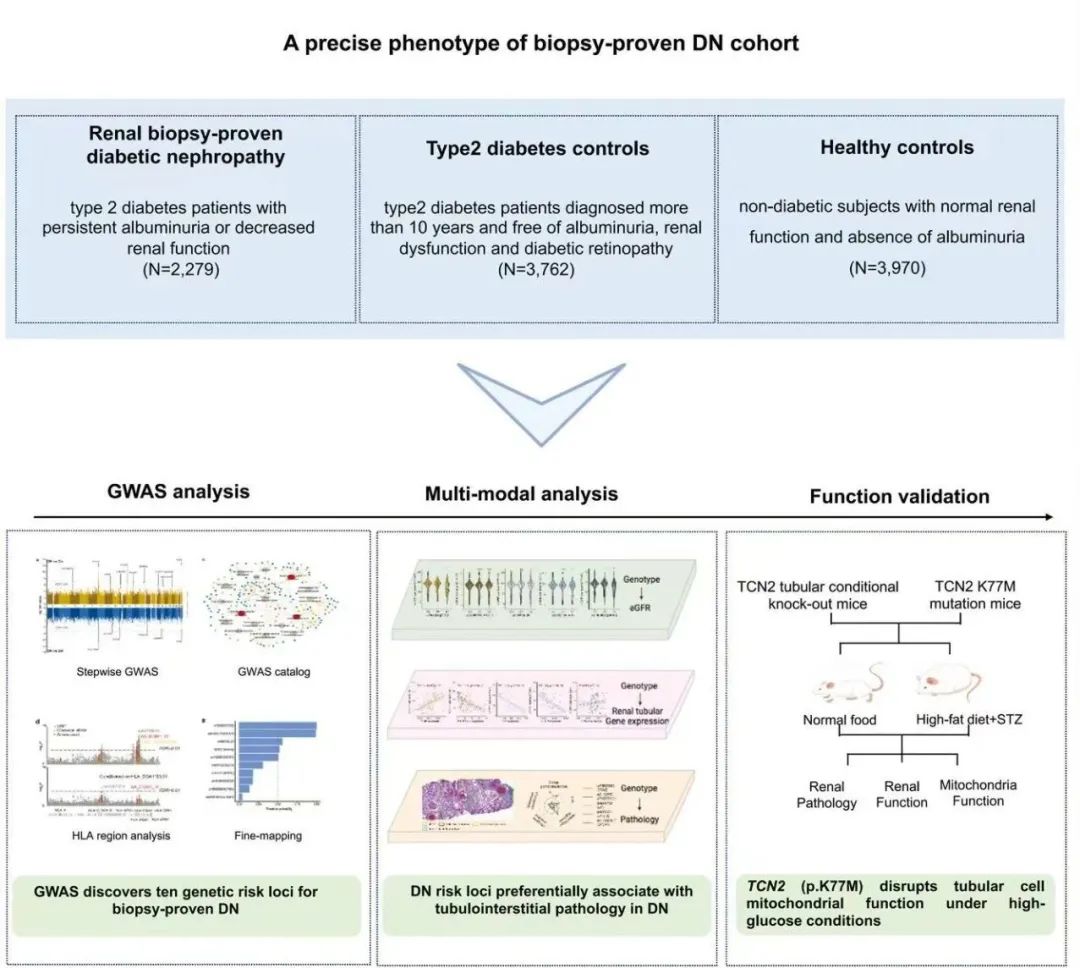
图1:研究流程图
精准表型增强DN遗传变异识别效能
研究团队为了最大程度降低临床表型定义的DKD队列中难以避免的其他肾脏疾病的干扰,采用了严格的临床与病理表型筛选方案,其中DN疾病组仅纳入经肾脏病理活检明确诊断的DN患者,并排除所有其他肾脏疾病;糖尿病对照组(T2D组)则筛选了罹患2型糖尿病10年以上,无微量白蛋白尿且肾功能正常的患者,并通过眼底检查排除了合并糖尿病视网膜病变患者;健康对照组(HC 组)则纳入无糖尿病及肾脏病病史的健康人群。最终,该研究共纳入2279例DN患者、3762例T2D患者和3970例健康对照者。得益于这种严谨的表型分层策略,该研究将DN的遗传度由既往研究报道的10-12%提升至36.5-42.4%,极大地增强了识别真正致病性DN遗传变异的能力。

图2:Cell Reports Medicine文章封面,研究团队共纳入全国12家中心
全面系统地解析了DN遗传发病机制
研究基于两阶段GWAS分析,发现了10个达到全基因组显著水平的DN遗传易感位点,且新发现位点与既往DKD GWAS研究结果存在显著差异,不仅提示中国汉族人群可能具有独特的DN遗传易感背景,也有力地支持了精准表型DN队列在揭示核心致病位点上的优势。研究首次利用DN患者,T2D不合并微血管病变患者以及正常对照患者的组间GWASs结果比较分析,证实了DN疾病发生主要取决于肾脏对于损伤的易感性。利用GWAS Catalog通路富集分析,揭示了DN遗传易感位点相关基因显著富集于免疫系统调节及代谢相关通路。相关结果为全面系统解析DN遗传发病机制指明了方向。
多模态分析阐释易感位点生物学意义
研究团队充分利用了DN组患者拥有完整肾脏病理数据的独特优势,在初步通过FINEMAP确定5个潜在致病性基因突变位点的基础上,创新性地进行了“基因型-肾脏组织基因表达-病理表型-临床表型”的多模态数据整合分析。分析揭示了与其他肾脏病理指标相比,这5个关键位点的基因型与肾小管间质纤维化和小管萎缩(IFTA)间存在着最密切的关联。例如,携带rs75680863(TCN2)风险等位基因T的患者,其IFTA评分显著高于非携带者,且其肾小管间质TCN2基因表达水平也同步降低。由此可见,多模态分析不仅从遗传关联的层面证实了肾小管损伤在DN发病中的核心地位,也为后续解析已鉴定遗传变异的致病机制提供了坚实的数据支撑。
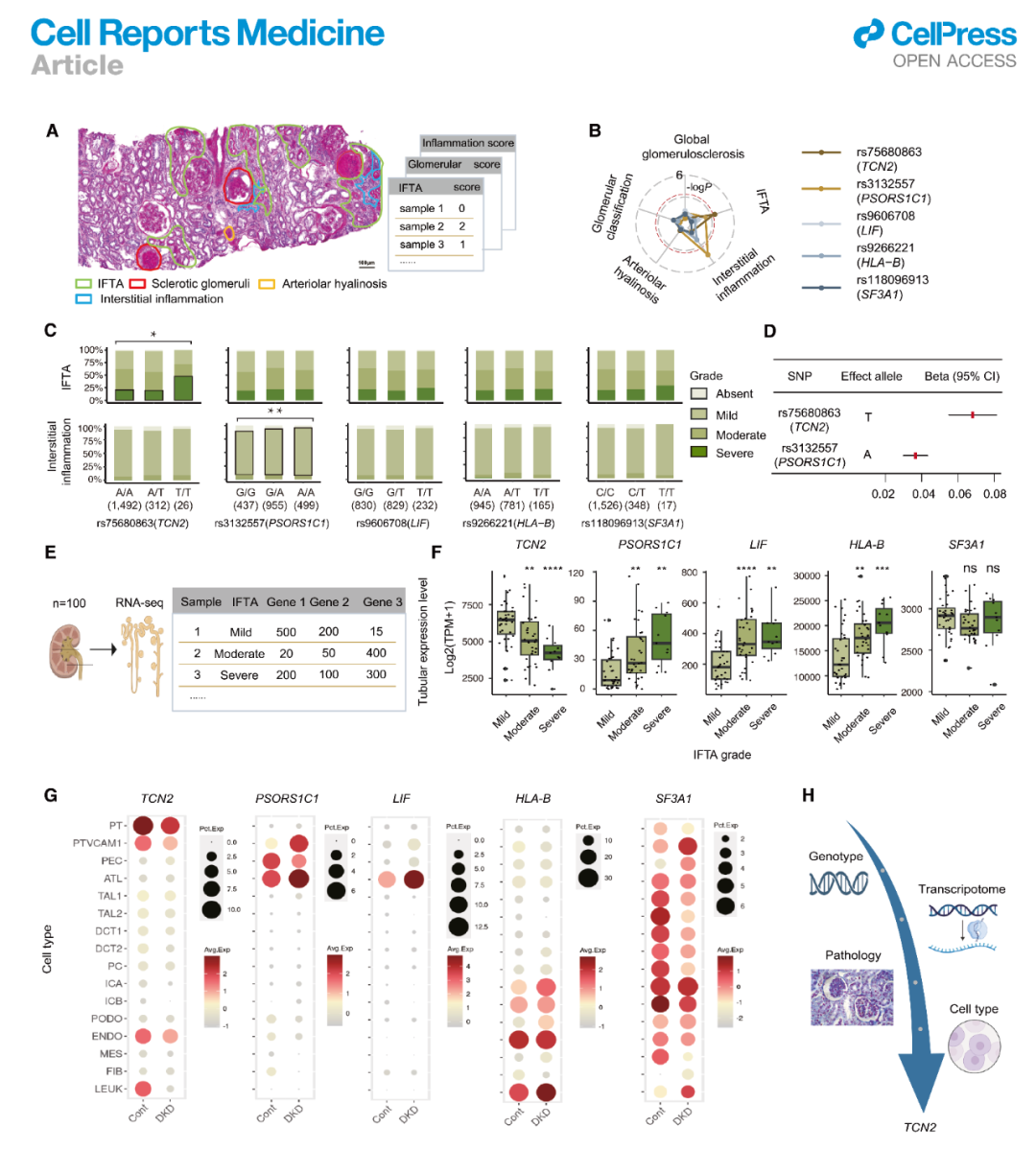
图3:基于DN“基因型-肾脏基因表达谱-病理表型-临床表型”的多模态分析揭示潜在致病性基因突变位点的生物学意义
体内外研究解析关键突变致病机制
为了深度验证多模态分析筛选出的核心致病位点的生物学功能,研究团队聚焦东亚人群高频携带(7.3%)的TCN2基因第2号外显子上错义突变rs75680863(c.230A>T, p.K77M)展开下游分子机制探索。通过构建TCN2基因肾小管条件性敲除小鼠及TCN2 K77M点突变小鼠,并诱导其发展为糖尿病肾病模型,结合体外细胞实验,揭示了该基因突变会破坏线粒体结构稳定性与功能完整性,导致肾小管上皮细胞出现能量代谢障碍,加重高糖情况下肾小管间质损伤并驱动DN发生发展的分子机制,这为未来开发相关靶向干预手段提供了理论基础。
研究意义:从遗传机制解析到疾病精准防控
研究基于大样本精准表型DN队列的GWAS研究,鉴定了10个新的DN风险SNP位点,并开创性地绘制了从遗传易感位点鉴定→肾组织基因表达→肾脏病理和临床表型的全景图谱。结果不仅填补了中国人群DN遗传数据空白,更为后续遗传机制研究提供了高度可信的研究方向。
研究通过比较分析DN患者,T2D不合并微血管病变疾病对照以及正常人群的组间GWAS结果,全面解析了DN复杂遗传病因,并揭示了免疫炎症和代谢异常驱动DN发生发展的遗传学基础,为更加系统的解读DN遗传发病机制提供了框架。
研究锁定了5个关键潜在致病突变位点,并首次证实了TCN2(p.K77M)这一关键突变影响线粒体功能加重高糖情况下肾小管细胞损伤促进DN进展的机制。这为靶向TCN2及其下游通路开发精准干预手段提供了理论依据,具有良好的临床转化价值。
在本研究发现的DN遗传易感位点及其与临床和病理表型关联的基础上,未来有望通过整合核心位点、关键分子通路,以及患者病理和临床表型数据,构建多层次和多维度的疾病发生和预后预测模型,从而实现对DN疾病发生及进展风险的精准防控。
综上所述,本研究在全面系统的解析DN遗传发病机制的基础上,为制定疾病精准防控策略和开发靶向干预手段提供了重要支撑。
专家简介
- 刘志红 院士 -
东部战区总医院
中国工程院院士,教授、博士生导师
东部战区总医院国家肾脏疾病临床医学研究中心 主任
国际肾脏病学会(ISN) 常务理事
中华医学会理事会 常务理事
中华医学会肾脏病学分会第九届 主任委员
国家“973”计划项目 首席科学家
国家“精准医学”重点研发计划项目 首席科学家
东部战区总医院国家慢性肾病临床医学研究中心刘志红院士、上海第六人民医院贾伟平院士、上海第六人民医院胡承教授和浙江大学良渚实验室沈宁研究员为论文的共同通讯作者。东部战区总医院蒋松、贾晗颖、金立、侯庆和良渚实验室博士后Md. Asif Ahsan为论文的并列第一作者。
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)