肌层浸润性
循环肿瘤DNA(ctDNA)检测作为一种非侵入性液体活检手段,已在多种实体瘤中被证实可作为分子残留病灶(MRD)的可靠预后标志物。例如在

MIBC患者在根治性膀胱切除术后的预后存在显著差异。基于ctDNA的分子残留病灶检测,有助于在术后识别出高复发风险的患者,使其能够从辅助免疫治疗中获益,同时避免低风险患者承受不必要的治疗负担。
该研究为一项III期、双盲、随机对照试验。研究对术后无影像学疾病证据的MIBC患者进行长达1年的连续ctDNA监测。在监测期间检测到ctDNA阳性的合格患者,按2:1的比例被随机分配接受静脉注射阿替利珠单抗或安慰剂治疗,每4周一次,最多持续1年。主要研究终点为研究者评估的无病生存期(DFS)。总生存期(OS)作为次要研究终点,采用分层检验以控制a类错误。所有持续检测为ctDNA阴性的患者不接受研究药物治疗,仅进行随访观察。
2021年5月3日至2024年11月25日期间,研究共从24个国家的157个中心纳入了761例患者进入ctDNA监测阶段。其中,250例ctDNA检测阳性的患者被随机分配至阿替利珠单抗组(167例)或安慰剂组(83例);另有129例ctDNA阳性患者因不符合条件未进入随机分组。此外,357例患者在全部监测时间点均持续呈ctDNA阴性,被纳入探索性分析。
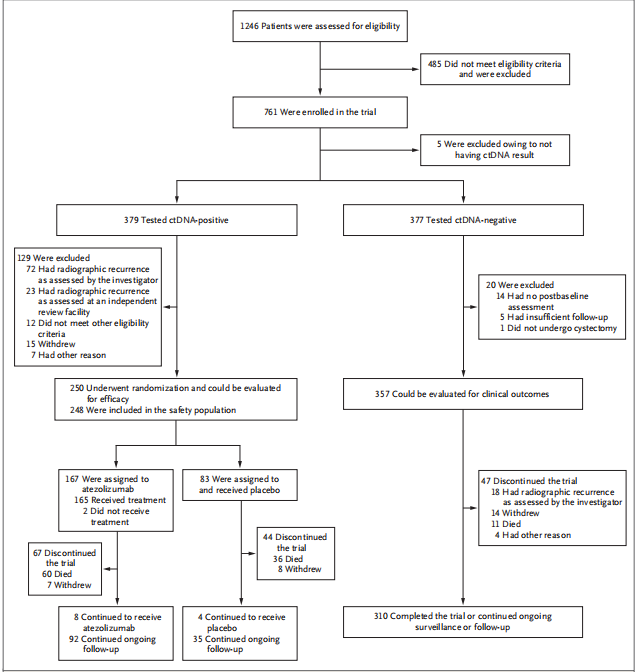
图1. 患者筛选、随机分组与随访流程图
主要终点结局
截至2025年6月15日的数据截止日,随机分组患者的中位随访时间为16.1个月。阿替利珠单抗组与安慰剂组分别有112例(67%)和66例(80%)患者发生研究者评估的疾病复发或死亡。最常见的复发部位为盆腔或远处淋巴结、肺和骨骼。阿替利珠单抗组的中位DFS(9.9个月;95% CI,7.2–12.7)显著长于安慰剂组(4.8个月;95% CI,4.1–8.3),疾病复发或死亡风险比为0.64(95% CI,0.47–0.87;P=0.005)。(图2A)
次要终点结局
在OS方面,阿替利珠单抗组中位OS为32.8个月,安慰剂组为21.1个月,死亡风险比为0.59(95% CI,0.39–0.90;P=0.01)。(图2B)
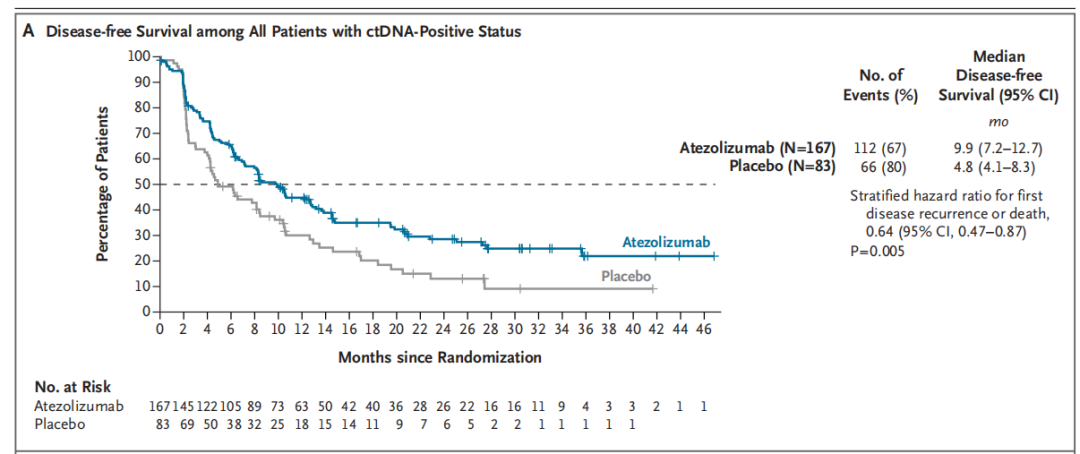
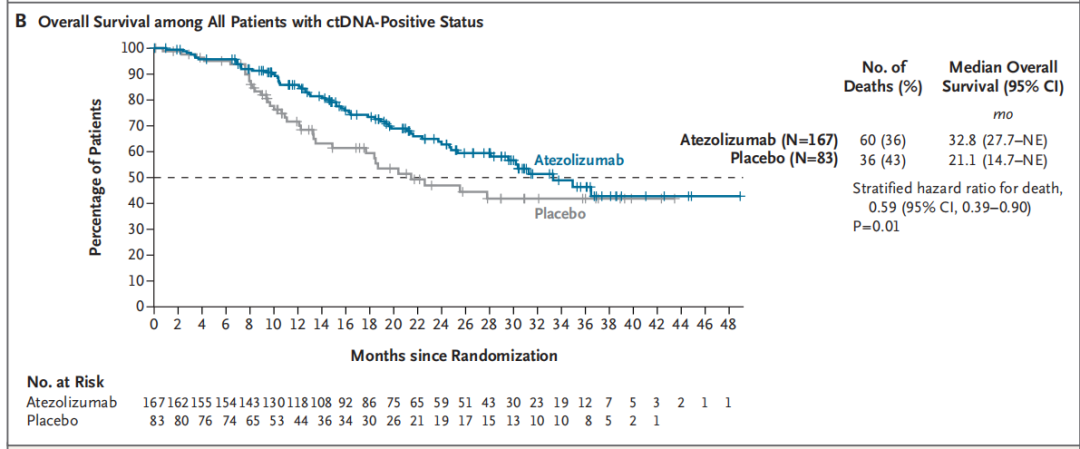
图2. (A)DFS;(B)OS
安全性结局
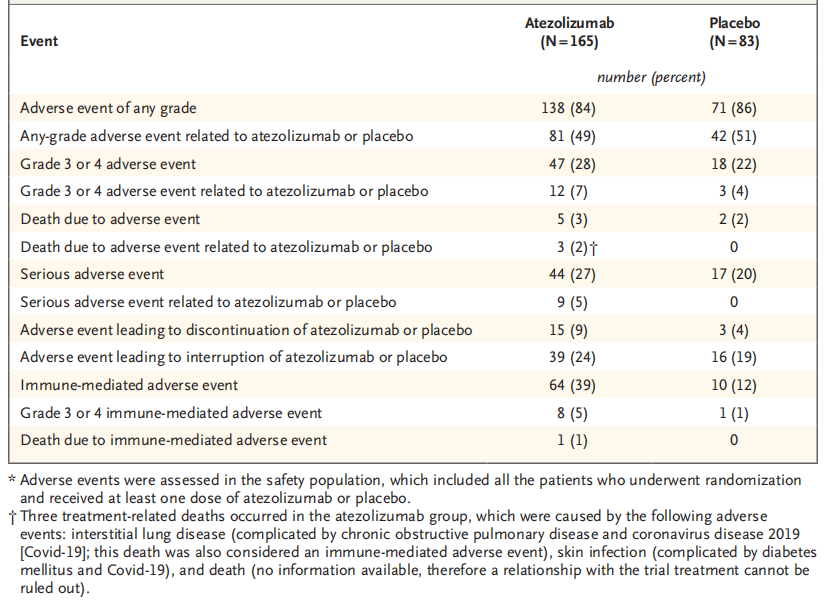
安全性分析显示,阿替利珠单抗组与安慰剂组分别有28%和22%的患者发生3-4级不良事件(其中被认为与试验药物相关的比例分别为7% vs. 4%)。
表1. 安全性事件汇总
探索性分析结局
在持续ctDNA阴性的357例患者中,1年ctDNA监测期结束时的无病生存率达95%,2年时仍保持在88%。
对于MIBC患者,基于ctDNA状态指导的辅助阿替利珠单抗治疗,与安慰剂相比,能显著延长DFS和OS。该策略能有效识别出真正需要强化治疗的高危患者,同时使低危患者免于不必要的治疗。
参考文献
1.Powles T, et al. ctDNA-Guided Adjuvant Atezolizumab in Muscle-Invasive Bladder Cancer. N Engl J Med. 2025;393(24):2395-2408.
本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。
医脉通是专业的在线医生平台,“感知世界医学

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)