HBV感染是全球重大公共卫生问题,其复制会诱导肝细胞免疫损伤,目前尚无针对特异性靶向共价闭合环状DNA(cccDNA)的药物,无法彻底清除肝内cccDNA达到完全治愈,肝脏持续处于炎症活动状态,从而进展为
1 资料与方法
回顾性分析2021年5月—2023年5月于昆明市第三人民医院就诊并给予PEG-IFN-α-2b治疗的HBeAg阴性的CHB患者。
(1)符合《慢性乙型肝炎防治指南(2022年版)》中CHB诊断标准同时HBeAg阴性者(2022年之前纳入的患者按照2022年版指南重新诊断);(2)18岁≤年龄≤65岁;(3)ALT≤10倍正常值上限(ULN);(4)使用 PEG-IFN-α-2b治疗,疗程满48周。
(1)合并慢性HCV或HDV感染;(2)合并
入组患者中分别口服使用4种核苷(酸)类似物(NUC):
(1)一般资料:性别、年龄、治疗方案和治疗经历等;(2)血清学生化指标、病毒学指标:HBV DNA,肝硬度值(LSM)、ALT、TBil、AFP、促甲状腺激素(TSH)、WBC、NEUT、Hb和PLT等以及基线、治疗12周、治疗24周时NEUT、PLT、ALT、TSH、AFP、HBV DNA、HBsAg;(3)治疗期间的不良反应。
2 结果
共入组125例患者,其中男88例(70.40%),女37例(29.60%),平均(34.07±12.46)岁;根据48周时HBsAg是否清除分为HBsAg清除组(n=37)和HBsAg未清除组(n=88),两组基线资料对比发现,基线HBsAg水平和治疗经历差异均有统计学意义(P值均<0.05),其余指标差异均无统计学意义(P值均>0.05)(表1)。
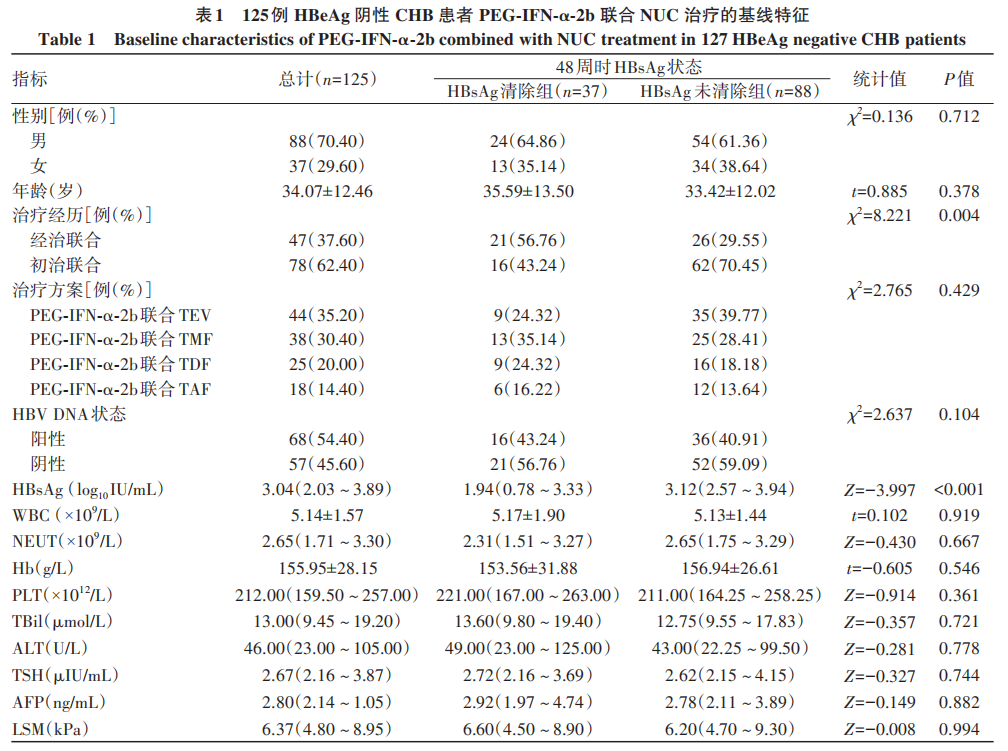
HBeAg阴性CHB患者采用PEG-IFN-α-2b联合NUC治疗过程中,WBC、NEUT、PLT、TSH逐渐下降(P值均<0.05),ALT、AFP逐渐升高(P值均<0.05)(表2)。
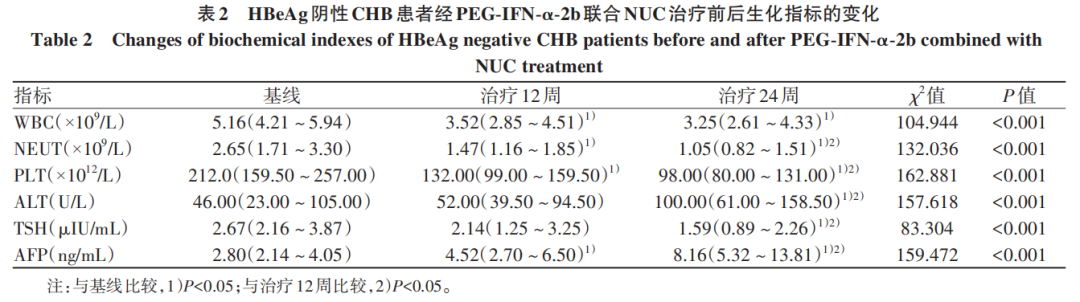
单因素Logistic分析结果显示,治疗48周时两组患者治疗经历(OR=0.320,95%CI:0.144~0.708)、HBsAg基线值(OR=2.102,95%CI:1.481~2.983)、HBsAg治疗12周较基线下降水平(OR=1.473,95%CI:1.092~1.988)、HBsAg治疗24周较基线下降水平(OR=1.832,95%CI:1.317~2.548)、治疗过程中ALT最大值(OR=0.992,95%CI:0.988~0.997)、治疗过程中TSH最小值(OR=2.718,95%CI:1.476~5.003)是HBsAg清除的影响因子(P值均<0.05)。多因素Logistic分析结果显示,治疗48周时两组患者治疗经历(OR=0.232,95%CI:0.071~0.753)、HBsAg基线值(OR=13.423,95%CI:3.276~54.997)、HBsAg治疗12周较基线下降水平(OR=0.143,95%CI:0.040~0.515)、治疗过程中ALT最大值(OR=0.986,95%CI:0.980~0.993)、治疗过程中TSH最小值(OR=3.281,95%CI:1.413~7.619)是HBsAg清除的独立影响因素(P值均<0.05)(表3)。构建HBsAg清除的联合预测模型Y=-1.603-1.462×治疗经历+2.597×HBsAg基线值-1.944×HBsAg治疗12周较基线下降水平-0.014×治疗中ALT最大值+1.188×治疗中TSH最小值。
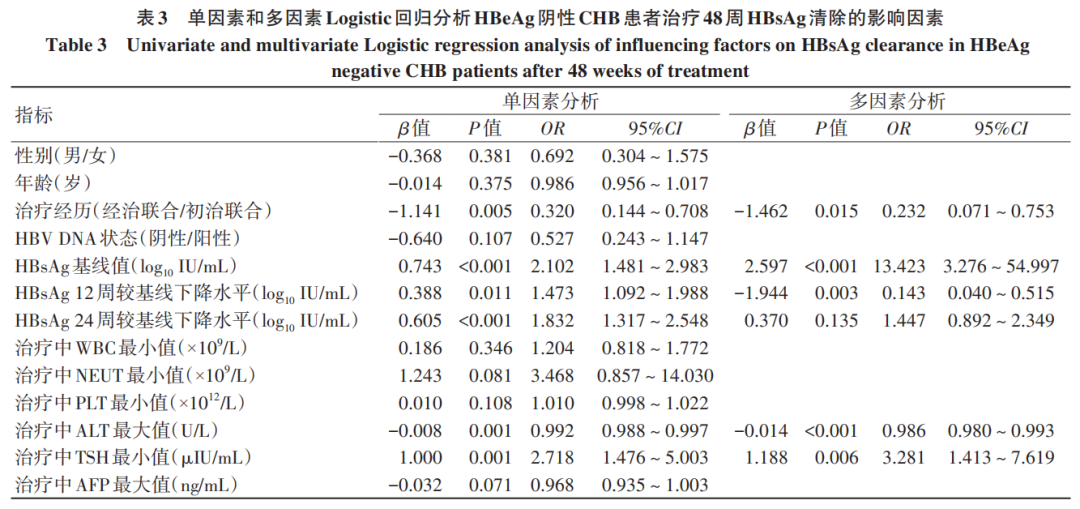
单个指标预测HBsAg清除效能从高到低依次为治疗中ALT最大值(AUC=0.824)、HBsAg基线值(AUC=0.727)、治疗中TSH最小值(AUC=0.707)、HBsAg治疗12周较基线下降水平(AUC=0.641)、治疗经历(AUC=0.636),而联合模型的预测价值更高(AUC=0.921)。运用Delong检验将联合预测模型的AUC分别与单个指标的AUC进行比较,结果显示联合预测模型的诊断效能较单一指标均得到提升(P值均<0.05)(表4、图1)。
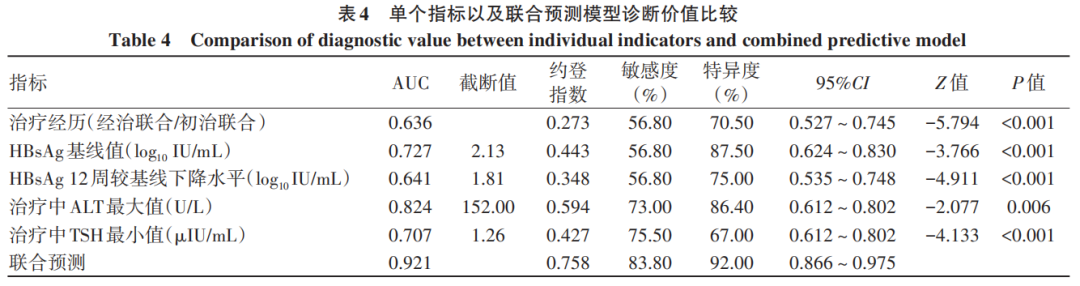
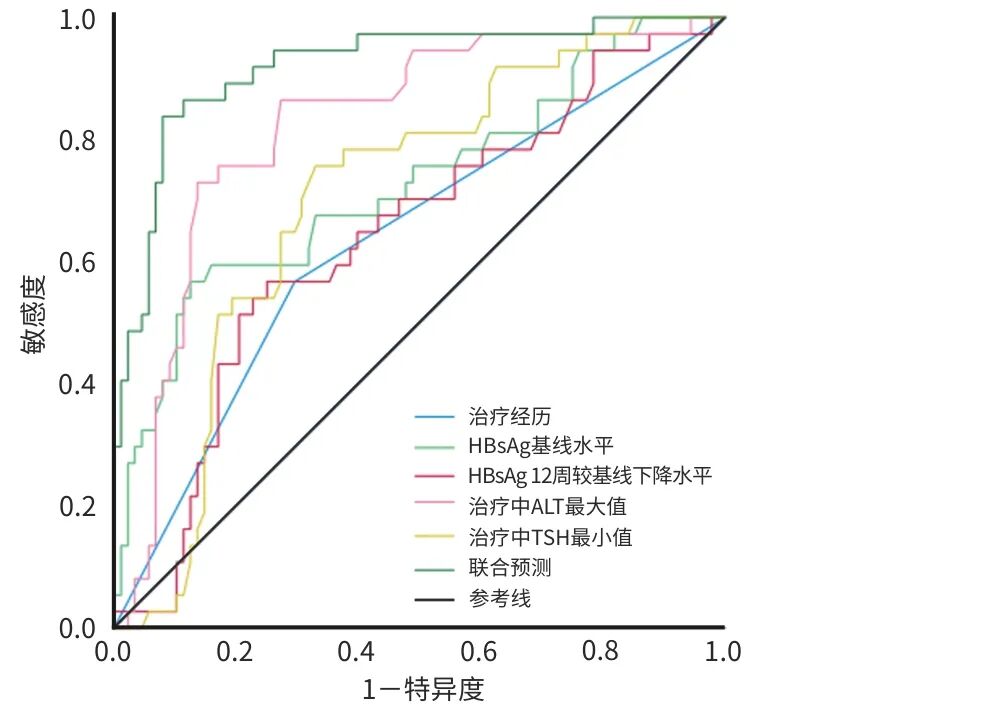
图1 单个指标以及联合预测模型预测48周HBsAg清除的ROC曲线
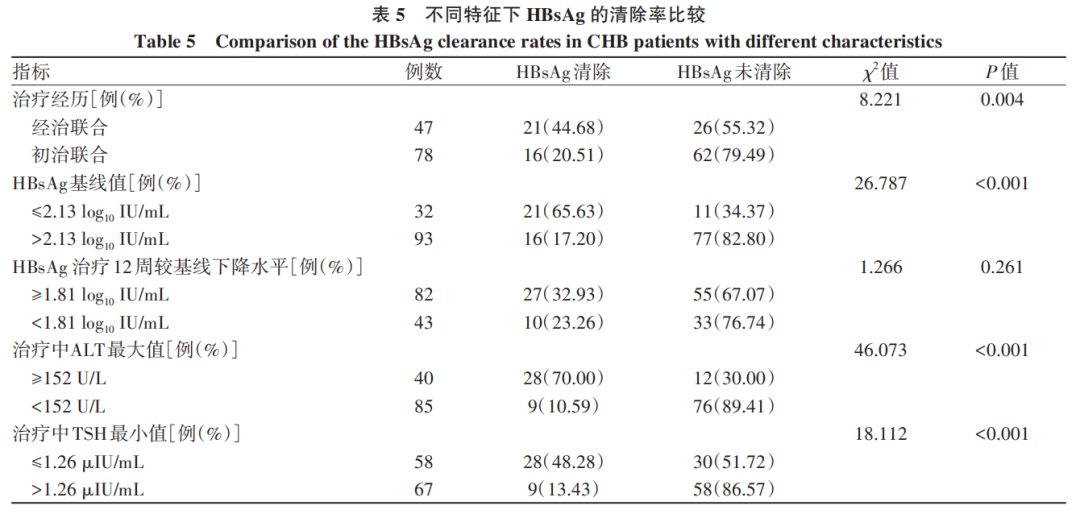
治疗经历为经治联合时HBsAg清除率为44.68%,经治联合和初治联合组间比较,差异有统计学意义(χ2=8.221,P=0.004);HBsAg基线值≤2.13 log10 IU/mL时HBsAg清除率为65.63%,与HBsAg基线值>2.13 log10 IU/mL比较,差异有统计学意义(χ2=26.787,P<0.001);治疗中ALT最大值≥152 U/L的HBsAg清除率为70.00%,与治疗中ALT最大值<152 U/L比较,差异有统计学意义(χ2=46.073,P<0.001);治疗中tsh最小值≤1.26>1.26 μIU/mL比较,差异有统计学意义(χ2=18.112,P<0.001)(表5)。
3 讨论
HBV感染导致肝脏处于慢性炎症刺激状态,肝细胞反复经历坏死和修复的过程可增加失代偿期肝硬化、HCC的发病率。现阶段的目标要追求患者停药后仍能维持HBsAg清除(伴或不伴抗-HBs出现)同时HBV DNA检测不到的临床治愈,这意味着患者对HBV能处于持续免疫控制状态,肝功能和肝组织学得到改善,从而提高生存质量。HBsAg清除是临床治愈的重要标志,长期使用NUC或有限疗程IFN治疗能在一定程度上促进HBsAg清除,降低不良结局的发生。目前临床常见抗病毒药物对cccDNA均无直接作用,单用NA或IFN难以维持免疫学应答状态,利用这两种药物的不同作用机制,将NUC和IFN联合治疗,能互补协同提高CHB患者临床治愈率。
基于PEG-IFN-α治疗的多项研究表明,治疗前基线HBsAg水平越低,HBsAg后期的清除率就越高,故多数学者将基线HBsAg<1 500 IU/mL作为选择PEG-IFN-α治疗优势人群的节点,可使联合治疗中HBsAg的清除率得到更大提升。Li等针对基线HBsAg<200 IU/mL CHB患者短期PEG-IFN-α-2b治疗效果的研究提出,基线HBsAg水平是HBsAg清除的重要预测因素。Zhong等在PEG-IFN-α-2b治疗HBeAg阴性CHB患者实现功能性治愈的研究中发现,基线HBsAg<182 IU/mL、第24周HBsAg<4>12 IU/mL是预测HBsAg消失的良好指标。Iannazzo等研究中基线HBsAg定量是HBsAg清除最重要的因素,当基线HBsAg<100 IU/mL时,HBsAg清除率可达53.9%。顾琳琳等研究也发现当基线HBsAg对数值为1.68时,HBeAg阴性CHB患者实现临床治愈的AUC为0.802。本研究中得出HBsAg基线值和HBsAg治疗12周较基线下降水平是PEG-IFN-α-2b联合NUC治疗48周HBeAg阴性CHB患者发生HBsAg清除的独立影响因素,当HBsAg基线值≤135 IU/mL(研究中经对数后HBsAg基线值为2.13 log10 IU/mL)时AUC为0.727,HBsAg清除率为65.60%,12周较基线下降水平越高,后期HBsAg清除率就越高。
IFN治疗中出现ALT升高,原因可能与清除HBV同时发生炎症反应有关,ALT可间接反映肝脏炎症程度,由于炎症活动时肝细胞的损伤和再生,ALT升高表明患者免疫应答反应更强烈。目前已有多个研究发现PEG-IFN-α-2b治疗中出现ALT升高峰值大的患者,临床治愈率更高,但有关ALT的最佳截断值如何,仍需进一步研究。吴丽丽等在CHB的HBsAg阴转的预测因子分析中提出,治疗过程中ALT升高为HBsAg阴转的直接影响因素。Tang等发现治疗中第12周ALT水平≥80 U/L,是建立功能性治愈的多参数预测模型指标之一。本研究中发现治疗中ALT升高是影响48周HBeAg阴性CHB患者发生HBsAg清除的独立影响因素,当治疗中ALT≥152 U/L时AUC为0.824,HBsAg清除率为70.00%。
肝脏是甲状腺激素转化及排泄的重要器官,甲状腺功能障碍是CHB患者接受IFN治疗的常见的不良反应,其作用机制可能是IFN对免疫系统激活,导致免疫细胞过度攻击甲状腺组织,增强淋巴细胞、巨噬细胞及自然杀伤细胞等免疫细胞活性,产生细胞毒性,影响甲状腺素生成、分泌及代谢,从而对甲状腺造成损伤。TSH是评估甲状腺功能的重要指标,目前TSH的变化对IFN的疗效以及最终结局影响的相关研究较少。皇甫彤等发现IFN治疗中CHB出现病毒学应答组的TSH水平明显低于未应答组。木唤等在研究PEG-IFN-α-2b治疗乙型肝炎患者HBsAg与TSH的关系时发现,治疗第24周和第48周时TSH降低组对HBsAg清除能力明显优于TSH正常组。本研究发现,经PEG-IFN-α-2b联合NUC治疗48周患者TSH均较前有下降趋势,多因素Logistic回归分析表明低水平TSH与HBsAg清除相关,当治疗中TSH≤1.26 μIU/mL时对预测HBsAg清除有较高诊断价值。
本研究通过Logistic回归分析对变量进行筛选,建立了由HBsAg基线值、HBsAg治疗12周较基线下降水平、治疗过程中ALT最大值、治疗过程中TSH最小值等变量组成的联合预测模型,经ROC曲线和Delong检验分析显示联合预测模型的诊断价值更高。在后期临床中,将结合实际情况,扩大样本量,延长研究时间,联合多中心进行进一步验证。力求使患者在承受最小的不良反应和经济负担的情况下,更高效地实现HBsAg清除,为获得临床治愈提供依据。
吴凤萍, 何玲, 刘晨瑞, 等. 聚乙二醇干扰素α治疗非活动性HBsAg携带者血清
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)