临床研究是验证医学假设、推动诊疗进步的核心手段,其质量直接关系到研究结论的可靠性与临床转化价值。随着2024年10月《医疗卫生机构开展研究者发起的临床研究管理办法》的正式施行,我国临床研究进入了规范化、精细化管理的新阶段。
医脉通特邀南方医科大学珠江医院丁长海教授从研究者发起的临床研究(IIT)的界定、临床研究设计与实施的关键环节、临床研究管理体系三个维度,结合具体案例与法规要求,对高质量临床研究的实施与管理进行详细解析。
根据《医疗卫生机构开展研究者发起的临床研究管理办法》,IIT是指医疗卫生机构开展的,以人(个体或群体)为研究对象,不以药品、医疗器械(含体外诊断试剂)等产品注册为目的,研究疾病的病因、诊断、治疗、康复、预后、预防、控制及健康维护等的活动。
这一定义明确了IIT的核心特征,与以产品上市为目标的企业赞助注册研究(IST)形成鲜明对比(表1)。
表1 IIT和IST的区别

高质量临床研究需同时满足“重要性、有意义、新颖性、符合伦理”四大标准,每个标准都有具体的内涵与判断依据:
重要性:研究需提出能影响临床实践的重要问题,对疾病的认识、诊断或治疗产生重大影响。
有意义:研究结论需对现有资料形成补充,提供有用信息,且结论需来自研究本身,不含商业或学术偏见。
新颖性:研究需开辟新的领域、提出新的治疗方法或解决有争议的重大问题。
符合伦理:研究需获得受试者的知情同意,将其暴露于研究风险的程度降至最低。
膝骨关节炎(KOA)作为一种影响全球的高发疾病,其所有关节结构均参与发病与进展,目前没有药物可以治愈。团队围绕KOA开展了系列IIT,展示了从临床问题提出到证据转化的完整过程,每个研究的设计、方法与结果均体现了高质量临床研究的特征。其中


图1 维生素D缺乏对骨关节炎有影响吗?(队列研究)
(Arthritis Rheumatol 2009;Ann Rheum Dis 2014)

图2 维生素D补充对骨关节炎有治疗作用吗?
(随机对照临床试验,JAMA 2016)
干预:维生素D 5,000 IU,每月一次,持续两年。安慰剂对照。
主要发现:与安慰剂组比较,维生素D干预对关节软骨损失和WOMAC疼痛作用不明显;但对VAS疼痛、关节功能等有一定作用。

图3 维生素D研究写入国际指南(OARSI、ESCEO)
临床研究设计需严格遵循PICOS框架,即明确研究对象(Population)、干预/暴露因素(Intervention/Exposure)、对照(Comparison/Control)、结局(Outcome)与研究设计(Study design,图4)。
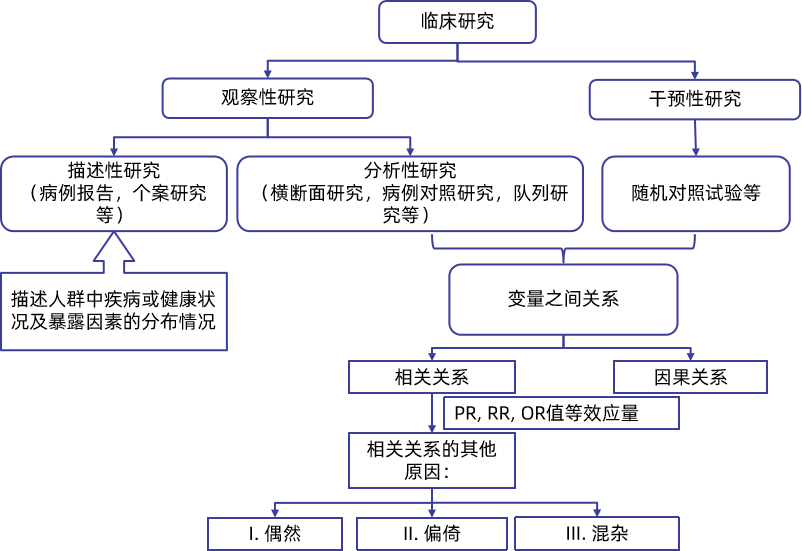
图4 研究设计
此外,研究的具体实施需历经完整链条:前期工作→研究方案→立项→伦理→注册备案→启动→招募受试者→检查测定→质控→中期会议→结题→完成测定→写作→投稿→被拒→再投→回复→接受→发表。整个过程需具备先进性、科学性、规范性,并伦理合规,唯有脚踏实地、注重细节,方能确保研究的严谨性与成功落地。
方案制定是研究开展的关键环节,关乎研究能否顺利进行,结果是否正确,结论是否可靠以及是否能出高质量成果。
在因果推断方面,临床试验能明确因果关系,观察性研究可推断因果关系,需通过Bradford-Hill准则评价因果关系,具体包括9项标准:时间顺序;量效关系;相关性的强度;可逆转性;一致性;合理性;特异性;实验证据;类比证据。

图5 因果推断流程图
另一方面,研究实施的核心是通过严格的质量控制减少偏倚,包括选择偏倚、信息偏倚以及混杂偏倚,确保结果可靠。
(1)选择偏倚的控制
选择偏倚是在确定研究对象时出现的系统误差,使研究样本不能代表目标人群,包括成员偏倚、低应答偏倚、失访偏倚等。
识别选择偏倚:
横断面研究:选择人群是否有代表性?
队列研究:暴露组和非暴露组中,除了暴露因素以外,所有其他重要的可变因素是否都类似?
病例对照研究:病例组和对照组,除了结局事件以外,所有其他重要的可变因素是否都类似?
减少选择偏倚:
研究人群明确规定:随机
制定入选和排除标准
将拒绝和失访病例保持到最小化
减少失访偏倚:
选择可能依从干预和方案的受试者
干预措施简单
研究访视方便且愉悦
测量方法无痛苦且有用
鼓励受试者继续完成试验
找到失访的受试者
(2)信息偏倚的控制
信息偏倚包括回忆偏倚、采访者或观察者偏倚、测量偏倚、确认偏倚等。
如何识别信息偏倚:
队列研究:是否用同样的方法获得暴露组和非暴露组的结局信息?
病例对照研究:是否用同样的方法获得病例组和非病例组的暴露因素信息?
信息偏倚最小化:
方法标准
方法客观
盲法测定
测量人员严格培训
按方案标准程序收集数据
校正病人提供的信息
(3)混杂偏倚的控制
混杂偏倚是指暴露因素与疾病发生或疾病结局的相关(关联)程度受到其他因素(混杂因素)的歪曲或干扰。
控制混杂因素:
设计时:随机、限定、匹配;
分析时:分层、多因素回归、敏感性分析、倾向性评分法。
观察性研究
为什么做此研究?创新性
受试者是如何选择的?选择偏倚
暴露因素和结局变量是如何报告/测量的?盲法,信息偏倚
那些变量作为混杂因素?为什么?
检查了交互作用吗?亚组分析?
多因素回归分析?
缺失值的处理?
相关关系的大小?
讨论:主要发现?结果解释?外推性?
局限性?
临床意义?
临床试验
为什么做此研究?创新性
方案执行过程中有变动吗?
受试者是如何入排的?
随机方法,分配隐藏(选择偏倚、混杂偏倚)
干预措施,对照?
结局变量是如何报告/测量的?
盲法,信息偏倚
事先定好的主要终点指标?次要终点指标?
统计学方法:ITT?PP?亚组?调整?
缺失值的处理?
结果:主要发现---主要终点指标
效应值的大小?临床意义
讨论:主要发现,结果解释,外推性
局限性?
登记、方案发表
基金
2021年7月,国家卫生健康委印发《关于开展医疗卫生机构临床研究规范管理试点工作的通知》,将北京、上海、广东、海南列为首批试点省市,探索IIT管理模式。
2022年4月,试点范围扩大至河北、辽宁、江苏等8个省市,进一步验证管理机制的可行性。
2024年9月,国家卫生健康委员会、国家中医药管理局、国家疾病预防控制局联合印发《医疗卫生机构开展研究者发起的临床研究管理办法》,共8章49条,自2024年10月1日起施行。
图6 关于印发医疗卫生机构开展研究者发起的临床研究管理办法的通知
广东省作为首批试点省市,于2022年2月成立“广东省临床研究质量控制中心”(依托南方医科大学珠江医院),构建了“四大体系”,推动IIT规范化管理。
分级标准:将IIT分为4级,根据研究设计、风险程度、受试者类型等划分(表2)。
表2 广东省IIT风险分级标准(试行)

(三)编写《研究者发起的临床研究研究者手册》


图7.《研究者发起的临床研究研究者手册》编写启动会

图8.《研究者发起的临床研究研究者手册》由人民卫生出版社正式出版
(四)组织制定管理共识,指导医疗机构建立健全临研管理体系
表3 15家牵头撰写单位,20项共识

审核:南方医科大学珠江医院 丁长海教授
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)