来源:IBD Daily
该研究基于来自荷兰Lifelines前瞻性队列 (基于人群、三代人的队列,包含荷兰北部地区超过167,000名居民的健康、疾病和健康相关行为数据),纳入了178名在随访期间确诊为炎症性肠病 (IBD) 的参与者,并收集其在诊断前与诊断后的配对血浆样本 (诊断前后时间间隔中位数为3.9年)。采用噬菌体展示免疫沉淀测序技术 (PhIP-Seq),对覆盖约344,000种微生物、食物蛋白及免疫抗原的肽段文库进行系统性抗体反应分析。所使用的两个噬菌体展示文库分别包含约244,000项以微生物群来源为主的抗原,以及约100,000项覆盖常见过敏原和免疫表位数据库 (IEDB) 的B细胞抗原。实验流程包括将血清样本与文库共孵育,通过免疫沉淀富集抗体结合的噬菌体,并进行新一代测序以获取抗体反应谱。PhIP-Seq数据经过严格的质控与预处理,包括基于广义泊松分布的肽段富集显著性判定、流行度过滤等步骤。所有分析均校正了年龄、性别与测序板等混杂因素,并对多重假设检验进行错误发现率校正。
该研究纳入了178名在随访期间发展为IBD的参与者,包括123例UC、44例CD和11例未分型IBD (IBD-U),中位随访时间为3.9年 (四分位数间距 (IQR):3.4-4.3)。队列平均年龄为47.0岁,女性占59.5%。研究人员采用PhIP-Seq技术对覆盖344,000种肽段抗原的文库进行系统性抗体反应分析,结果显示在诊断前时间点,抗体反应丰富度呈正态分布,整体中位数为1786个抗体结合肽段 (IQR:1518-2075),CD与UC患者间无显著差异。在所有参与者中,共检测到105,638个阳性抗体结合肽段,其中仅5174个在5-95%的个体中普遍存在,体现了抗体表位组库的高度个体特异性。
主成分分析显示,诊断前样本中PC1在CD与UC间存在差异 (p = 0.041),诊断后样本中PC2亦呈现亚型间差异 (p = 0.014),而其余主成分未见显著分离。进一步亚组分析表明,CD患者在诊断后PC1发生显著变化 (p = 0.028),而UC患者中未观察到类似趋势 (p = 0.142)。载荷分析提示,PC1主要受巨细胞病毒相关抗原驱动,PC2则与多种肠道微生物抗原如鞭毛蛋白和毒力因子相关,与既往在确诊IBD及一般人群中的发现一致。
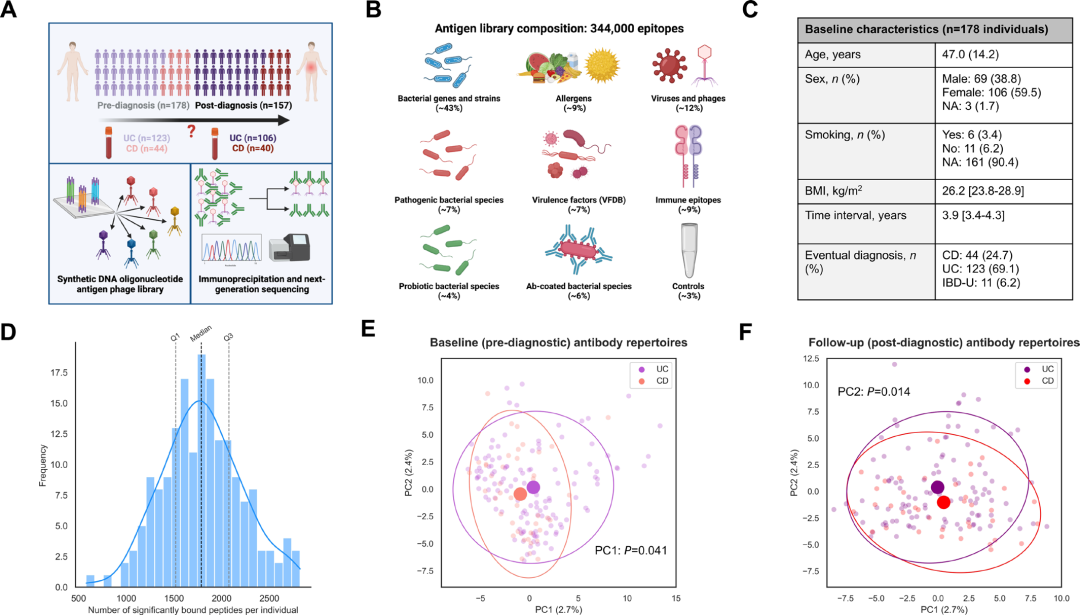
图 1: 178名个体在IBD诊断前后全身性抗体组库的表征
(A) 研究设计图。 (B) 抗原文库内容的示意图。 (C) 报告发展为IBD的178名个体的基线队列特征。 (D) 直方图显示在5-95%个体中出现的抗体结合肽段的多样性,蓝线代表分布的核密度估计,垂直虚线表示中位数和IQR边界。 (E-F) 基于基线 (诊断前,图E) 和随访 (诊断后,图F) 抗体组库的主成分分析图,显示了按诊断亚型标记的前两个主成分的质心和95%置信椭圆。
研究人员评估了157名IBD患者在诊断前后的抗体表位组库的纵向稳定性,结果显示,CD和UC患者的配对样本之间抗体反应谱高度一致,平均phi系数为0.72 (SD = 0.06),显著高于无关个体间的相关性 (CD:0.20±0.09;UC:0.19±0.06)。在322名健康个体 (Lifelines-DEEP子队列) 的验证分析中,自身配对样本的平均phi系数为0.71,显著高于无关个体间的0.24。尽管健康人群中无关个体的抗体组库相似性略高于IBD人群 (0.24 vs. 0.20/0.19),但差异无统计学意义。抗体结合肽段数量在整体IBD队列中诊断后显著增加 (中位数:1860 vs. 1786,p = 1.90×10⁻¹⁵),亚组分析显示,增长仅在UC患者中显著 (1787 vs. 1858,p = 2.57×10⁻¹⁵),而在CD患者中未达统计学显著水平。尽管抗体组库在总体上具有较高的时间稳定性,但诊断前后仍发生了疾病类型特异性的变化。
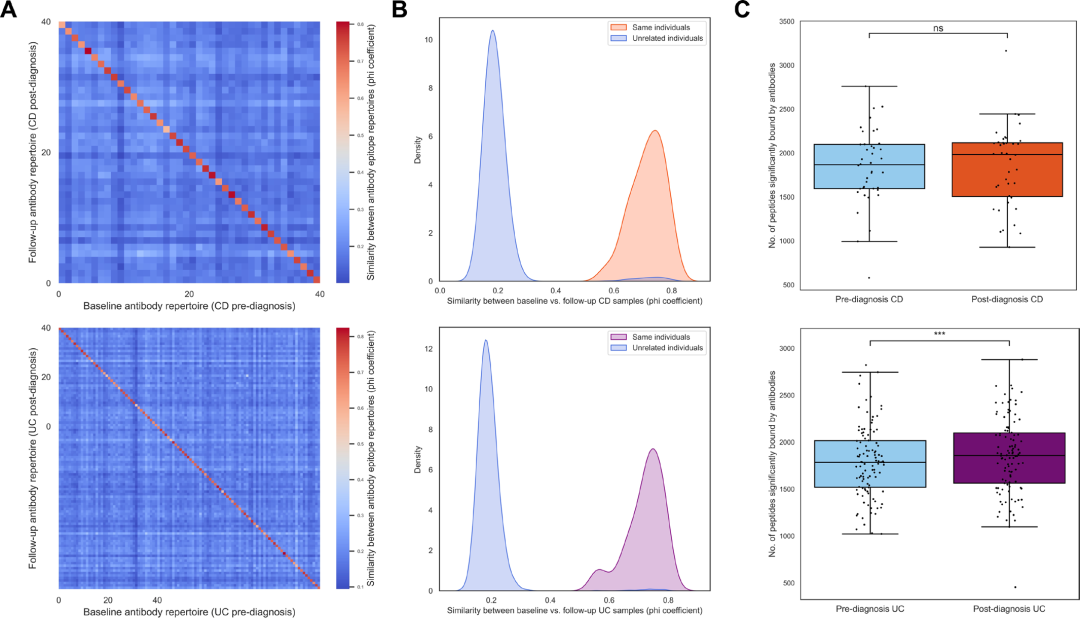
图 2: 全身性抗体表位组库在IBD诊断前后表现出高度的时间稳定性
(A) 热图可视化157名个体在诊断前和诊断后分析的抗体表位组库之间的相关性 (φ 系数) (上CD,下:UC),从图左上角到右下角的对角线代表同一个体抗体表位组库的相关性。 (B) 根据同一个体的匹配样本 (上:CD,红;下:UC,紫) 和无关个体的未配对样本 (蓝) 分离的φ系数分布。 (C) 在诊断前后评估时每个个体显著结合肽段数量的分布。
研究人员分析了157例IBD患者的配对样本,发现诊断前后共有59个抗体结合肽段出现差异富集 (FDR < 0.05),其中13个在诊断后更常见,46个更少见。分层分析显示,UC组的差异肽段有33个,而CD组仅有4个。诊断后,针对EB病毒 (如EBNA-1、VP26) 和
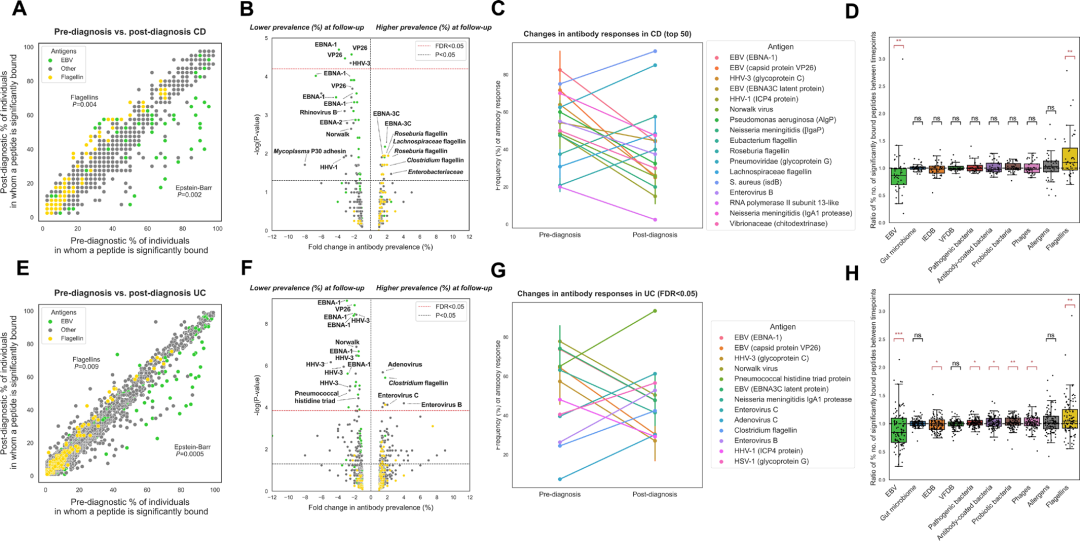
图 3: CD (A–D) 和UC (E–H) 诊断前后抗体表位组库的差异性变化
(A, E) 散点图显示CD (n=40,上) 和UC (n=106,下) 诊断前 (x轴) 与诊断后 (y轴) 抗体结合肽段的频率 (%)。黄点表示鞭毛蛋白,绿点表示EBV相关肽段 (Wilcoxon检验)。 (B, F) 火山图显示CD (上) 和UC (下) 诊断前后抗体反应的倍数变化 (计算为诊断后与诊断前的频率比值) 及其统计学显著性,黄点和绿点分别标记鞭毛蛋白和EBV相关肽段。 (C, G) 配对图展示CD (上,显示FDR < 0.05和名义p < 0.05的肽段) 和UC (下,仅显示FDR < 0.05的肽段) 中显著变化的抗体反应频率增减情况。 (D, H) 箱线图显示诊断前后不同抗原文库亚组中抗体结合肽段频率 (%) 的变化。
由于CD与UC患者间抗体结合肽段存在差异,研究人员进一步采用了梯度提升回归 (GBR) 与XGBoost两种机器学习算法,评估抗体组库在疾病诊断前、后区分两种亚型的潜力。结果显示,在诊断前,基于致病菌抗原亚组构建的分类模型性能最优,平均工作特征曲线 (ROC) 下面积 (AUC) 为0.67 (SD=0.06),略优于使用全数据集训练的模型 (平均 AUC=0.64,SD=0.08)。而在诊断后,鞭毛蛋白肽段子集所构建的模型表现最优,平均AUC达0.64 (SD=0.08),与肽段水平差异富集结果一致。
为验证所识别差异肽段的泛化能力,研究人员进一步在一个独立的确诊IBD队列 (CD=256,UC=207) 中进行测试,结果显示诊断前差异肽段在该队列中区分CD与UC的AUC为0.72 (SD=0.05) ,诊断后差异肽段的区分能力相当,表明疾病发生前后所获抗体特征均具有稳定的亚型判别价值。
此外,研究人员通过SHAP分析识别出对模型分类贡献显著的关键抗原,发现诊断前阶段主要包括N-乙酰胞壁酰-L-
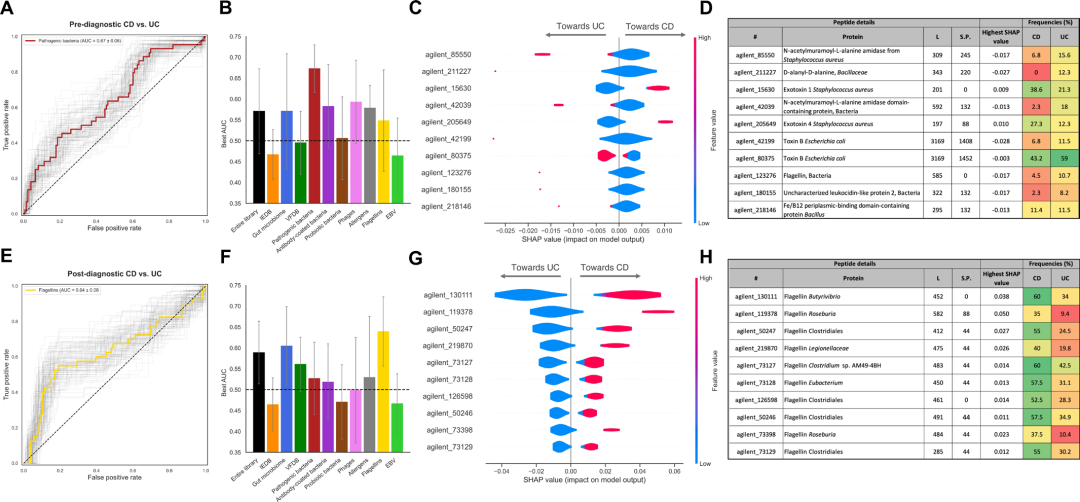
图 4: 基于抗体表位组库的机器学习模型在诊断前与诊断后均能有效区分将发展为CD或UC的个体
(A, E) 诊断前 (A,上) 和诊断后 (E,下) 阶段性能最佳模型的受试者ROC曲线,浅灰色曲线为Bootstrap迭代结果。 (B, F) 条形图展示在不同抗原文库亚组上训练的模型于诊断前 (B) 和诊断后 (F) 的最佳AUC及其Bootstrap标准差。黑色虚线表示无区分能力 (AUC = 0.50)。 (C, G) SHAP小提琴图展示性能最佳模型中贡献最大的前10个抗体结合肽段:诊断前为致病菌亚组模型 (对应 A),诊断后为鞭毛蛋白肽段模型 (对应 E)。每条水平线代表一个肽段,每个点代表一个体的贡献值。 (D, H) 表格列出 (C) 与 (G) 中前10个肽段的注释信息,包括肽段标识、蛋白质注释、长度 (L)、起始位置 (S.P.)、最高SHAP值,以及CD与UC个体在诊断前和诊断后阶段的阳性比例 (%)。
该研究首次利用高通量技术系统解析了IBD患者在诊断前数年及诊断后的抗体表位组库动态变化,揭示了IBD发病前即已存在的特异性免疫改变,不仅为阐明疾病早期免疫发病机制提供了新的科学依据,也提示这些抗体特征谱具有作为预测性生物标志物的潜力。
致谢
中南大学湘雅三医院 舒海婷
浙江大学医学院附属第二医院 孙誉郝
中南大学湘雅三医院
中南大学湘雅三医院
对本篇文章解读做出的贡献
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)