来源:IBD Daily
遗传易感个体在环境因素持续作用下可发生肠道屏障损伤与慢性炎症。菌群失调在IBD发病中的作用已获广泛证据支持,如产短链脂肪酸的有益菌Faecalibacterium prausnitzii在IBD患者肠道与黏膜中显著减少;
当大量抗原突破肠黏膜屏障,可诱发过度免疫反应及宿主组织损伤。中性粒细胞作为最先抵达炎症部位的免疫细胞,通过病原清除与中性粒细胞胞外诱捕网 (NETs) 的释放,在炎症控制与黏膜修复间扮演关键角色。其中,PAD4可被多种抗原激活,催化组蛋白瓜氨酸化,进而引起染色质解聚及NETs释放。该过程 (NETosis) 以释放由解聚DNA及MPO、NE等抗菌蛋白构成的网状结构为特征,参与多种病理过程。在UC患者发炎结肠及循环中性粒细胞中均观察到NET形成过度,且与炎症持续相关。NETs可延缓
Odoribacter splanchnicus (O. splanchnicus) 属于拟杆菌门。其丰度下降与
本研究以O. splanchnicus为研究对象,采用DSS诱导的急性肠炎模型和Il-10-/-自发肠炎模型模拟IBD,系统评估其对肠炎的缓解作用及潜在机制。通过单细胞转录组测序全面描绘内脏拟杆菌干预后肠道免疫细胞的谱系构成与功能变化,并结合流式细胞术、bulk RNA测序、免疫印迹、免疫荧光及ELISA等多种技术,对中性粒细胞数量及功能改变进行验证。进一步采用非靶向代谢组学与靶向胆汁酸代谢组学分析鉴定与内脏拟杆菌抗炎效应相关的关键代谢物,筛选并验证能够缓解肠炎及直接抑制NETs形成的功能性代谢产物。通过抗生素预处理、粪菌移植模型、无菌小鼠实验及细菌体外共培养体系,探讨内脏拟杆菌促进关键代谢物产生的机制与菌群依赖性。
➤O. splanchnicus在DSS诱导的结肠炎和Il-10-/-小鼠模型中减轻炎症和肠道屏障损伤
研究团队首先通过16S rRNA测序发现,UC患者肠道内O. splanchnicus及其所属的Odoribacter属丰度均显著降低 (图1A)。为进一步验证,采用qPCR检测了15例新确诊UC患者的样本,再次确认该菌的绝对丰度下降 (图1B)。在DSS诱导的急性结肠炎模型中,O. splanchnicus干预显著减轻了小鼠体重下降 (图1D) 及炎症相关的结肠缩短 (图1H)。组织学分析显示,黏膜损伤、隐窝结构破坏及免疫细胞浸润等关键炎症表征均明显改善 (图1E-F)。在肠道屏障方面,O. splanchnicus处理显著上调了紧密连接蛋白Zo-1与Claudin-1的表达 (图1I-L),并通过AB-PAS染色证实其促进了黏蛋白Muc2的表达和杯状细胞数量的恢复 (图1K, 1M)。此外,在Il-10-/-自发慢性结肠炎模型中,O. splanchnicus同样表现出抗炎与屏障保护作用 (图1N)。以上结果共同表明,O. splanchnicus在急性和慢性结肠炎模型中均具有缓解炎症、修复肠道屏障的潜力。
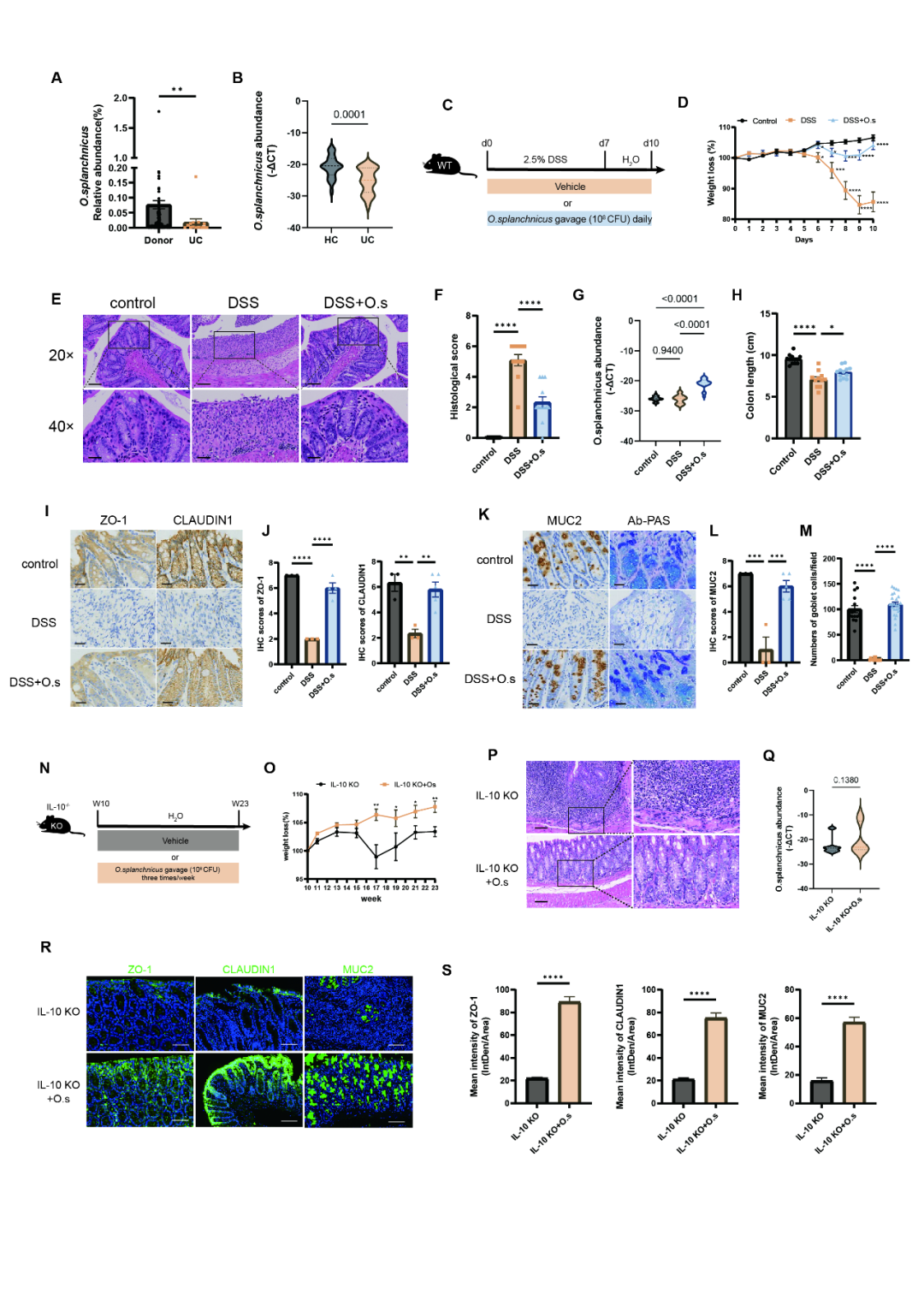
图1. O. splanchnicus在DSS诱导的结肠炎和Il-10基因敲除小鼠模型中缓解炎症及肠道屏障损伤
➤O. splanchnicus调节结肠炎小鼠的结肠免疫,特别是中性粒细胞
为系统探究O. splanchnicus在结肠炎中的免疫调节机制,研究团队通过单细胞RNA测序分析了该菌干预后小鼠结肠组织的免疫细胞图谱 (图2A)。经UMAP降维分析,所有细胞被划分为8个主要亚群 (图2B-D)。进一步聚焦中性粒细胞发现,其可细分为7个功能亚群 (图2E),且O. splanchnicus干预显著改变了各亚群比例:Cluster 1、2、4、5、6下降,而Cluster 0和3上升 (图2F)。基因富集分析揭示了各中性粒细胞亚群的特异功能:Cluster 0主要关联NOD样受体、TNF及趋化因子信号通路,Cluster 1与细胞凋亡相关,Cluster 2参与C型凝集素受体信号与氧化磷酸化,而Cluster 3则涉及自噬、TNF信号及线粒体自噬 (图2G)。流式细胞术检测显示,在DSS诱导的急性结肠炎和Il-10-/-慢性肠炎模型中,O. splanchnicus均显著降低结肠组织Gr-1⁺中性粒细胞在CD45⁺细胞中的比例 (图3H–I),并下调促炎因子IL-6与IL-1β表达 (图3J-K),在Il-10-/-模型中也获一致结果 (图3L-O)。进一步通过体内中性粒细胞清除实验证实,清除中性粒细胞后,O. splanchnicus的抗炎作用消失 (附图4B-D)。综上,O. splanchnicus可通过调节结肠中性粒细胞的群落结构与功能状态,在急性和慢性结肠炎模型中发挥免疫调控与保护作用。
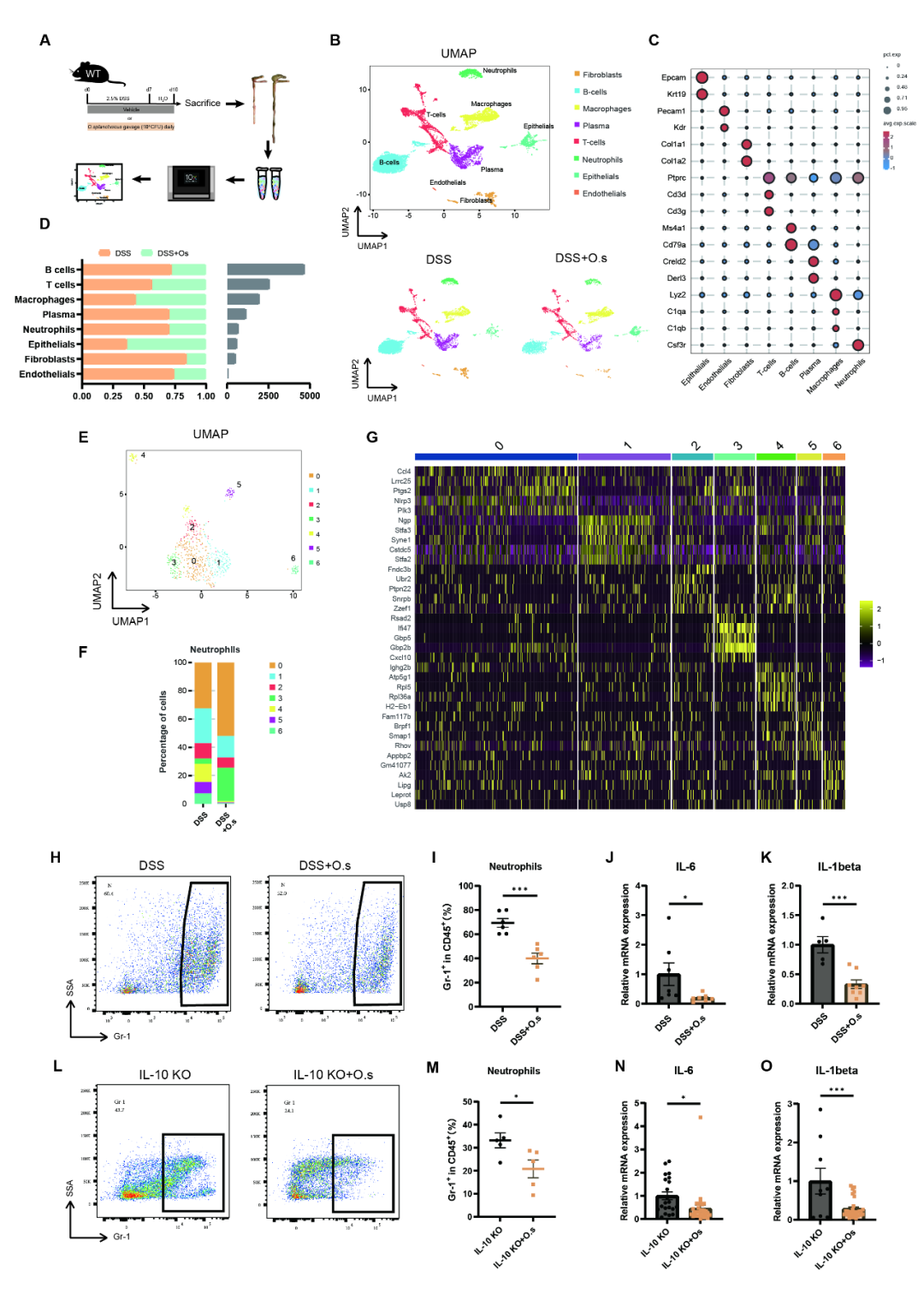
图2 O. splanchnicus 重塑结肠炎小鼠免疫景观并抑制中性粒细胞浸润
➤O. splanchnicus通过调节NETs的形成与降解发挥抗炎及肠道屏障保护作用
为解析O. splanchnicus在结肠炎中的基因调控网络,研究团队对小鼠结肠组织进行转录组测序与分析。结果显示,O. splanchnicus显著改变多个基因表达 (图3A),KEGG富集分析进一步揭示其特异性影响中性粒细胞胞外诱捕网 (NETs) 形成等免疫相关通路 (图3B)。在机制层面,O. splanchnicus干预显著降低了关键酶PAD4的表达 (图3C-E),并下调中性粒细胞来源的MPO与瓜氨酸化组蛋白 (CitH3) 水平 (图3D-E)。血清中CitH3和游离DNA (cfDNA) 含量也同步下降 (图3F-G)。免疫荧光共定位分析进一步证实,O. splanchnicus有效抑制CitH3与MPO在结肠组织中的共定位 (图3H-I),提示其调控NETs形成与降解的过程。为验证该机制的必要性,研究在Padi4-/-小鼠中构建结肠炎模型,发现O. splanchnicus未能缓解其体重下降、结肠缩短、组织学损伤及屏障破坏等表型 (图3K-O),表明其保护作用依赖于PAD4介导的NETs调控通路。综上,O. splanchnicus通过调控PAD4以平衡NETs的形成与降解,进而发挥抗炎及屏障保护作用。
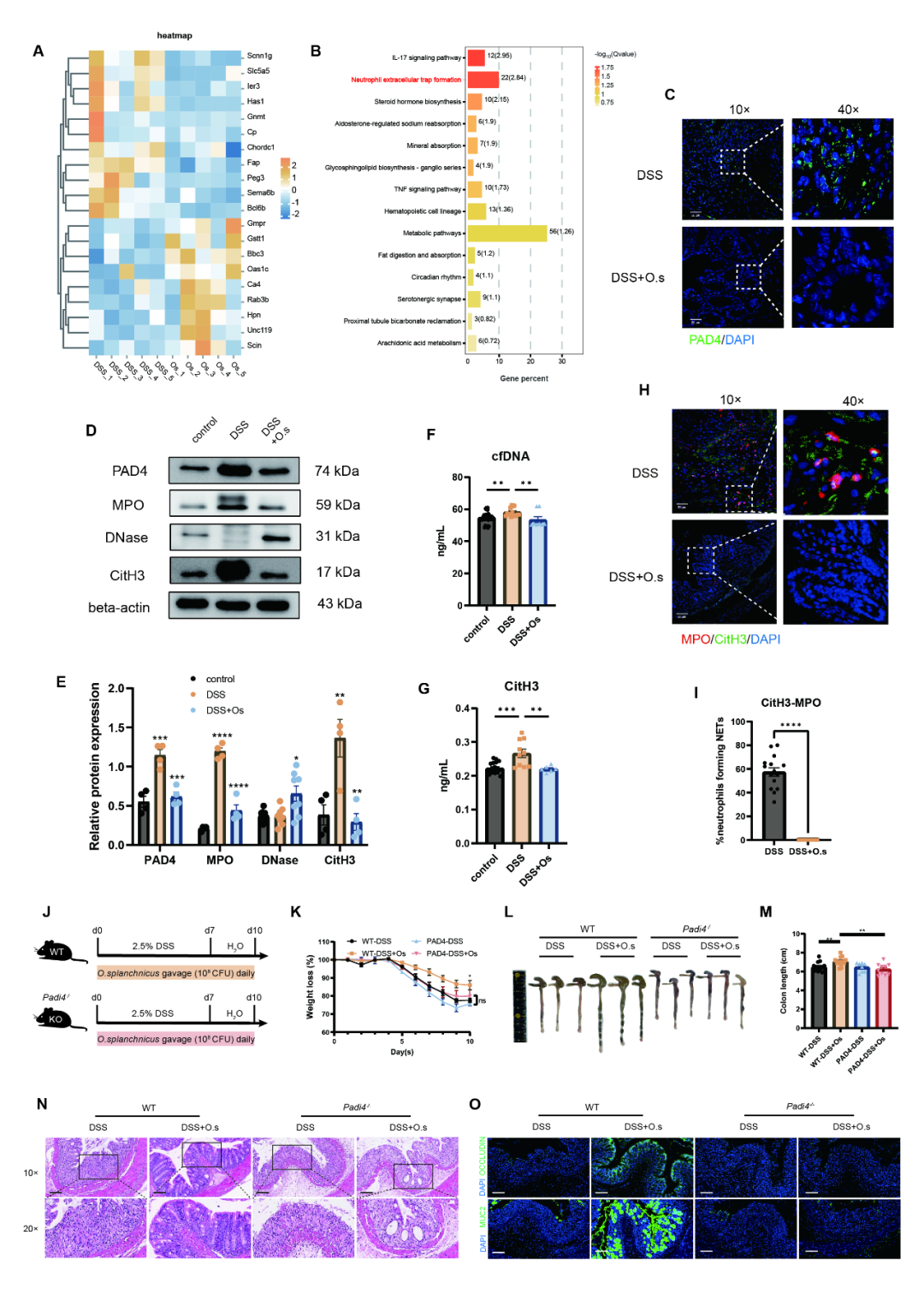
图3 O. splanchnicus通过调控NETs的形成与降解发挥抗炎及肠道屏障保护作用
➤O. splanchnicus通过重塑胆汁酸池促进LCA驱动的中性粒细胞调节
为探究O. splanchnicus调控的代谢物,研究采用LC-MS/MS对小鼠粪便进行非靶向代谢组学分析。OPLS-DA模型显示两组代谢谱显著分离 (图4A),通过VIP评分鉴定出差异代谢物 (图4B-C),其中次级胆汁酸LCA在干预组显著富集 (图4C)。靶向分析进一步证实,O. splanchnicus提升了粪便总胆汁酸水平 (图4D) 及次级/初级胆汁酸比率 (图4E),并促进了LCA及其衍生物的生成 (图4G)。该趋势在Il-10-/-小鼠模型中得以验证 (图4F,H)。机制上,qPCR分析显示O. splanchnicus干预后,肝脏胆汁酸合成与转运基因 (Bacs、Bsep、Cyp2c70等) 表达上调 (图4I);回肠胆汁酸受体Vdr表达升高,而转运蛋白Ostb与Astb表达下降 (图4J);结肠胆汁酸受体Gpbar1表达增加 (图4K)。此外,干预组粪便中结合型胆汁酸减少、非结合型胆汁酸增多 (图4L-M)。这些结果提示O. splanchnicus重塑了粪便胆汁酸谱的组成。
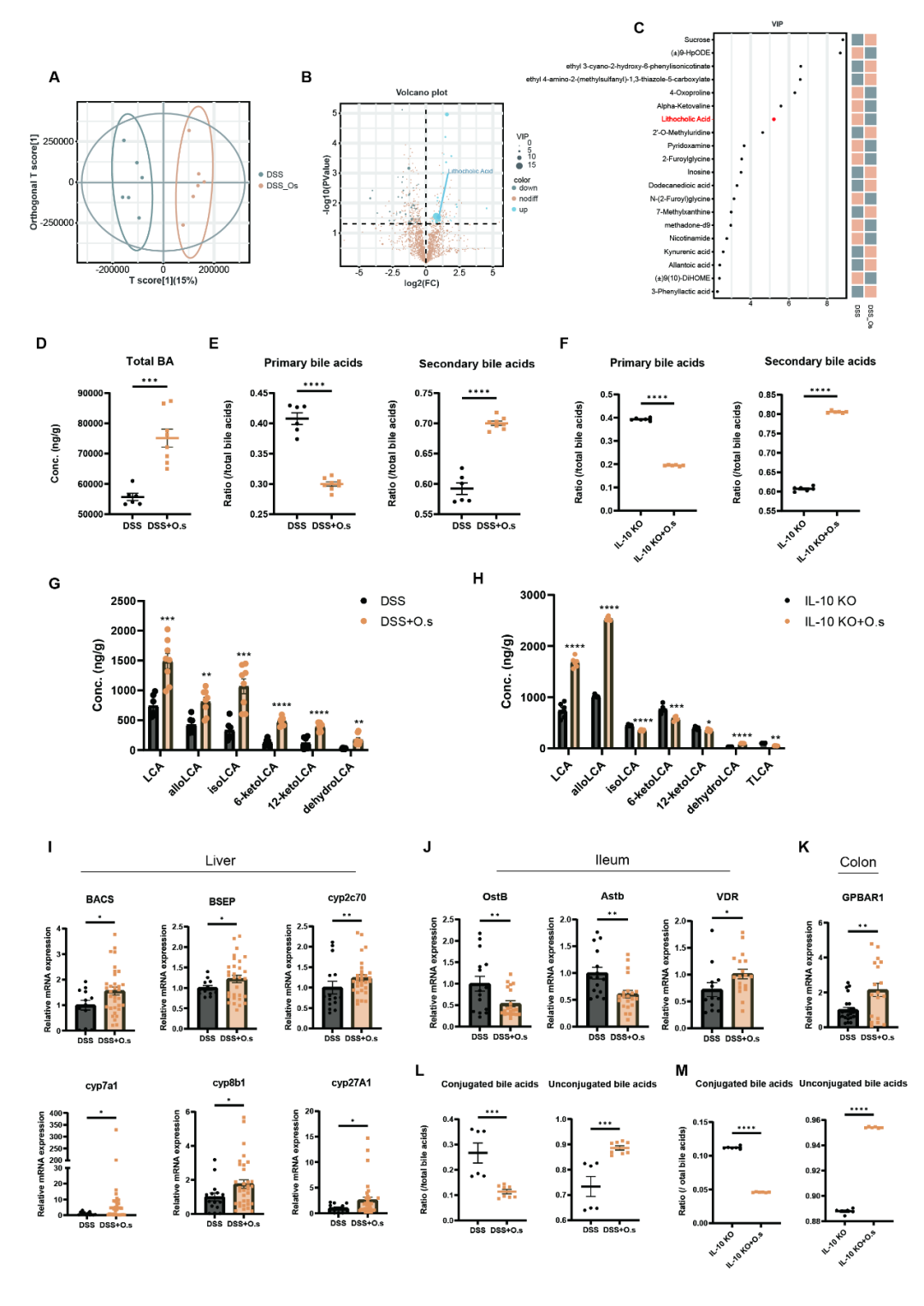
图4 O. splanchnicus在DSS诱导结肠炎及Il-10-/-小鼠模型中调控胆汁酸代谢
LCA作为关键次级胆汁酸,其单独干预足以缓解DSS诱导小鼠的体重下降、结肠缩短及组织损伤 (图5A-C)。在机制层面,LCA显著下调NETs形成关键蛋白PAD4、MPO、NE与CitH3的表达 (图5E-F),并降低血清CitH3水平 (图5D)。组织共染色显示,LCA处理组中CitH3与MPO/NE的共定位减弱 (图5I-J),中性粒细胞标志物Ly6G与CitH3/PAD4的共表达也同步减少 (图5G-H)。体外实验进一步证实,LCA直接抑制中性粒细胞NETs形成,表现为CitH3/MPO共定位减弱、细胞外网状DNA结构减少 (图5M-N) 及cfDNA/MPO释放降低 (图5L)。以上结果阐明,O. splanchnicus通过调控肠道菌群-胆汁酸代谢轴,驱动LCA介导的中性粒细胞功能重塑,进而抑制炎症并促进屏障修复。
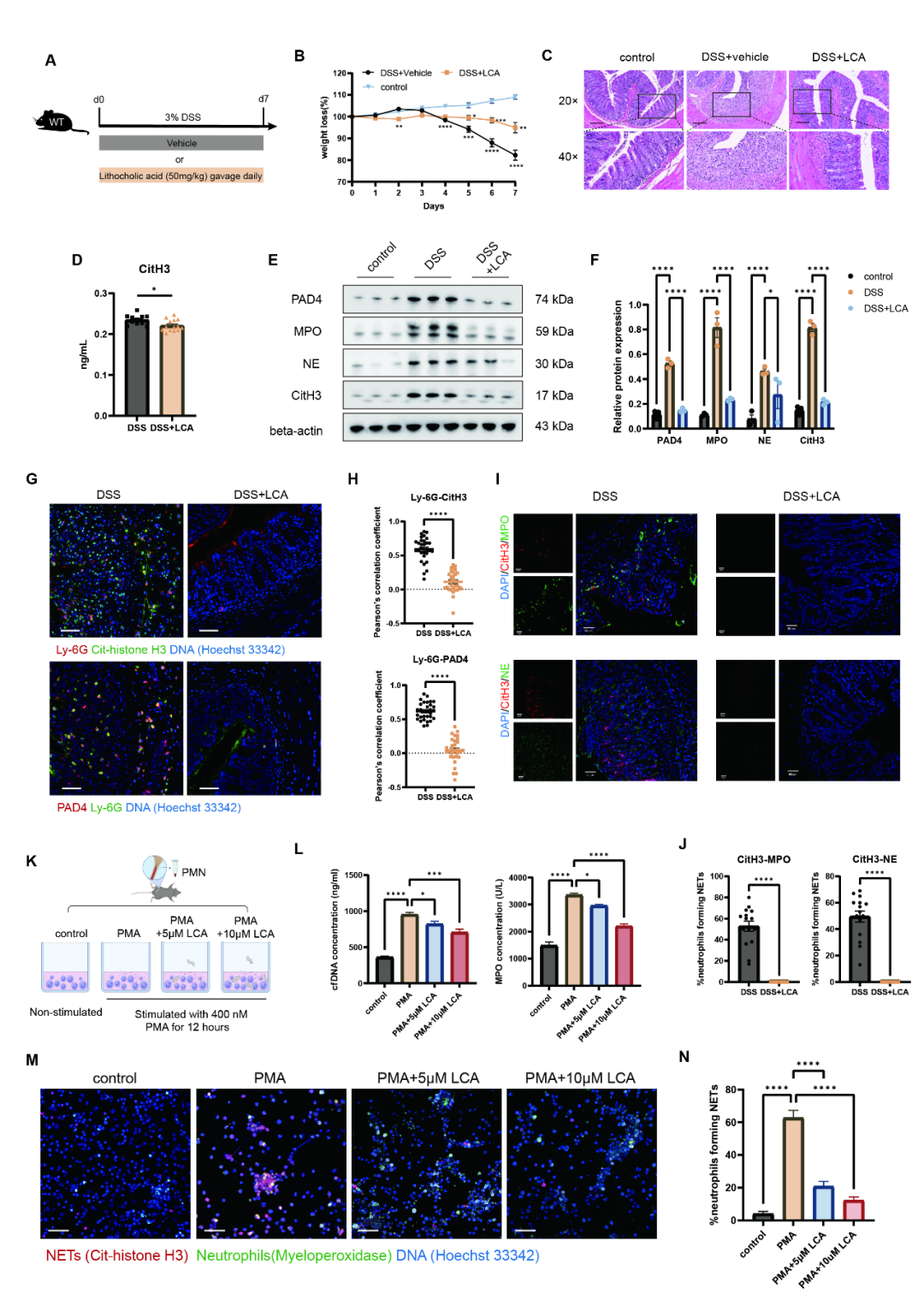
图5 LCA抑制NET形成
➤O. splanchnicus促进LCA的转化依赖于肠道菌群
为探究O. splanchnicus是否直接转化LCA,研究团队在其条件培养基中添加初级胆汁酸底物培养72小时 (图6A),LC-MS/MS分析显示LCA水平未见增加 (图6B)。在无菌小鼠模型中,口服O. splanchnicus两周后同样未观察到LCA水平升高 (图6E-F),表明该菌在体内外均不能直接转化LCA。进一步通过16S rRNA测序发现,O. splanchnicus干预显著提升肠道菌群多样性,并富集了拟杆菌属、颤螺旋菌属等潜在益生菌 (图6G-H)。值得注意的是,负责胆汁酸去结合和去羟化反应的关键功能菌丰度增加,包括含BSH的拟杆菌属及含HSDH的拟杆菌属/真杆菌属 (图6G-H)。为验证菌群在LCA转化及保护作用中的必要性,FMT实验显示,移植O. splanchnicus干预组粪便可显著缓解受体小鼠的炎症及屏障损伤 (图6I-L),并提升LCA的含量。而在抗生素清除菌群的小鼠中,O. splanchnicus未能改善组织学评分与屏障修复 (图6S-T)。综上,O. splanchnicus通过调控肠道菌群结构与功能,促进LCA转化,进而发挥其保护作用,该过程依赖于菌群的存在。
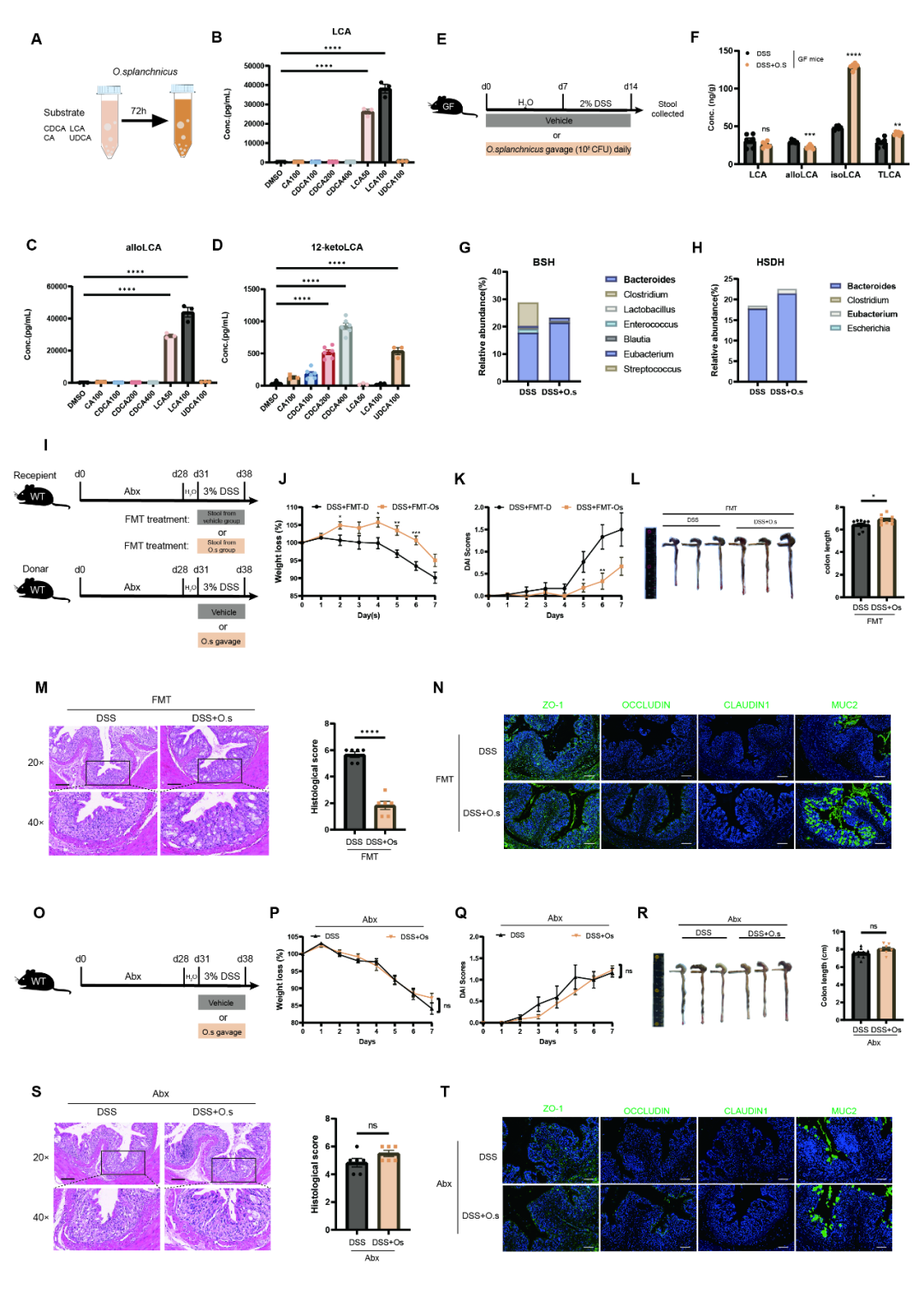
图6. O. splanchnicus通过肠道菌群促进LCA转化
➤O. splanchnicus通过LCA抑制Nlrp3-Gsdmd信号介导的NET形成
NLRP3通路可介导特定肠道菌群及其代谢物触发的炎症与免疫反应。为探究NLRP3在结肠NET平衡调控中的作用,研究发现LCA处理可降低小鼠结肠组织中NLRP3、ASC与IL-18的表达 (图7C-F),并减少GSDMD剪切体比例 (图7C,G),提示LCA能够抑制NLRP3通路活性及细胞焦亡。单细胞RNA测序数据进一步显示,Nlrp3在中性粒细胞中表达最高,且O. splanchnicus干预可降低结肠中性粒细胞的Nlrp3表达 (图7A),该结果经NLRP3与Ly-6G的免疫荧光共定位验证 (图7B)。在Nlrp3-/-小鼠中,LCA失去对NET形成的抑制作用:NET相关蛋白 (PAD4、MPO、DNase) 表达无显著变化 (图7I–L),CitH3与MPO/NE的共定位也未减弱 (图7M-N)。同时,LCA与O. splanchnicus在Nlrp3-/-模型中均未表现出抗炎 (图7O-P) 及屏障修复作用 (图7Q-T)。以上结果说明,O. splanchnicus通过促进LCA转化,依赖NLRP3-GSDMD通路调控NET的形成与降解,进而发挥其对结肠炎的保护作用。
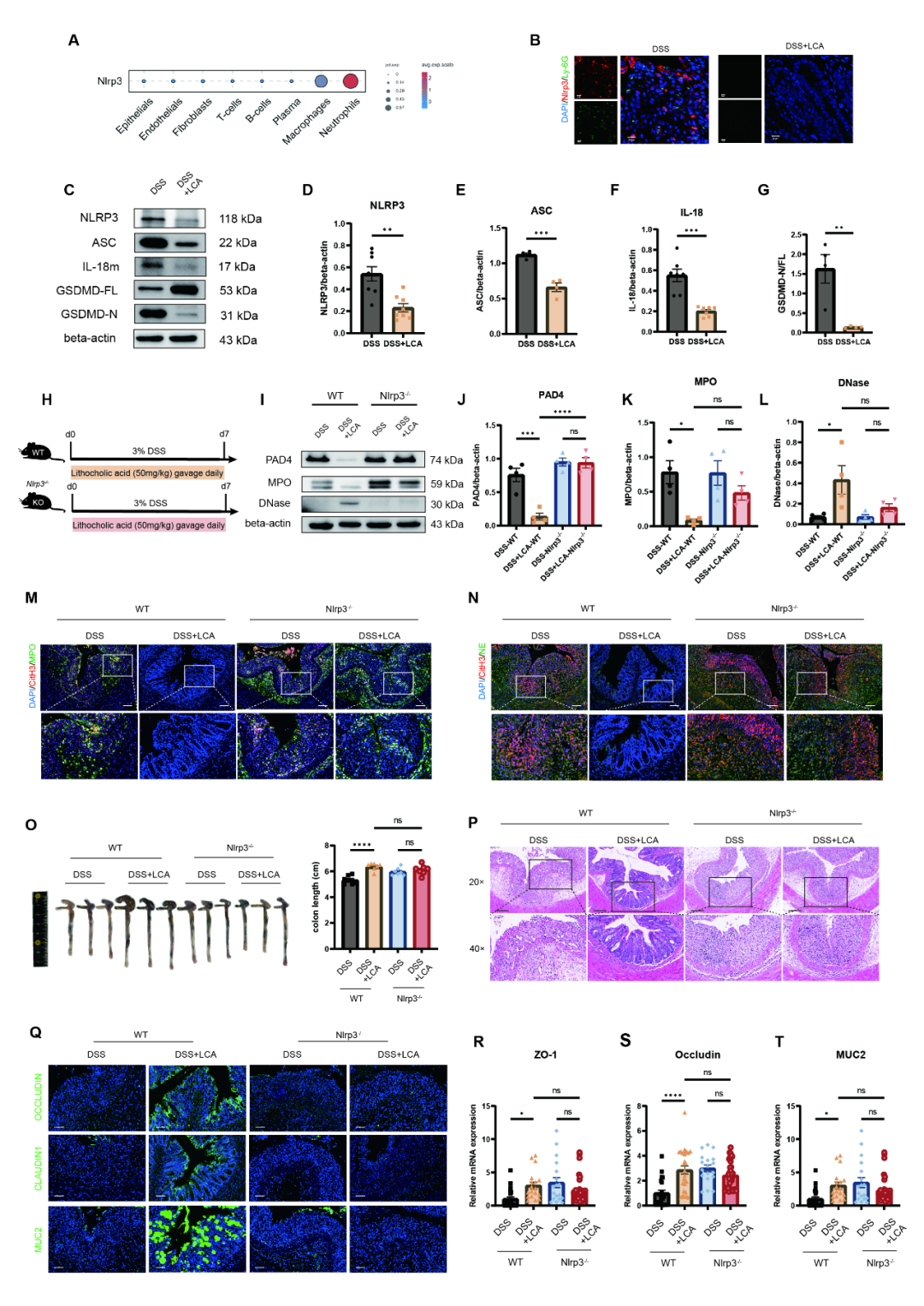
图7. O. splanchnicus通过促进LCA生成经NLRP3-GSDMD信号通路抑制NET形成
➤LCA、NETs及Nlrp3表达与UC患者体内O. splanchnicus丰度相关
为明确前述发现的临床价值,本研究进一步分析了UC患者中O. splanchnicus与NET形成之间的关联。与健康对照 (HC) 相比,UC患者结肠组织中瓜氨酸化组蛋白3与MPO的共定位显著增强 (图8A, C),提示NETs形成增多;同时NLRP3表达上升 (图8B, D),而紧密连接蛋白ZO-1表达下降 (图8F-G),反映上皮屏障受损。Spearman相关分析表明,O. splanchnicus 丰度与ZO-1表达呈正相关 (r=0.77,P<0.0001),而与NETs比例 (r=-0.83,P<0.0001) 及NLRP3表达 (r=-0.67,P<0.0001) 均呈显著负相关。LC-MS/MS检测进一步显示UC患者粪便中LCA水平显著降低 (图8H)。上述结果共同提示,UC患者中O. splanchnicus的减少与NETs形成增强密切相关,为探索UC治疗新靶点提供了临床依据。
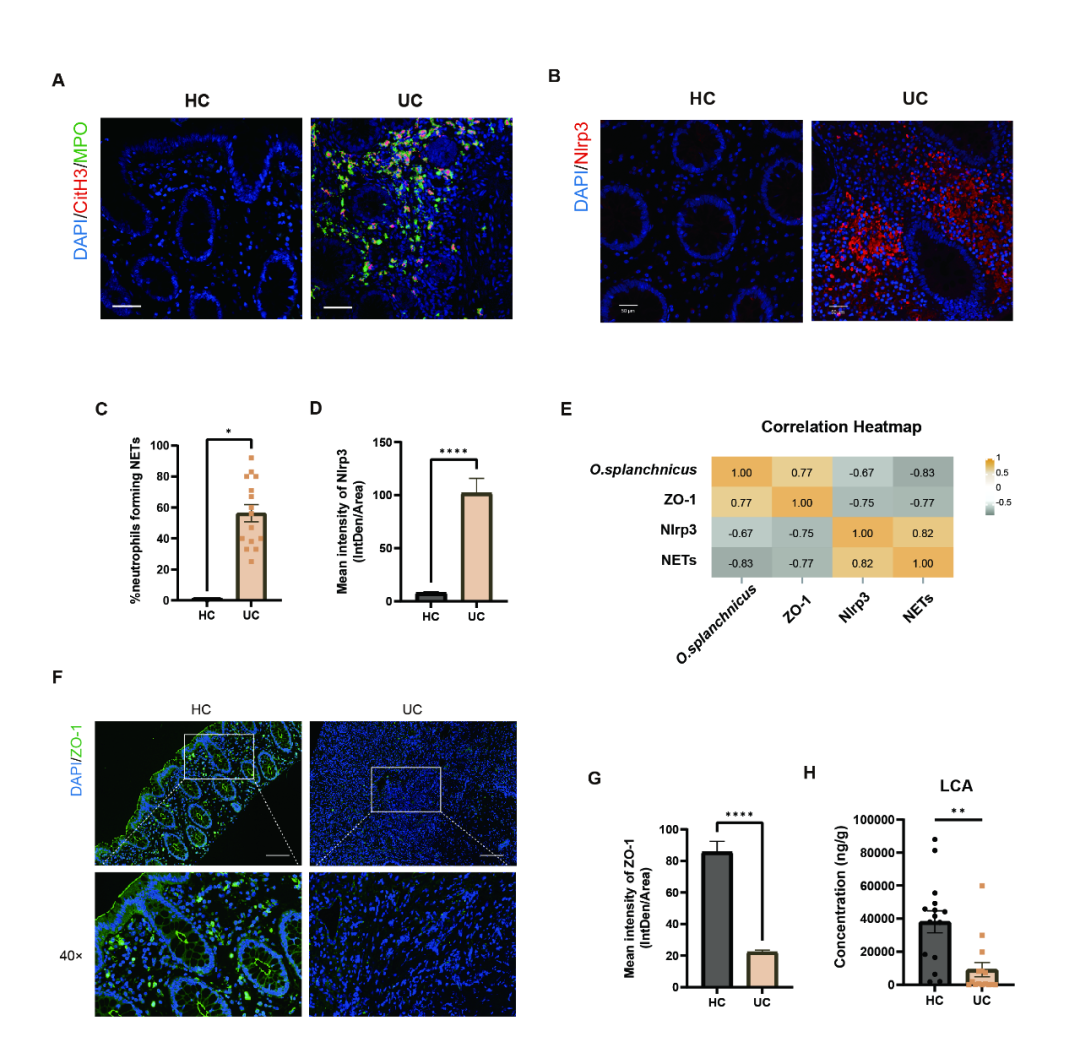
图8. UC患者呈现LCA水平下降、NETs增多及Nlrp3表达升高
本研究在UC患者中观察到O. splanchnicus的减少;在DSS诱导急性结肠炎和Il-10-/-自发慢性肠炎模型中,O. splanchnicus均表现出显著的抗炎与屏障修复作用。机制上,该菌通过调控次级胆汁酸
致谢
广州市第一人民医院聂玉强教授与周有连教授
团队供稿
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)