肠道炎症的综合多模型分析揭示临床前和临床 IBD 的关键分子特征
Integrated multimodel analysis of intestinal inflammation exposes key molecular features of preclinical and clinical IBD
Gut
PMID: 40301114 [IF=25.8]
来源:IBD Daily
本研究采用了一种综合多模型的策略,在C57BL/6J小鼠中构建了13种IBD小鼠模型以模拟不同类型的肠道炎症,涵盖屏障损伤、免疫调节和感染三大类,包括急慢性DSS结肠炎 (AcDSS/cDSS)、Oxazolone结肠炎 (OxC)、TNBS结肠炎、T细胞转移模型 (TnfΔARE)、Caspase8ΔIEC小鼠模型等。研究人员从这些小鼠模型中提取结肠或回肠组织进行RNA测序,通过差异表达分析、基因本体论 (GO) 富集分析、KEGG通路分析等手段,对小鼠转录组数据进行了深入分析。随后,研究人员采用了单细胞RNA测序 (scRNA-Seq) 对肠道细胞进行更细致的分析,并使用加权基因共表达网络分析 (WGCNA) 识别了不同模型中与炎症相关的基因模块。
此外,研究人员将小鼠模型的数据与公开的IBD患者数据集 (儿童、成人) 及本地队列进行了对比,识别出小鼠模型与患者之间共享的分子特征,揭示了与IBD相关的保守基因网络。为了方便进一步的分析,研究团队开发了一个名为Shared Experimental Inflammation Data (SEPIA) 的在线工具,允许研究人员访问和分析小鼠IBD模型与人类IBD患者的转录组数据。
结果显示,除Casp8ΔIEC外,所有模型均出现鼠粘膜分子炎症评分 (mMIS) 显著上升。进一步通过scRNA-Seq与解卷积分析,发现炎症小鼠免疫细胞比例上升,与组织学观察一致。各类模型细胞组成存在差异,在cDSS与Casp8ΔIEC中出现了鳞状样上皮细胞,而Casp8ΔIEC、AcTNBS、Hhepa与Crode中肌肉样细胞减少。此外,蛋白质组学与转录组学证实B细胞与TA细胞、肠神经元与TA细胞之间存在负相关关系。小肠模型中也观察到B细胞与TA细胞标记物间的负相关。
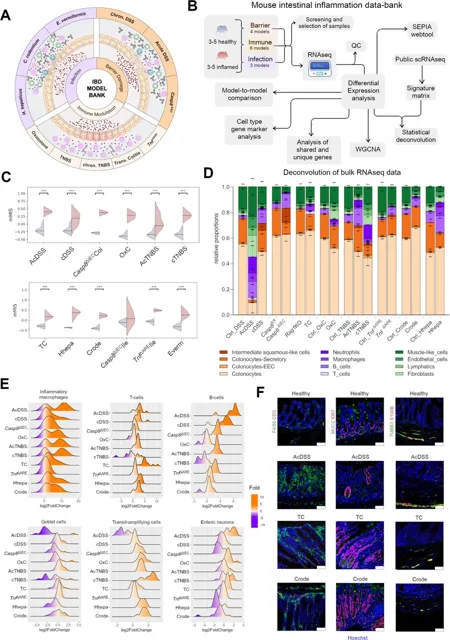
图1:小鼠IBD模型中组织细胞组成的变化
(A) 小鼠模型三个主要类别的分布:感染、屏障损伤和免疫调节; (B) 展示了用于小鼠IBD模型的转录组数据库SEPIA的建立流程,包括模型筛选、质量控制 (QC) 和分析步骤; (C)各模型与相应对照组的mMIS; (D)结肠模型中去卷积后的细胞类型标记物; (E) 展示了选定细胞类型标记基因在结肠小鼠模型中的变化幅度; (F) 免疫荧光染色结果,用于标记巨噬细胞 (绿色,第1列)、杯状细胞 (绿色,第2列)、转运增生细胞 (红色,第2列)、肠神经元 (绿色,第3列) 和肠神经胶质细胞 (红色,第3列),在各类模型中的表达情况。 (***表示padj
为系统解析不同小鼠模型中IBD相关通路的共享与特异性转录特征,研究人员进一步对结肠与小肠模型中共同差异表达基因进行GO功能分析显示:结肠模型中437个共同上调基因显著富集于固有免疫、趋化及细菌应答等经典炎症通路,而小肠模型中627个共同下调基因则主要涉及核糖核蛋白组装、mRNA代谢与DNA损伤应答等过程;结肠共同下调基因功能富集较弱,小肠共同下调基因则显著参与抗菌反应与离子转运等。通路富集分析进一步揭示:结肠屏障损伤模型中炎症反应、IFN-γ与TNF通路显著激活,免疫调节模型中DNA修复与TNF通路上升;感染模型中Crode与Hhepa在多数通路上调中一致;AcTNBS与OxC模型中Notch与Wnt通路明显抑制;小肠模型中IFN-γ通路则在所有小肠模型中一致上调。结果表面, TNF与IFN-γ信号在各类模型中起核心作用,且AcTNBS/cTNBS结肠炎中存在Notch与Wnt通路的特异性抑制。
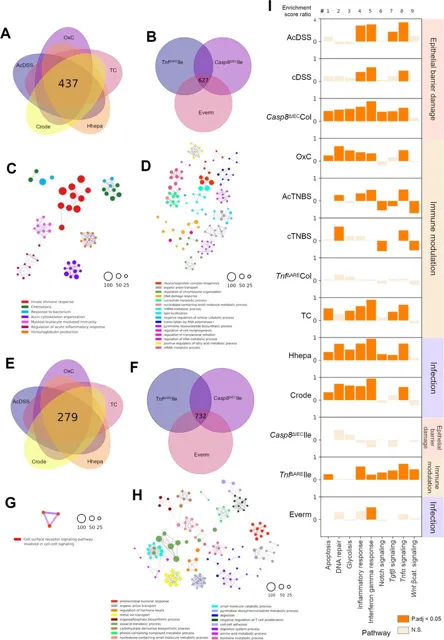
图2:小鼠模型间的调控共性与差异
(A-B) 结肠炎 (A) 与回肠炎 (B) 模型之间共同上调基因的Venn图; (C-D) 基于GO术语的语义相似性网络,分别来自A和B中的上调基因集; (E-F) 结肠炎 (E) 与回肠炎 (F) 模型之间共同下调基因的Venn图; (G-H) 基于GO术语的语义相似性网络,分别来自E和F中的下调基因集; (I) 每个小鼠模型中去卷积后标志性通路的相对表达变化。
研究人员采用了WGCNA在结肠与小肠小鼠模型中分别鉴定出14个和13个共表达模块,其表达特征与预期功能一致,结肠ME6与小肠ME4模块均显著富集“炎症反应”相关GO条目。此外,研究还发现结肠ME2和小肠ME6模块均与羧酸代谢过程相关,且包含一系列具有潜在免疫抑制功能的基因,包括调控类固醇合成的Nr5a2以及参与胆固醇代谢的Cyp家族基因,同时这些模块也涉及调节单羧酸供应的代谢免疫相关基因。小肠特有的ME2模块则显著富集“RNA加工”类基因,这些基因在p53应激反应中发挥作用。结果表明,小鼠模型和人类IBD患者队列之间在关键途径、细胞因子和基因调节上的保守性和差异性。
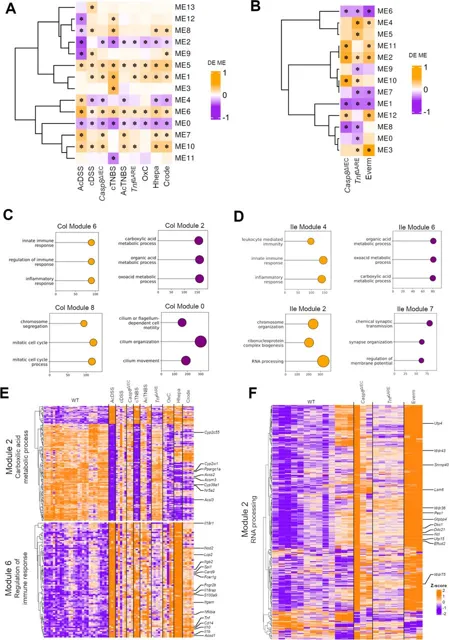
图3:小鼠模型数据集中的加权基因共表达网络分析
(A-B) 展示了应用于结肠炎和回肠炎样本的WGCNA中观察到的模块变化,带 * 的变化表示limma后p值小于0.05; (C-D) 展示了在结肠 (C) 和回肠 (D) WGCNA分析中选定模块中的前3个GO术语的富集情况; (E-F) 展示了来自结肠和回肠小鼠模型的选定WGCNA模块中的富集基因的热图。
比较小鼠模型与人类IBD患者转录组数据显示,趋化因子信号、细胞因子受体、JAK/STAT及TNF信号等核心炎症通路在多个模型与患者队列中高度相关。部分KEGG通路呈现模型特异性关联,如
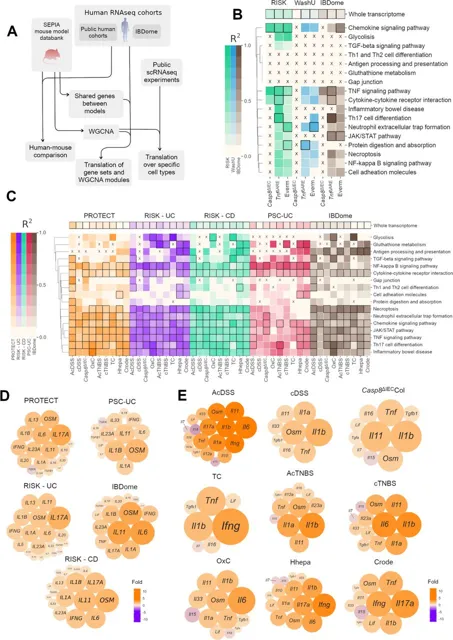
图4:小鼠模型与患者队列之间的调控保守性
(A) 将SEPIA小鼠模型数据库与人类IBD队列转录组数据进行统计比较的分析流程图; (B-C)选定GO本体在多种小鼠结肠炎模型与人类UC队列转录组数据 (B) 以及小鼠回肠炎模型与人类CD队列转录组数据 (C) 之间的相关性。标记为X的单元格表示因共享基因少于10个未进行回归分析; (D-E) 结肠人类IBD队列 (D) 和结肠小鼠炎症模型 (E) 中的细胞因子表达变化。
通过比较小鼠模型与人类IBD队列的转录组数据,研究人员发现结肠与小肠模型中共同调控的基因在相应患者队列中呈现保守的表达模式,其中部分基因隶属于WGCNA鉴定的ME6与ME2等共表达模块。尽管小肠ME2模块中“RNA加工”相关类别未在患者数据中重现,但“羧酸代谢过程”的下调在物种间具有明显保守性。
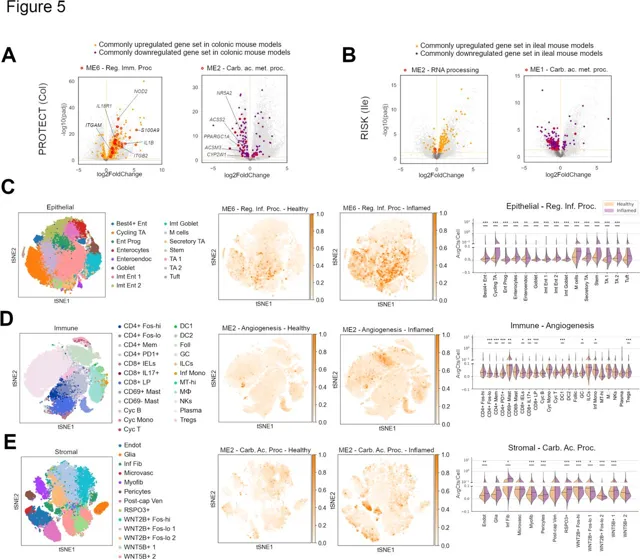
图5 由独特的IBD相关单细胞簇表达的保守本体
(A-B) UC (A) 与CD (B) 患者队列的火山图,左侧为来自结/回肠炎小鼠模型的共同上调基因的同源基因,右侧为共同下调基因。所有在小鼠结肠炎模型中共同调节并达到显著性阈值的基因以橙色或紫色高亮显示,属于WGCNA小鼠结肠炎模块ME116和ME32的基因标记为红色。 (C-E) 来自Smillie等人研究的UC患者单细胞RNA测序 (scRNA-Seq) 数据集的上皮 (C)、免疫 (D) 和基质 (E) 区室的t-SNE聚类结果。左图为t-SNE聚类,中图为按患者健康状态分隔的t-SNE,颜色表示从WGCNA模块中选定路径的基因平均表达,右图为展示每个注释簇中基因表达变化的提琴图。
进一步分析揭示,与纤毛组织相关的ME0模块在小鼠多个结肠炎及小肠模型中显著下调,该现象在成人队列中也得到印证,且扫描电镜结果证实患者及AcTNBS模型均存在微绒毛结构损伤,提示纤毛/微绒毛缺陷在克罗恩病与溃疡性结肠炎中具有共性。此外,线粒体功能异常也在模型与患者间呈现一定保守关联。这些发现从共表达模块、细胞亚结构至细胞器层面,系统揭示了IBD相关病理特征在临床前模型与患者之间的保守性与差异性。
研究通过对13种常用小鼠肠道炎症模型的多组学综合分析,系统揭示了与临床IBD在分子层面上的保守与差异特征。研究发现,小鼠模型与人类IBD在核心炎症通路及关键炎症因子上具有高度保守性,同时也存在代谢、上皮屏障功能等方面的差异。总体而言,该研究为IBD的分子机制研究和临床前模型选择提供了系统框架和重要资源,有助于提高IBD基础研究的转化价值。
致谢
中南大学湘雅三医院 舒海婷
中南大学湘雅三医院 王思丹
中南大学湘雅三医院 陈杰
中南大学湘雅三医院 王晓艳
对本篇文章解读做出的贡献
参考文献
[1]Gonzalez-Acera M, Patankar JV, Erkert L, et al. Integrated multimodel analysis of intestinal inflammation exposes key molecular features of preclinical and clinical IBD. Gut. 2025;74(10):1602-1615. Published 2025 Sep 8. doi:10.1136/gutjnl-2024-333729.
医脉通是专业的在线医生平台,“感知世界医学

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)