患者女性,54岁,仓库工人,既往健康,因进行性体重下降及肠衰竭由外院转诊至本院,拟行家庭
然而,两年前患者开始出现胃肠道传输缓慢症状,表现为
15个月后,因症状进行性加重并出现疑似中毒性巨结肠的急性临床表现,患者接受了全结肠切除术及末端回肠造口术。但术后症状未缓解,首次出院后4天,患者因持续
实验室检查未见明显异常。
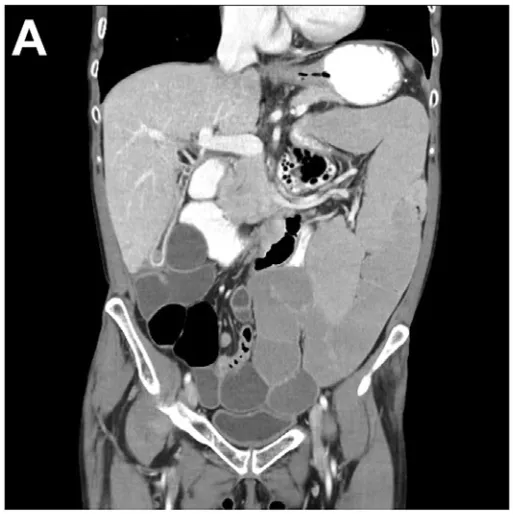
尽管尝试了包括
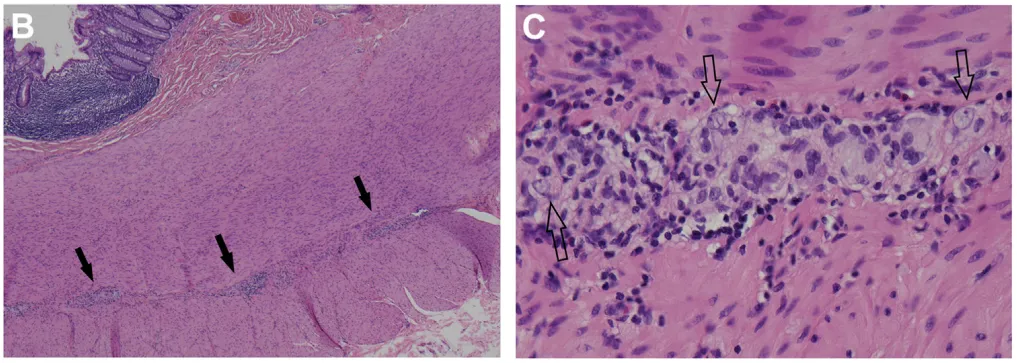
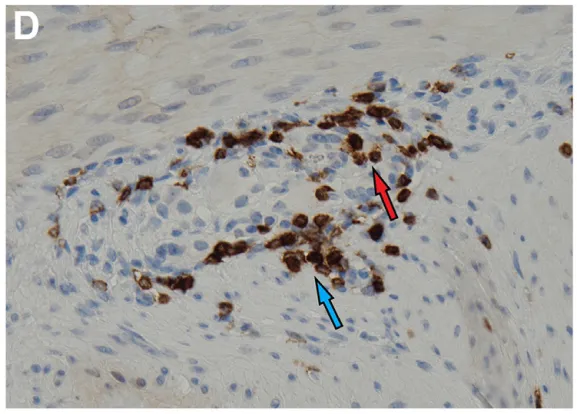
术后标本组织病理学检查显示结肠明显扩张。肠肌间神经丛的显微镜检可见以淋巴细胞为主的免疫细胞广泛浸润神经节及神经,伴局灶性神经元丢失(图B、C)。CD3免疫组化染色显示淋巴细胞侵袭神经节(图D;淋巴细胞围绕[蓝色箭头]并侵入[红色箭头]神经节)。上述病变特征在整个结肠、阑尾及回肠末端均明显可见,且在肠道扩张最明显区域,神经节细胞数量显著减少。
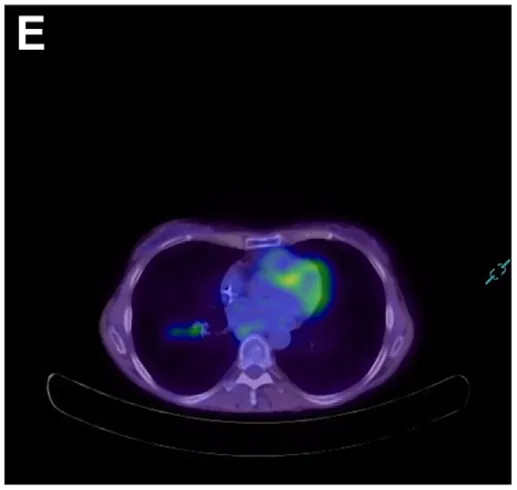
考虑到炎症性肠神经节炎的提示,遂行血清抗神经元抗体检测,结果显示抗神经元核抗体(ANNA)-1/Hu和SOX-1抗体阳性。复查氟代脱氧葡萄糖-PET扫描显示右肺下叶存在明显高代谢病灶,伴同侧纵隔淋巴结受累(图E)。
患者最可能的诊断是什么?
答案揭晓:小细胞
组织病理学检查提示一种罕见的免疫介导性疾病,导致肌间神经丛功能障碍,进而引发肠道动力障碍。临床团队对可能的病因及相关疾病进行了排查,包括感染后因素、结缔组织病及副肿瘤综合征等。抗神经元抗体(尤其是ANNA-1/Hu抗体)阳性与小细胞肺癌(SCLC)及
患者接受了
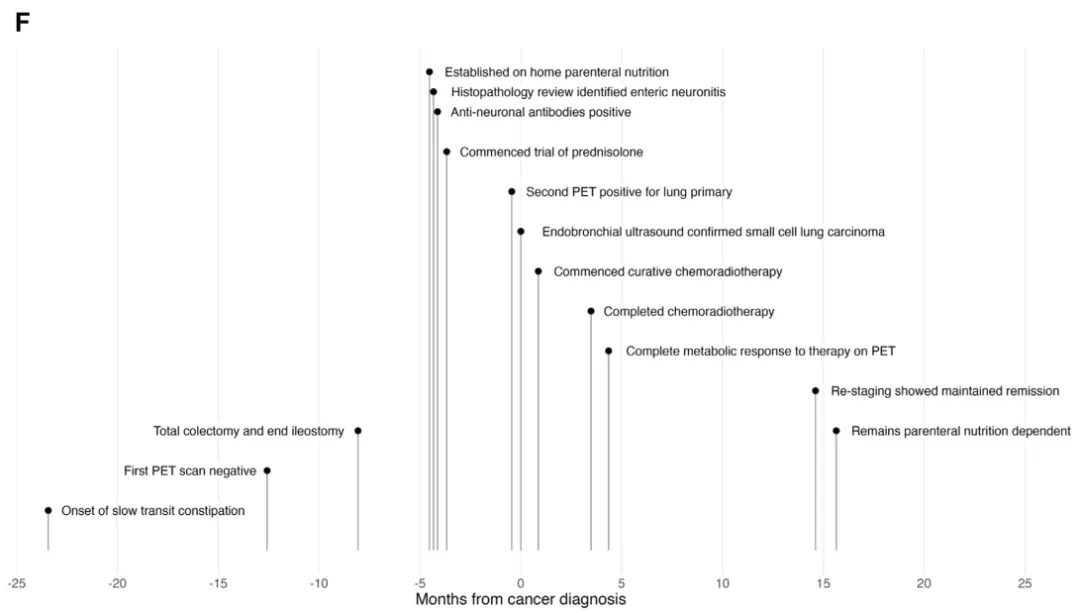
1年后复查影像学检查,患者仍处于缓解状态(图F)。从肠道动力角度来看,大剂量
副肿瘤性神经综合征(PNS)是一组异质性的罕见神经系统疾病,与恶性肿瘤及特定肿瘤神经元抗体相关。由于PNS相对罕见且诊断不足,其流行病学数据有限,据估计其在癌症患者中的发生率约为1/300。累及胃肠道系统的PNS往往影响整个消化道。虽然目前尚无特异性临床特征能可靠区分副肿瘤性与非副肿瘤性胃肠道动力障碍,但总体而言副肿瘤性病例的临床表现通常更严重且进展迅速,患者往往在6个月内出现明显的功能障碍。
在高达80%的病例中,PNS症状先于恶性肿瘤诊断数周至数年出现。一项病例系列研究发现,从胃肠道动力障碍症状出现到SCLC诊断的平均时间为8.7个月。2019年更新的诊断标准将临床表型、抗体状态和恶性肿瘤诊断视为关键诊断依据。目前已报道多种针对肿瘤和神经系统共同表达抗原的抗体,但仅不足50%的患者可检测到此类抗体。尽管抗SOX-1和抗ANNA-1抗体均是与SCLC相关的高危抗体,但抗ANNA-1抗体的存在也被证明与化疗敏感性更高、局限期疾病相关。鉴于高危抗体与癌症的关联性>70%,当其与胃肠道动力障碍并存时,应及时开展隐匿性肿瘤的排查。
针对胃肠道动力障碍的常规药物治疗和免疫抑制疗法总体获益有限。虽然治疗重点在于控制恶性肿瘤,但因肠神经元损伤往往不可逆,癌症缓解后肠道动力通常难以改善。
本例患者有吸烟史和抗ANNA-1/Hu抗体阳性,均为SCLC的危险因素。与文献报道一致,其快速进展的胃肠道动力障碍症状和肠衰竭出现于SCLC诊断之前。
参考文献:
[1]Low ESL, Lokan J, Wong D. A Rare Cause of Rapid Progression to Intestinal Failure. Gastroenterology. 2025 Oct;169(5):781-784.
[2]DiBaise JK. Paraneoplastic gastrointestinal dysmotility: when to consider and how to diagnose. Gastroenterol Clin North Am. 2011 Dec;40(4):777-86.
[3]Graus F, Vogrig A, Muñiz-Castrillo S, Antoine JG, Desestret V, Dubey D, Giometto B, Irani SR, Joubert B, Leypoldt F, McKeon A, Prüss H, Psimaras D, Thomas L, Titulaer MJ, Vedeler CA, Verschuuren JJ, Dalmau J, Honnorat J. Updated Diagnostic Criteria for Paraneoplastic Neurologic Syndromes. Neurol Neuroimmunol Neuroinflamm. 2021 May 18;8(4):e1014.
[4]Lee HR, Lennon VA, Camilleri M, Prather CM. Paraneoplastic gastrointestinal motor dysfunction: clinical and laboratory characteristics. Am J Gastroenterol. 2001 Feb;96(2):373-9.
[5]Sodhi N, Camilleri M, Camoriano JK, Low PA, Fealey RD, Perry MC. Autonomic function and motility in intestinal pseudoobstruction caused by paraneoplastic syndrome. Dig Dis Sci. 1989 Dec;34(12):1937-42.
医脉通是专业的在线医生平台,“感知世界医学

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)