2025年9月17日至20日,第十八届IgA肾病国际研讨会(IlgANN)在捷克布拉格隆重召开,大会全面呈现了免疫球蛋白A肾病(IgAN)领域的最新进展。随着对IgAN的发病机制,即免疫性损伤与慢性肾病(CKD)损伤的认识日渐深入,一系列新型的治疗药物也正在不断涌现。其中,
机制创新:伊普可泮选择性抑制AP途径,拓展IgAN治疗新选择
在IgAN中,半乳糖缺乏的IgA1(Gd-IgA1)形成的免疫复合物沉积于肾脏,局部激活旁路途径(AP)途径,AP过度激活导致肾脏炎症与肾小球损伤,是IgAN重要发病机制之一1。伊普可泮为同类首款、口服近端补体抑制剂,特异性结合B因子并抑制AP途径。抑制B因子可阻断旁路途径相关C3转化酶的活性,从而阻止下游旁路途径C5转化酶的生成,以及C3a、C5a过敏毒素和膜攻击复合物的形成(图1)2,3。
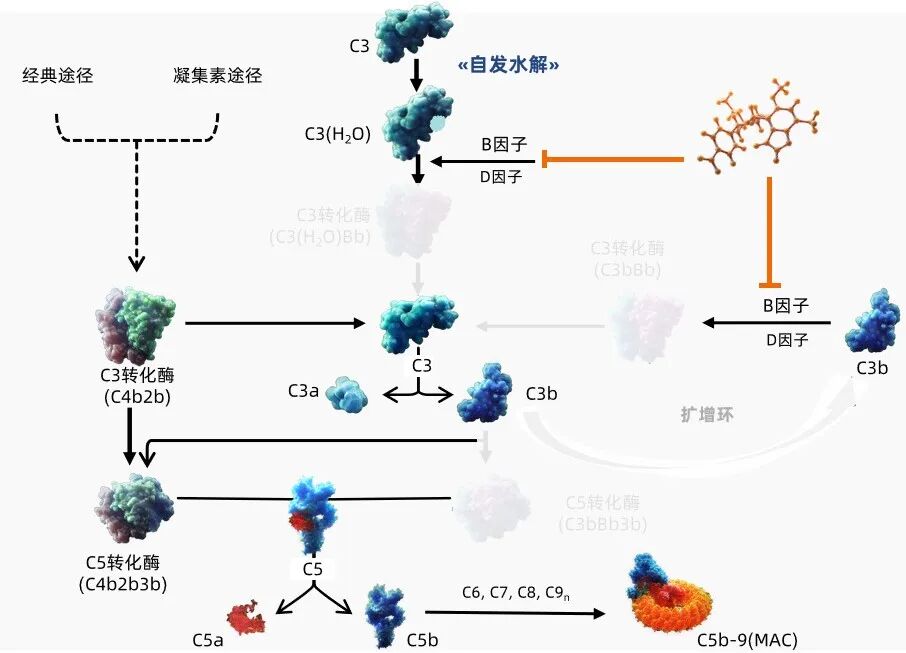
图1 伊普可泮作用机制
本次大会报道了一项IIa期多中心、单臂、开放标签、重复肾活检研究,旨在通过评估肾小球补体激活、肾脏组织学、肾功能及关键生物标志物,探索伊普可泮对IgAN免疫病理学的影响4。研究计划招募20例经活检确诊的IgAN成人患者,主要纳入标准包括:预估肾小球滤过率(eGFR)≥30mL/min/1.73m²、首次晨尿-尿蛋白/肌酐比值(FMV-UPCR)≥0.8g/g,且已接受≥90天最大耐受剂量/稳定剂量的支持治疗(ACEI/ARB和/或SGLT2抑制剂)。患者接受伊普可泮200mg每日两次治疗9个月,并于基线和研究结束时行肾活检(图2)。主要终点为9个月时系膜区C3c及含C3c片段沉积较基线至少降低1级。次要终点为9个月时CD68+细胞与免疫球蛋白较基线的变化。探索性终点为9个月时MEST-C评分较基线的变化;经对数转换的UPCR与基线比值;试纸法

n:受试者数量;EOT:治疗结束;*:符合资格的受试者可进入开放标签扩展研究,具体取决于当地政策。
图2. IIa期、多中心、单臂、开放标签、重复肾活检研究设计
卓有成效:APPLAUSE-IgAN研究低eGFR队列数据彰显伊普可泮治疗潜力
APPLAUSE-IgAN是一项多中心、随机、双盲、安慰剂对照、平行组、III期研究,纳入主要研究人群(基线eGFR≥30mL/min/1.73m²,N=443)用于疗效和安全性分析以及中晚期IgA肾病患者(基线eGFR 20-30mL/min/1.73m²,N=27)以提供额外的药代动力学和安全性信息。
此次会议报道了APPLAUSE-IgAN研究中晚期
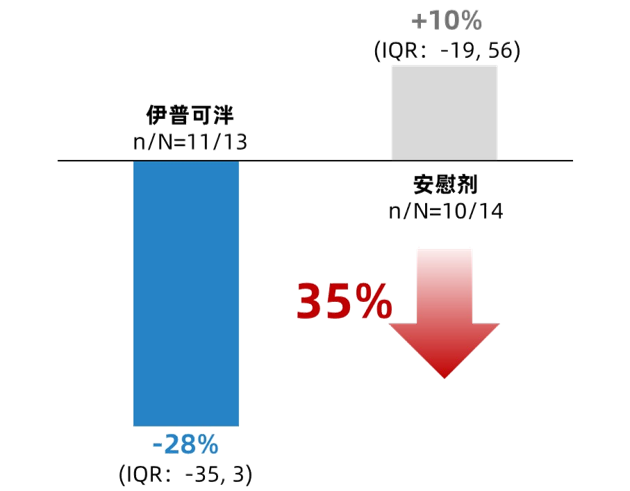
图3. 低eGFR队列:第9个月时24h-UPCR较基线的变化百分比
实力守护:伊普可泮引领IgAN靶向补体治疗新阶段
盐酸伊普可泮胶囊已于2025年9月9日获得中国NMPA(国家药品监督管理局)批准,用于降低有疾病快速进展风险的原发性IgAN成人患者的蛋白尿(一般来说,这类患者的UPCR≥1.5g/g),该适应症的获批是基于APPLAUSE-IgAN III期临床研究的预设中期分析结果。该研究纳入了接受最佳支持治疗(稳定且最大耐受剂量的ACEi或ARB±SGLT2i)≥90天后仍存在蛋白尿(UPCR≥1.0g/g)的原发性IgAN成人患者,结果显示,伊普可泮组与安慰剂组相比,9个月时24h-UPCR显著降低了38.3%(P<0.0001)5。
伊普可泮此次新适应症的获批,标志着中国IgAN治疗正式迈入了靶向补体通路的新阶段。APPLAUSE-IgAN研究数据有力地证实了其临床价值:无论是主要人群还是低eGFR队列,伊普可泮均展现出降低蛋白尿的显著疗效和良好安全性。作为创新口服补体抑制剂,伊普可泮有望为IgAN患者提供有效、稳定的治疗选择,重塑临床治疗格局。
审批码 FAB0054340-113354,有效期为2025-09-18至2026-09-17,资料过期,视同作废
问题:
1:伊普可泮作为口服补体抑制剂,其治疗IgA肾病的主要作用机制是?(B)
A. 直接降解半乳糖缺乏的IgA1(Gd-IgA1)
B. 抑制补体旁路途径中的B因子,阻断C3转化酶的形成
C. 拮抗C5a受体,阻止膜攻击复合物(MAC)的形成
D. 增强经典补体途径的活性
2:APPLAUSE研究低eGFR队列显示,第9个月时伊普可泮组相较于安慰剂组,24小时UPCR相对降低约为多少?(B)
A. 28%
B. 35%
C. 38.3%
D. 50.1%
问卷审批码 FAB0054341-113356,有效期为2025-09-18至2026-09-17,资料过期,视同作废
(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)