2026版《KDIGO 慢性肾脏病贫血管理临床实践指南》共设四章,基于证据评审团队纳入的高质量研究证据,系统梳理贫血与缺铁的诊断及管理方案,为临床实践与医疗决策提供循证指导。医脉通特此整理,以飨读者。
与KDIGO 2012指南一致,贫血采用世界卫生组织标准定义:女性Hb<12 g/dl(<120 g/l),男性< 3 g/dl(<130 g/l),儿童参照年龄特异性阈值(图1)。贫血在CKD患者中高发,且随病情进展患病率攀升,超半数CKD G4、G5期患者受其影响(图 1)。CKD贫血的病理生理机制复杂,涉及相对性促
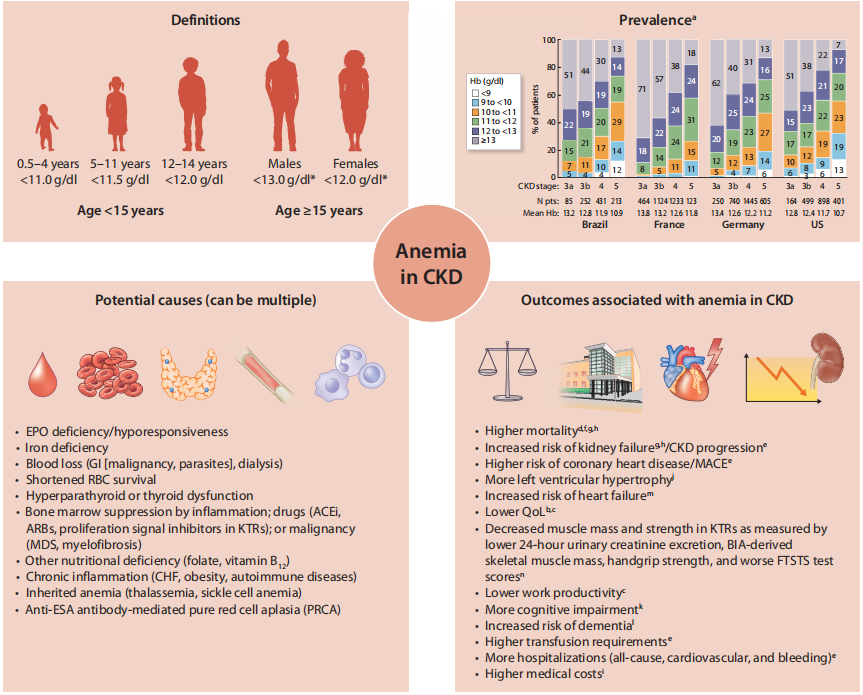
图1 CKD贫血概述
包含贫血的定义、在不同CKD分期中的患病率、潜在病因及相关不良结局。
ACEi:血管紧张素转换酶抑制剂,ARB:血管紧张素 Ⅱ 受体阻滞剂,BIA:生物电阻抗分析,CHF:充血性心力衰竭,EPO:促红细胞生成素,FTSTS:五次坐立试验,GI:胃肠道,Hb:
* 注:图中提供了按年龄、性别划分的贫血诊断临界值。
铁缺乏是导致CKD患者贫血的重要原因,其诱因具有多因素性,包括失血量增加、营养摄入不足、药物干扰膳食铁吸收、铁调素水平过高抑制铁吸收与储备释放,以及ESAs使用引发的铁消耗增加。上述因素共同造成CKD患者两类主要缺铁状态,既往被称为 “绝对性缺铁” 与 “功能性缺铁”。目前KDIGO工作组已将其重新命名为“全身性铁缺乏” (systemic iron deficiency)和“铁限制性红细胞生成” (iron-restricted erythropoiesis),以更准确地反映病理生理状态(图 2)。 "铁限制性红细胞生成"这一术语为以下现象提供了理论依据:即使铁水平高于通常与缺乏相关的水平,补铁治疗也可以增加Hb浓度并减少ESAs需求 。
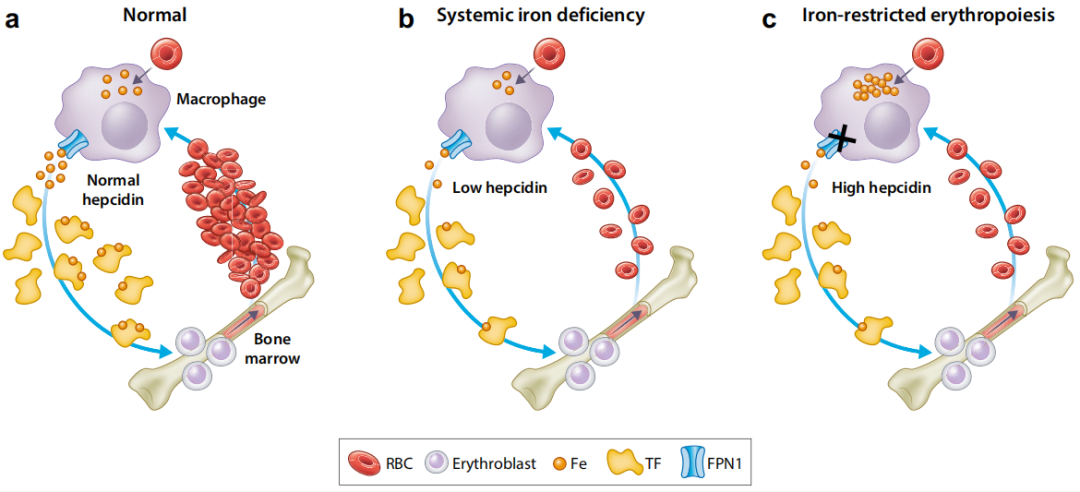
图2 不同铁代谢状态下的全身铁转运示意图
(a)正常生理状态:脾脏巨噬细胞通过吞噬衰老红细胞,经铁转运蛋白1(FPN1)通路释放铁。这些循环铁可与转铁蛋白(TF)结合,继而转运至骨髓用于红细胞生成,补充衰老凋亡的红细胞。
(b)全身性铁缺乏状态:其特征为循环铁与储存铁水平均降低。对于非透析CKD患者,诊断标准一般为TSAT<20%且铁蛋白<100 ng/ml(<100 mg/L);对于
(c)铁限制性红细胞生成状态:其特征为储存铁充足但循环铁水平降低,进而限制红细胞生成,诊断标准一般为铁蛋白>100~200 ng/ml(>100~200 mg/L)且TSAT<20%。此类状态下,巨噬细胞虽可通过吞噬红细胞获得足量回收铁,但炎症诱导的铁调素升高会导致铁在巨噬细胞内滞留,无法释放入血;最终引发转铁蛋白饱和度降低,以及血红蛋白含量正常的贫血。
多项观察性研究表明,缺铁与死亡率及主要不良心血管事件风险升高、健康相关生活质量下降及神经认知功能受损相关(图3)。其中数项研究指出,缺铁与不良结局的关联独立于贫血状态存在。支持缺铁对临床结局存在因果效应最有力证据源自"血液透析患者主动性静脉铁剂治疗(PIVOTAL)试验"。该试验在接受ESAs治疗的CKD G5期血液透析患者中评估了不同静脉铁剂治疗策略。PIVOTAL试验证实,与低剂量反应性补铁策略相比,高剂量主动性补铁策略可改善心血管结局并降低死亡率。这些数据为CKD患者缺铁的诊断与治疗提供了依据。
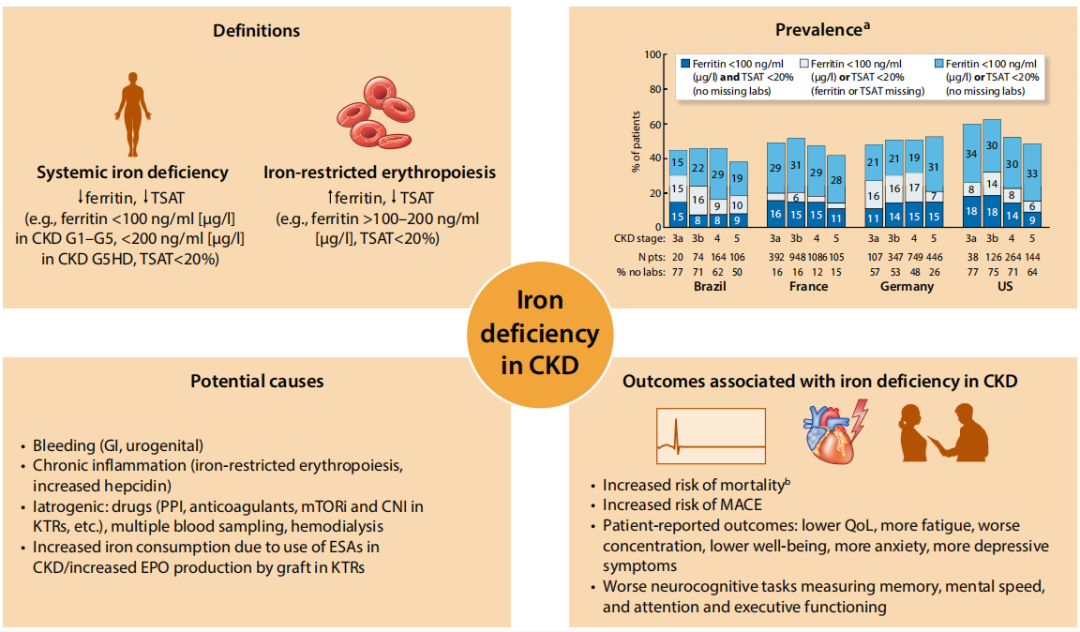
图3 CKD铁缺乏概述
涵盖铁缺乏的定义、在不同CKD分期中的患病率、潜在病因及相关结局。
CKD G5HD:血液透析治疗的5期慢性肾脏病,CNI:钙调磷酸酶抑制剂,EPO:促红细胞生成素,ESA:促红细胞生成刺激剂,GI:胃肠道,KTR:肾移植受者,MACE:主要不良心血管事件,mTORi:哺乳动物雷帕霉素靶蛋白抑制剂,PPI:质子泵抑制剂,QoL:生活质量,TSAT:转铁蛋白饱和度
CKD患者应在转诊时、出现疑似贫血症状时以及随访期间定期进行贫血和缺铁检测。建议检测频率为:CKD G3期至少每年一次,G4期每年两次,G5期或接受透析的G5期患者每三个月一次。监测指标应包括
若初始检测未明确病因,医疗人员应根据情况考虑扩展检测项目,包括血涂片检查、结合珠蛋白、乳酸脱氢酶、C-反应蛋白、维生素B12、叶酸、肝功能检查、血清蛋白电泳及免疫固定、血清游离轻链、尿本周氏蛋白、促甲状腺激素和粪便潜血试验。如果临床指征需要,也可以参考《KDIGO CKD评估与管理临床实践指南(2024 版)》,检测甲状旁腺激素水平。
对于原因不明的缺铁患者,尤其是铁蛋白<45 ng/ml (<45 µg/l) 或小细胞性贫血(平均红细胞体积<80 fl)患者,医疗人员应考虑评估失血情况,并根据需要转诊至专科进一步诊治(图4、图5)。
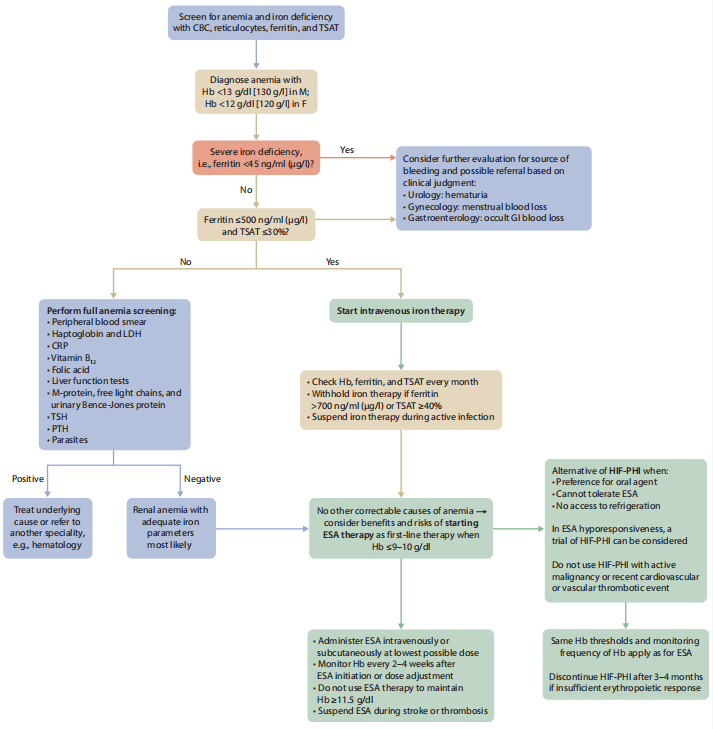
图4 血液透析治疗的CKD G5患者贫血管理方案
CBC:全血细胞计数,CRP:C反应蛋白,ESA:促红细胞生成刺激剂,F:女性,GI:胃肠道,Hb:血红蛋白,HIF-PHI:低氧诱导因子脯氨酰羟化酶抑制剂,LDH:乳酸脱氢酶,M:男性,PTH:甲状旁腺激素,TSAT:转铁蛋白饱和度,TSH:促甲状腺激素
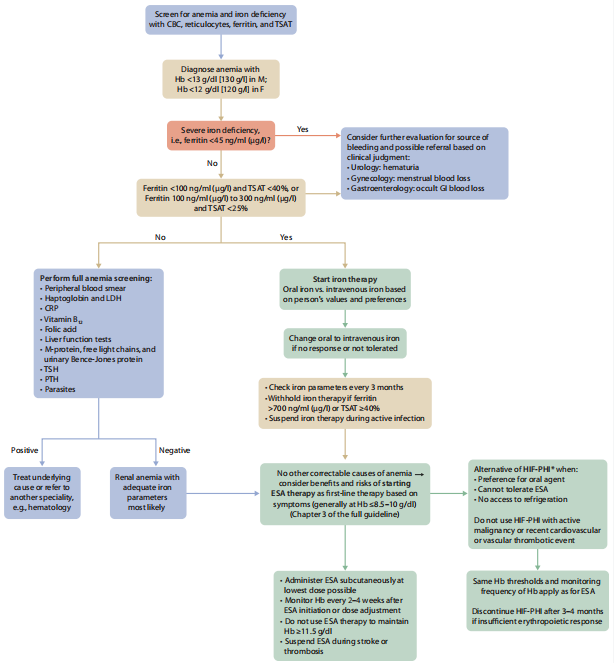
图5 非透析CKD患者的贫血管理方案
CBC:全血细胞计数,CRP:C 反应蛋白,ESA:促红细胞生成刺激剂,F:女性,GI:胃肠道,Hb:血红蛋白,HIF-PHI:低氧诱导因子脯氨酰羟化酶抑制剂,LDH:乳酸脱氢酶,M:男性,PTH:甲状旁腺激素,TSAT:转铁蛋白饱和度,TSH:促甲状腺激素
*注:尽管低氧诱导因子脯氨酰羟化酶抑制剂尚未获得美国食品药品监督管理局(FDA)批准用于该人群,但已被其他监管机构批准上市。
补铁的目标是维持充足的铁储备以支持红细胞生成或刺激促红细胞生成反应,同时最大限度减少铁过量相关潜在风险(包括感染及氧化应激介导的组织损伤)。然而,关于关键临床结局的随机对照试验数据有限,因此,关于Hb水平、ESAs或HIF-PHIs剂量与补铁之间的理想平衡,以及启动补铁的最佳阈值和治疗目标,仍存在不确定性。
在PIVOTAL试验中,对于接受ESAs治疗的CKD G5HD患者,与仅在铁蛋白<200 ng/ml(<200 μg/L)或TSAT <20%时采取反应性低剂量铁剂(0-400 mg/月)治疗相比,采用主动性高剂量静脉蔗糖铁(400 mg/月,除非铁蛋白>700 ng/ml[>700 μg/L]或TSAT ≥40%)的治疗方案可适度降低死亡及主要心血管事件风险,且未增加感染或其他不良事件风险。主动性高剂量治疗组患者的输血需求和ESAs用量也更低。需特别指出的是,此类结局的驱动因素尚不明确:是缺铁纠正本身、 ESAs剂量降低、二者协同作用,还是其他机制所致?同时,高剂量铁剂主动干预方案是否为最优选择,或是介于PIVOTAL试验对比的两种方案之间(甚至更积极的方案)效果更佳,也尚无定论。但临床前研究及观察性数据提示,更积极的铁剂方案可能增加死亡与感染风险。
对于合并贫血的CKD G5HD患者,当铁蛋白≤500 ng/ml(≤500 μg/L)且TSAT ≤30%时,建议启动铁剂补充治疗——该标准与KDIGO 2012贫血指南及PIVOTAL等该人群关键研究的纳入阈值一致。对于合并贫血的非透析CKD患者,建议在以下两种情况之一时启动铁剂治疗:铁蛋白<100 ng/ml(<100 μg/L)且TSAT<40%,或铁蛋白介于100-300 ng/ml(100-300 μg/L)之间且TSAT<25%。对于所有接受铁剂治疗的CKD患者,若铁蛋白>700 ng/ml(>700 μg/L)或TSAT≥40%,暂停常规铁剂治疗是合理的。虽然认为HIF-PHIs可能提高铁利用度并降低铁剂需求,但目前尚无充分数据支持对接受HIF-PHIs治疗的患者采用与ESAs不同的阈值 。
对于无贫血但存在严重缺铁的CKD患者(铁蛋白<30 ng/ml[<30 μg/L]且TSAT<20%),尤其是伴有相关症状时,也可考虑铁剂治疗。目前认为,铁除参与Hb合成外,还在电子传递链能量生成、DNA合成、细胞增殖分化等多项生物学过程中发挥关键作用。此外,研究证实缺铁与CKD患者不良结局独立相关。同时,多项针对心力衰竭患者(含合并CKD亚组)的随机对照试验表明,独立于贫血纠正的补铁治疗,可改善患者功能状态并减少住院风险。
对于启动铁剂治疗的贫血CKD G5HD患者,建议采用静脉铁剂而非口服铁剂。对于担心过敏反应或受限于静脉铁剂可及性及成本的患者,可考虑口服铁剂。在接受静脉铁剂治疗的CKD G5HD患者中,建议每1-3个月(或根据临床指征提高频率,如启动或增加ESAs/HIF-PHI剂量、发生已知失血事件、近期住院、TSAT或铁蛋白显著升高、或超过目标上限时)监测TSAT、铁蛋白和Hb水平。
对于合并贫血的非透析CKD患者,建议根据患者的价值观与偏好、贫血与缺铁程度,以及不同给药途径的相对疗效、耐受性、可及性和成本,选择口服或静脉铁剂。口服铁剂因其成本低廉、易于获取、无需静脉通路或医院就诊,且有助于为动静脉内瘘建立保留静脉资源,可能更适合部分患者。耐受性也是选择口服或静脉铁剂的重要影响因素:口服铁剂常因胃肠道副作用而限制剂量调整,静脉铁剂的过敏反应虽不常见但可能危及生命。对于接受铁剂治疗的非透析CKD患者,建议至少每3个月(或根据上述指征提高频率)监测TSAT、铁蛋白和Hb水平。对于口服铁剂治疗者,若1-3个月后疗效不足或耐受性差,建议转为静脉铁剂治疗。
需注意的是,某些静脉铁剂(羧基麦芽糖铁、含糖氧化铁及多麦芽糖铁)会通过与其碳水化合物载体相关的未知机制提升完整成纤维细胞生长因子23水平,从而导致低磷血症及骨骼并发症。因此,接受此类制剂治疗的患者(尤其是早期CKD患者、肾移植受者及重复给药者)应监测血磷水平。
铁是多种病原体生长的必需元素,临床前数据表明铁剂可能加重特定感染的不良结局,建议在全身性感染期间暂缓铁剂治疗。过敏反应是静脉铁剂的罕见并发症,首次静脉铁剂给药必须在具备处理急性过敏及低血压反应能力的场所进行,且单次剂量不应超过推荐上限。若发生轻度或中度反应,应暂停输注:对非特异性症状无需额外处理;对轻度或中度输注反应可给予皮质类固醇或抗组胺药物(可联合或不联合静脉补液)。若症状缓解,建议以降低25%-50%的速率重启铁剂输注。对于较强过敏反应患者可考虑更换铁剂类型。若发生严重类过敏反应需立即规范救治,并避免再次使用静脉铁剂。
需开展更多研究评估不同铁剂给药方案在非透析CKD患者及CKD G5HD患者中的获益与风险,目标铁蛋白与TSAT水平应涵盖中等范围及高于PIVOTAL试验研究的阈值。还需研究针对以下人群的最佳铁剂方案:使用HIF-PHIs治疗的CKD贫血患者、无贫血的CKD缺铁患者及妊娠合并CKD者。应比较新型口服铁剂与传统口服/静脉铁剂的疗效,并对隔日与每日一次口服给药方案进行对比。需进一步研究评估接受铁剂治疗的CKD患者中铁过载的患病率(包括采用新型生物标志物与影像技术),并明确与毒性相关的阈值水平。
ESAs虽能改善贫血相关疲劳、降低红细胞输注风险,但无法减少CKD贫血患者的不良心血管结局,对生活质量亦无显著改善作用。在维持性血液透析患者中,证据明确显示:以较高Hb水平(如≥13 g/dl [≥130 g/L])为靶目标使用ESAs,会增加卒中、血管通路失功等心血管事件风险。
启动ESAs治疗前,需确保患者铁储备充足,并排查、纠正其他可逆性贫血病因;部分患者经上述处理后,或可无需启动ESAs。对于维持性透析患者,Hb≤9–10 g/dl(≤90–100 g/L)是合理的启动阈值。指南建议,ESAs启动需综合评估患者整体健康状况、合并症及个人意愿:近期卒中、血液透析通路反复血栓形成等不良事件高风险人群,可延迟至Hb接近9.0 g/dl(90 g/L)甚至更低时启动;心血管风险低但运动能力下降、贫血症状明显,或高度重视避免输血(如拟行肾移植)的患者,可在Hb接近10.0 g/dl(100 g/L)时启动。
非透析CKD患者启动ESAs的Hb阈值,需结合贫血相关症状、高Hb水平的潜在获益及输血或ESAs治疗的潜在风险个体化设定。多数患者的启动阈值宜设为 8.5–10.0 g/dl(85–100 g/L);合并心血管疾病、血栓栓塞性疾病或恶性肿瘤(尤其是以治愈为目标的活动性恶性肿瘤)者,可考虑更低阈值;儿童、肾移植候选人及存在贫血症状的患者,则可酌情设定更高阈值。
对于接受ESAs治疗的成人患者,指南推荐目标Hb≤11.5 g/dl(≤115 g/L),通常维持在10-11.5 g/dl(100-115 g/L)区间。该目标范围的设定旨在权衡较高Hb的潜在获益与风险,包括Hb>11.5 g/dl(>115 g/L)时高血压风险增加,以及更高目标值带来的血管事件风险。
对于接受ESAs治疗的儿童患者,Hb目标应个体化设定。儿童特有的临床因素包括发育与心理因素、较低的心血管事件风险,以及避免同种致敏以利于肾移植可能更为重要。因此,儿童的最佳Hb目标尚未明确,医护人员需审慎考量如何将成人建议调整应用于肾病患儿。
在接受维持性血液透析的患者中, ESAs可经皮下或静脉途径给药;而对于其他类型CKD患者,皮下给药途径是优选。对于依泊汀 (epoetin),皮下途径更有效,但对于达依泊汀α (darbepoetin alfa),两种给药途径的剂量需求无显著差异。
指南建议,针对成人及儿童患者,需通过调整ESAs 剂量逐步提升Hb水平,避免其在任意两周内增幅超过1 g/dl(10 g/L)。若出现上述快速上升情况,应将ESAs剂量下调25%–50%;当Hb超过 11.5 g/dl(115 g/L)时,优先减药而非停药。
急性卒中、血管通路血栓形成或血栓栓塞事件的住院期间,应考虑暂停ESAs治疗。出院后重启治疗,需经医患共同决策,充分权衡获益与风险后再实施。
特定癌症患者相关研究显示,ESAs治疗贫血可能增加癌症进展及死亡风险。因此,对于合并CKD、贫血且伴活动性癌症或癌症病史的患者,医护人员需结合患者意愿及预期临床结局,审慎决定是否启动或继续ESAs治疗,尤其当癌症治疗以治愈为目标时。
指南将CKD合并ESAs低反应性定义为“即使显著增加ESAs剂量仍无法达到目标Hb水平,或需持续高剂量维持目标”的患者群体。建议医疗人员识别并处理潜在病因,包括缺铁、慢性炎症导致的铁利用障碍、透析充分性不足及隐匿性失血。
HIF-PHIs为口服制剂,通过稳定低氧诱导因子转录因子促进内源性ESAs生成。现有证据表明,在CKD相关贫血患者中,HIF-PHIs治疗可达到与ESAs治疗相当的Hb水平。基于ESAs长期临床应用经验及其升Hb疗效的确证性,指南建议,对于已纠正可逆病因但仍需进一步提升Hb的患者,优先选择ESAs而非HIF-PHIs 。
指南重点指出两种可考虑使用HIF-PHIs 的情况:
(1) ESAs 低反应或不耐受;
(2) ESAs 使用受限(如存在肠外给药障碍)。
需注意的是,尽管少量研究提示,在炎症标志物升高的患者中,HIF-PHIs的剂量递增需求可能低于ESAs,但其在ESAs低反应人群中的安全性与获益尚未明确。无论何种情况,医护人员均应与拟接受治疗的患者充分讨论HIF-PHIs的风险获益,并重点排查多囊肾病、增殖性视网膜病变、肺动脉高压、妊娠等可能增加不良事件理论风险的基础疾病或状态。对于选择尝试HIF-PHIs的患者,其用药原则基本参照ESAs治疗建议。鉴于缺乏联合治疗的安全性与有效性临床数据,指南不建议同时使用ESAs与HIF-PHIs 。
需开展更多研究以指导维持性腹膜透析患者、肾移植受者及所有CKD分期儿童患者的优化ESAs应用。需在CKD G5D及非透析CKD成人与儿童患者中,比较HIF-PHIs与 ESAs治疗的长期风险与获益。
红细胞输注在普通人群中存在明确不良反应,包括输血相关循环超负荷、急性肺损伤、免疫致敏及溶血性输血反应等。CKD患者还需格外警惕输注后可能引发的同种免疫反应,此类反应或降低未来肾移植的适配性。但上述危害大多发生率较低,临床决策时需与未纠正严重贫血所致的心肌缺血、失代偿性心力衰竭甚至死亡等风险进行综合权衡。
对于合并急性危及生命贫血的CKD患者,若需快速纠正贫血以稳定病情(如急性出血、不稳定性冠心病),指南建议输注红细胞。此外,严重贫血患者拟行术中出血量较大的手术时,可考虑术前输注红细胞以提升Hb水平。
对于合并慢性贫血的CKD患者,以下两类人群输注红细胞的利大于弊:
(1) ESAs或HIF-PHIs治疗无效者(如血红蛋白病、骨髓衰竭、 ESAs或HIF-PHIs低反应性患者);
(2) ESAs或HIF-PHIs治疗可能有害者(如既往或当前罹患恶性肿瘤、既往卒中病史的患者)。
在任何延迟纠正贫血可能导致不良结局或死亡的急性临床情况下(如严重急性出血、不稳定性冠心病、或预计将发生大量出血的限期手术),均应考虑红细胞输注。非急症情况时,指南强调需以CKD患者贫血相关体征与症状作为输注决策的首要依据,而非机械套用Hb阈值。同时建议以下情况可予输注:无症状且血流动力学稳定的成年住院患者Hb<7 g/dl(<70 g/L);心脏手术患者Hb<7.5 g/dl(<75 g/L);骨科手术或合并明显心血管疾病患者Hb<8 g/dl(<80 g/L)。
指南指出,若在医疗系统层面及个体患者中广泛实施相关策略,可减少CKD患者的红细胞输注需求。示例性策略包括:建立早期发现与纠正缺铁的标准化流程;规范静脉铁剂与ESAs的指南依从性应用;开展患者贫血管理方案教育;以及采用决策辅助工具帮助患者根据自身价值观与偏好,就红细胞输注使用做出知情决策。
在CKD人群中,需开展前瞻性观察性研究以探究当前红细胞输注的临床应用现状,包括输注指征、后续同种免疫风险及输注受者的肾移植接受情况。跨区域比较有助于明确CKD贫血管理的最佳实践,从而确定降低输血风险的路径。需进一步研究红细胞处理与储存的优化方法及其对临床结局(包括同种免疫与移植后结局)的影响。
参考文献
Babitt JL, et al. Executive Summary of the KDIGO 2026 Clinical Practice Guideline for the Management of Anemia in Chronic Kidney Disease (CKD). Kidney Int. 2026 Jan;109(1):44-56. doi: 10.1016/j.kint.2025.06.005.
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。仅供HCP观看。

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)