

前言

研究背景
近年来,免疫检查点抑制剂(ICIs)在转移性MSI-H/dMMR结直肠癌中展现的令人鼓舞的疗效,推动了其在局部晚期肿瘤新辅助治疗中的探索。但迄今为止,尚无免疫检查点抑制剂获批用于局部晚期MSI-H/dMMR结肠癌的新辅助治疗,尤其是双免疫联合方案是否较免疫单药在新辅助治疗中可提供额外临床获益仍未明确。
本研究通过一项随机1b期试验,评估信迪利单抗联合IBI310或信迪利单抗单药作为局部晚期MSI-H/dMMR结肠癌新辅助治疗的安全性和有效性。
研究方法
本研究是一项随机对照、开放标签、多中心1b期临床试验,研究纳入局部晚期可切除MSI-H/dMMR结肠癌患者,随机分配至联合治疗组(接受IBI310+信迪利单抗治疗,共2个治疗周期)或单药治疗组(接受信迪利单抗单药治疗)。新辅助治疗后进行手术评估。主要终点为改良意向治疗人群(mITT)的病理完全缓解(pCR)率,次要终点包括无事件生存期(EFS)、总生存期(OS)、R0切除率和安全性。
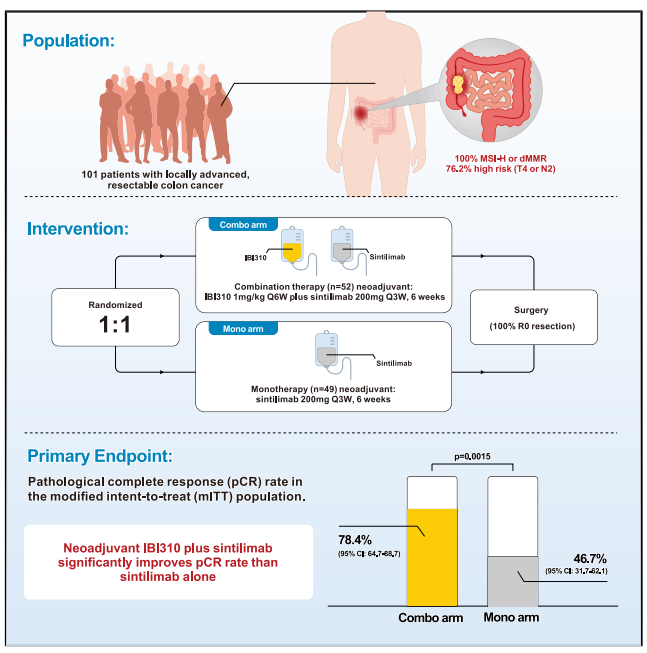
图1.研究方案设计
研究结果
►患者基线特征
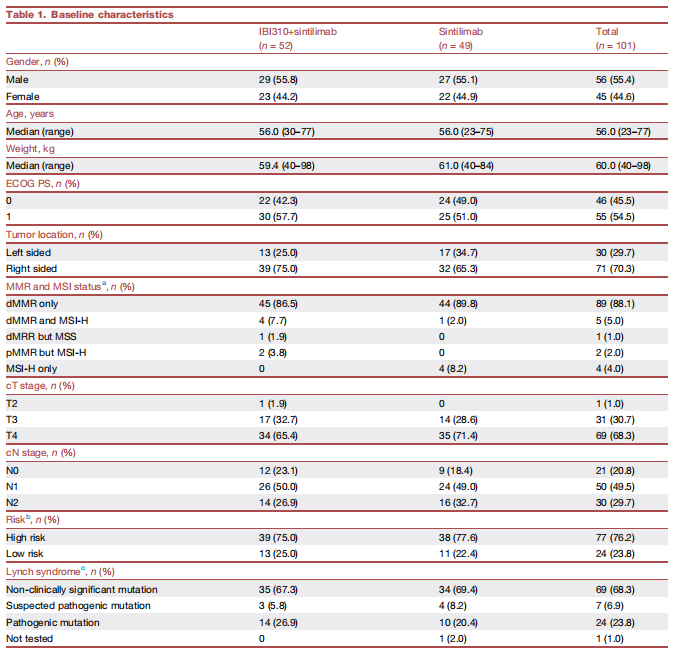
2023年5月26日至2025年6月17日,27个研究中心共纳入101例患者,中位年龄为56岁,两组患者的基线特征均衡可比(表1)。
表1.入组患者基线特征
►疗效分析结果
截至2025年6月17日,中位随访时间为21.4个月。在mITT人群中:联合治疗组pCR率为78.4%,单药治疗组为46.7%,新辅助IBI310联合信迪利单抗较信迪利单抗单药显著提高pCR率。在ITT和符合方案(PP)人群中均观察到一致的pCR结果。
在mITT人群中,亚组分析(年龄、体重、ECOG体力状况评分、基线风险等)显示联合治疗组pCR率改善趋势一致。携带林奇综合征致病性/疑似致病性突变患者:两组间pCR率相近(联合治疗组75.0% vs单药治疗组71.4%)。
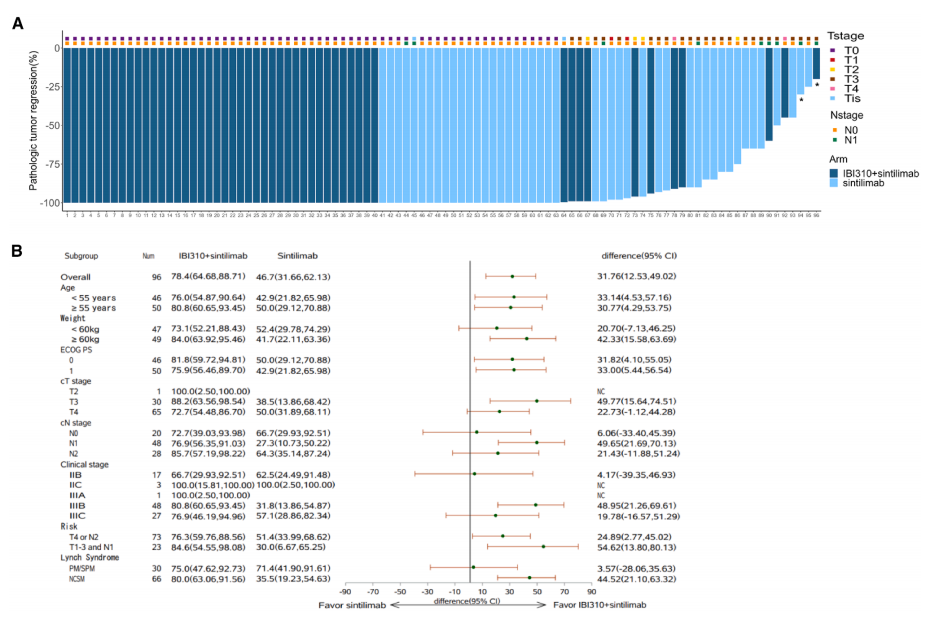
图2.主要研究终点-pCR率
截至2025年6月17日,EFS和OS数据尚未成熟。
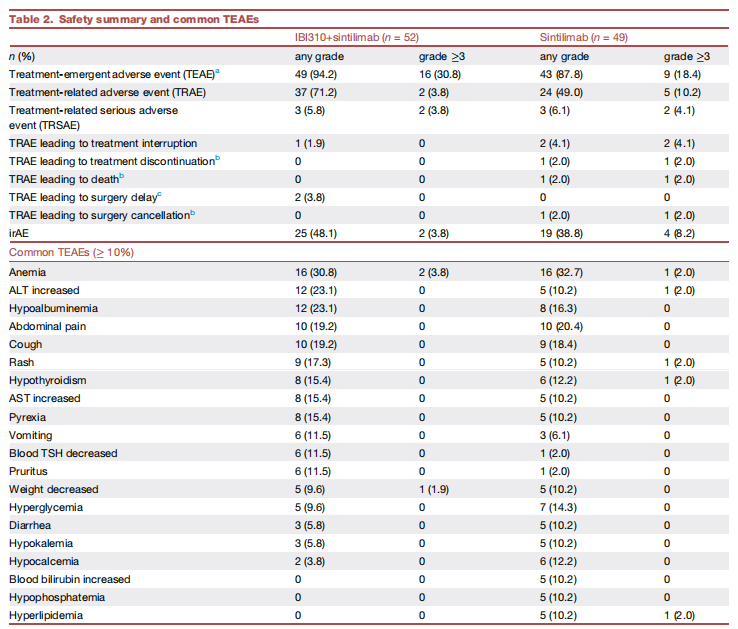
►安全性分析结果
安全性方面,两组治疗相关不良事件(TRAEs)发生率分别为71.2%和49.0%,多数TRAEs为1-2级,≥3级TRAEs发生率分别为3.8%和10.2%。联合治疗组最常见的3种治疗期间出现的不良事件(TEAEs)为
免疫相关不良事件(irAEs)发生率在联合治疗组为48.1%(25/52),单药治疗组为38.8%(19/49)。联合治疗组≥3级irAEs共2例,包括免疫介导性
表2.安全性分析
研究结论
本随机对照1b期研究结果显示,对于局部晚期MSI-H/dMMR结肠癌患者,新辅助IBI310联合信迪利单抗治疗较信迪利单抗单药显著提高pCR率且安全性特征具有可比性,未发现新的安全性信号。该研究有望为IBI310联合信迪利单抗作为MSI-H/dMMR结肠癌潜在新辅助治疗方案提供更多证据支持。
参考文献:
Wang F, et al. Neoadjuvant treatment of IBI310 plus sintilimab in locally advanced MSI-H/dMMR colon cancer: A randomized phase 1b study. Cancer Cell. 2025 Oct 13;43(10):1958-1967.e2. doi: 10.1016/j.ccell.2025.09.004. Epub 2025 Oct 2. PMID: 41043438.
撰写:Ariel
审核:Aurora
排版:Aurora
执行:Aurora

(本网站所有内容,凡注明来源为“医脉通”,版权均归医脉通所有,未经授权,任何媒体、网站或个人不得转载,否则将追究法律责任,授权转载时须注明“来源:医脉通”。本网注明来源为其他媒体的内容为转载,转载仅作观点分享,版权归原作者所有,如有侵犯版权,请及时联系我们。)